左卡尼汀联合美托洛尔治疗缺血性心肌病心力衰竭的临床研究
缺血性心肌病(ischemic cardiomyopathy,ICM)是指由于心肌供血不足导致心肌梗死、萎缩或营养障碍性疾病,其临床特点表现为心脏逐渐扩大,继而发生心律失常和心力衰竭(heart failure,HF)。HF具有较高的致残率和致死率,已成为亟待解决的公共卫生问题[1]。美托洛尔是临床治疗HF的常用药物,属β受体阻滞剂,对降低HF病人的病死率及住院率具有重要作用。近年来研究发现心肌能量代谢失衡是ICM HF的发生机制之一,左卡尼汀为人体能量代谢必需的天然物质,通过调节脂类参与能量代谢,可调节心肌能量代谢失衡[2]。
既往研究发现,ICM HF的发生发展与N氨基末端脑钠肽前体(N- terminal pro- brain natriuretic peptide,NT- proBNP)密切相关,NT- proBNP可反映心脏收缩能力,常作为判断HF病人预后有效指标之一[3]。有研究表明,心功能分级与血清炎性因子水平呈显著正相关,炎性因子通过影响心肌收缩性能,促进心肌纤维化或凋亡,造成持续的心肌重塑[4],白细胞介素(interleukin,IL)- 6是由成纤维细胞和活化T细胞分泌的促炎细胞因子,对HF具有较强的预示作用[4]。肿瘤坏死因子(tumor necrosis factor,TNF)- α主要由内皮因子和巨噬细胞产生的炎性因子,具有促进炎性细胞活化和聚集的作用[5]。本研究以我院2014年1月—2016年10月收治的ICM HF病人为研究对象,探讨应用左卡尼汀联合美托洛尔治疗ICMHF的临床效果及对病人心功能和血清IL- 6、TNF- α、NT- proBNP水平的影响,现报道如下。
1 资料与方法
1.1 临床资料 选取我院2014年1月—2016年10月收治的ICM HF病人166例,入选标准:①符合《缺血性心肌病的诊断及治疗策略》关于ICM诊断标准[6]和《中国心力衰竭诊断和治疗指南》(2014年版)关于HF的诊断标准[7],并经临床表现、心电图检查等综合判断确诊;②年龄18岁~75岁;③有明确心肌缺血病史;④纽约心脏病协会(NYHA)分级Ⅱ级~Ⅳ级[7];⑤自愿受试,签署知情同意书;⑥能遵医嘱服药、接受定期随访,依从性高。排除标准:①由扩张型心肌病、心脏瓣膜病、肥厚梗阻性心肌病、重症心肌炎所致充血性心力衰竭;②过敏体质或对本研究使用药物过敏;③合并精神疾患及严重造血、肝肾、心脑血管系统等原发性疾病;④有药物或酒精滥用史;⑤合并变异型心绞痛、急性心肌梗死急性期;⑥近3个月内有本研究相关药物使用史;⑦依从性差,无法配合治疗方案;⑧失访、未按规定用药等临床资料不全;⑨哺乳或妊娠期妇女。采取随机数字表法均分为两组。观察组83例,男51例,女32例;年龄59.9岁±7.5岁;NYHA分级:Ⅱ级25例,Ⅲ级34例,Ⅳ级24例。对照组83例,男50例,女33例;年龄60.4岁±7.4岁;NYHA分级:Ⅱ级26例,Ⅲ级35例,Ⅳ级22例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究获得我院医学伦理委员会同意。
1.2 方法 两组病人均给予常规抗ICM治疗,同时给予病人常规抗HF药物(地高辛、利尿剂、硝酸酯类、醛固酮抑制剂、低分子肝素)治疗。对照组:采用酒石酸美托洛尔片(阿斯利康制药,国药准字H32025391,规格:每片25 mg)治疗,初始剂量每日7 mg,每日2次,随病情进展调整剂量,最大不超过每日80 mg。观察组在对照组基础上,加用左卡尼汀注射液(哈尔滨松鹤制药,国药准字H20041120,规格:每支1.0 g)治疗,左卡尼汀注射液4.0 g加入50 mL生理盐水,微量泵30 min内完成静脉输注,每日1次。两组均连续治疗14 d。
1.3 观察指标
1.3.1 疗效判定标准[8]显效:临床症状显著改善,心功能改善2级以上;有效:临床症状一定程度上有所好转,心功能发改善1级以上;无效:临床症状无任何变化,心功能无改善甚至加重。
1.3.2 心功能指标 所有病人分别于治疗前、治疗14 d后进行超声心动图检查,检查仪器运用彩色超声心动图仪(美国通用,型号Vivid7),检测指标包括每搏输出量(SV)、左室射血分数(LVEF)、心排出量(CO)。
1.3.3 血清学指标检测 于治疗前和治疗14 d后抽取空腹肘静脉血5 mL,离心取上清液,并于-80 ℃冰箱中保存,待检;仪器为全自动酶标仪(德国拜发,型号RT2100C),血清NT- proBNP水平使用免疫层析法检测,IL- 6、TNF- α水平使用酶联免疫法检测,试剂盒均购自上海朗顿生物科技;以上各项指标操作流程均严格按照试剂盒配套说明书执行。

2 结 果
2.1 两组临床疗效比较 治疗14 d后,观察组总有效率较对照组明显升高(P<0.05)。详见表1。
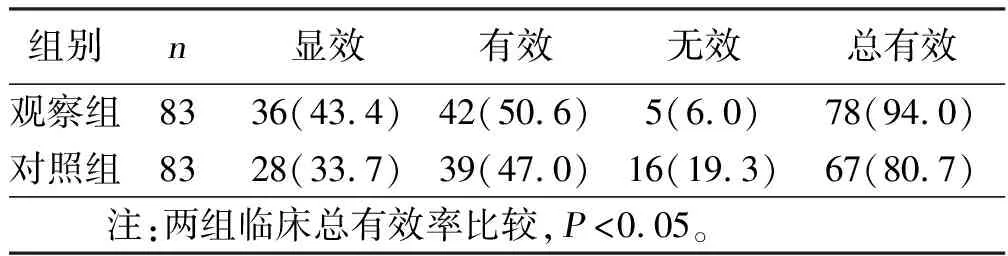
表1 两组临床疗效比较 例(%)
2.2 两组病人治疗前后心功能指标比较 与治疗前比较,两组治疗14 d后心功能指标SV、LVEF、CO值均升高(P<0.01);且观察组各指标值均高于对照组更显著(P<0.01)。详见表2。
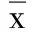
表2 两组病人治疗前后心功能指标比较(±s)
2.3 两组病人治疗前后血清指标比较 与治疗前比较,两组治疗14 d后血清IL- 6、TNF- α、NT- proBNP水平均降低(P<0.01);且观察组改善较对照组更显著(P<0.01)。详见表3。
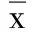
表3 两组病人治疗前后血清指标比较(±s)
3 讨 论
近年来,随着临床循证医学的深入发展,ICM HF的治疗观念从增加心肌收缩力、改善临床症状转变为抑制神经内分泌因子的过度激活、改善心肌重塑的治疗方案。现代医学认为心肌细胞能量代谢障碍在HF病理过程中起到重要作用,改善心肌细胞的能量代谢对保护心肌细胞功能具有重要作用[8]。有研究发现引起HF病因众多,常见的是心血管系统疾病、呼吸系统疾病、内分泌系统疾病、血液系统疾病等,其中以心血管系统疾病为主要原因[9]。
目前针对ICM HF的药物治疗主要是在常规治疗ICM药物基础上联合应用控制HF药物。美托洛尔是具有高选择性β1肾上腺素受体阻滞剂,其治疗ICM HF的机制为[10- 11]:①通过延缓心室收缩率以改善左心室充盈状态,提高舒张末期容量,以达到提高心肌收缩力,改善左心室收缩功能目的;②通过降低血浆中儿茶酚胺的容量,减少儿茶酚胺对心肌的损伤,以起到心肌保护作用;③通过降低心率,减少心肌耗氧量。动物实验显示,美托洛尔可有效抑制HF大鼠模型心肌梗死后的心肌纤维化[12]。临床研究显示,美托洛尔能显著降低病人血清IL- 6、TNF- α水平,改善心功能分级,且安全可靠[13]。左卡尼汀是动物能量代谢中不可或缺的天然类物质,作为脂肪酸转运载体,可促进脂肪酸进入线粒体,提高心肌细胞利用脂肪酸能力,为心肌代谢提供充足能量供应,促进心肌细胞各项功能恢复[14]。在心肌细胞长期缺氧下,长链脂肪酰辅酶A(CoA)和其他毒性代谢产物长期在心肌细胞内堆积,破坏心肌细胞膜性结构,造成细胞内环境紊乱,细胞坏死、破裂。左卡尼汀与长链脂肪酰CoA结合后可进入血液由尿液排出,可有效减轻长链脂肪酰CoA和其他毒性代谢产物产生的反应。现代临床研究发现左卡尼汀治疗ICM HF能显著改善病人心功能,临床效果显著[15]。多项Meta分析显示左卡尼汀治疗HF是安全、有效的[16- 17]。
本研究采用左卡尼汀联合美托洛尔治疗的观察组治疗14 d后总有效率达94.0%,较仅予以美托洛尔治疗的对照组(80.7%)明显上升,这与乔玉冰[10]报道相似;说明ICM HF采用左卡尼汀联合美托洛尔用药方案治疗有利于减轻病人临床症状/体征,改善心功能,提高整体治疗效果。分析原因可能与左卡尼汀以下作用机制有关[18]:①抑制心脏重构,减轻室壁张力,以达到降低机械电反馈目的;②改善缺血心肌低pH环境,缓解钙超载,以减少局部心肌触发活动发生的作用;③促进肉碱脂酰转移酶作用,减少毒性代谢产物堆积,缓解细胞内钙超载,稳定细胞膜电位,进一步降低心律失常发生率。本研究显示观察组治疗14 d后心功能指标SV、LVEF、CO值均显著低于对照组,提示本研究联合方案有利于改善ICM HF病人心功能。究其原因可能与左卡尼汀可有效调节心肌能量代谢药理作用密切相关[15]。
NT- proBNP是由心室分泌的激素类多肽,刺激心肌细胞产生大量NT- proBNP,而后分解为具有生物活性的B型利钠肽(BNP)。与BNP比较,NT- proBNP具有稳定性强、半衰期长等优点,有利于HF的诊断。近年来研究显示NT- proBNP水平升高与心脏功能关系密切,且其水平能特异、敏感地反映心力衰竭的严重程度,临床将其作为HF发作的早期指标[19]。有文献报道,炎性因子水平升高是HF病人的重要危险因素,其可促进心室重构和病情进展,IL- 6为炎症反应敏感标志物,可迅速对机体损伤或炎症做出反应,其通过降低心肌收缩能力,诱导细胞发生坏死或凋亡,进而促进心室重塑[13]。TNF- α主要由单核巨噬细胞生成,心血管系统受损时,血管内皮细胞、血管平滑肌细胞均可生成TNF- α,HF病情严重程度与TNF- α水平呈显著正相关,TNF- α常作为HF病人预后的重要指标。本研究结果显示,与对照组比较,观察组治疗14 d后血清IL- 6、TNF- α、NT- proBNP水平均显著更低;提示左卡尼汀联合美托洛尔治疗方案有助于提高ICM HF病人心脏收缩能力和心肌细胞功能,减轻炎性反应。
综上所述,左卡尼汀联合美托洛尔治疗ICM HF能改善病人临床症状,降低血清IL- 6、TNF- α、NT- proBNP水平,改善心功能,疗效显著。但本研究联合用药方案的具体机制及临床有效性、可靠性,有待进一步多中心、大样本的长期试验研究分析。

