不同缺氧复氧损伤程度对H9c2心肌细胞自噬的影响
黄小玲 唐轶洋 钟敏 赵高峰
广州中医药大学第二附属医院麻醉科(广州 510006)
自噬是真核细胞所特有的通过溶酶体降解细胞内物质成分、清除衰老或受损细胞器的过程,对维持细胞内稳态至关重要。目前普遍认为自噬是一种防御和应激调控机制。研究表明心肌缺血再灌注损伤与自噬关系密切,自噬是缺血再灌注损伤心肌细胞死亡的另一途径[1]。2017年5-10月本研究采用H9c2大鼠心肌细胞作为受试细胞,检测不同缺氧复氧损伤程度对自噬的影响,并观察在此种自噬改变下对心肌细胞存活率的影响,从而摸索出当前实验条件下研究H9c2心肌细胞自噬的最佳缺氧复氧模型。
1 材料与方法
1.1 材料与试剂 H9c2大鼠心肌细胞株购自中南大学湘雅中心实验室;高糖型DMEM、青霉素-链霉素双抗、胎牛血清、0.25%胰酶-EDTA、PBS购自美国Gibco公司;四氮唑蓝(MTT)、二甲基亚砜(DMSO)、丹酰戊二胺(MDC)购自美国Sigma公司;无糖培养基购自吉诺生物公司;总RNA提取试剂盒购自Promega公司;ReverTra Ace qPCR RT Kit逆转录试剂盒、SYBR Green Realtime PCR Mas⁃ter Mix购自Toyobo公司;Atg5、GAPDH引物由广州艾基生物公司合成。
1.2 方法
1.2.1 实验分组与模型制备 H9c2心肌细胞在含10%胎牛血清、1%双抗(v/v)(100 U/mL青霉和100 mg/L链霉素)、高糖DMEM培养基,5%CO2、95%空气的37℃细胞培养箱中培养,每2天更换1次培养基。细胞融合度>80%时进行传代,传代细胞可用于实验。
取对数生长H9c2大鼠心肌细胞,将细胞随机分为4组:空白对照组(CON),细胞未作任何处理;缺氧复氧(H/R)模型3组,将H9c2心肌细胞置于37 ℃含 1%O2、5%CO2、94%N2缺氧培养箱中分别以 0.5%FBS 复合高糖 DMEM[2]、无糖培养基[3]、PBS[4]为缺氧液培养3 h模拟不同程度缺血缺氧,然后置换完全培养基置于正常培养箱中培养3 h模拟复氧再灌注。收集复氧后H9c2心肌细胞或用于检测。
1.2.2 MTT法检测H9c2细胞存活率 采用对数生长期的心肌细胞,胰酶消化后用完全培养基调成单细胞悬液,分配至96孔板,每孔约100 μL(2×104个/孔)。按上述方法进行分组,每组设5个复孔,并设置调零孔。按上述分组处理后,每孔加入MTT工作液(5 g/L)约10 μL,置于37℃、5%CO2培养箱中继续培养4 h后吸弃上清,每孔加入100 μL DMSO终止反应,置摇床上低速振荡10 min,使结晶物充分溶解。在酶标仪490 nm波长下测定吸光度OD值。实验重复3次,记录并计算细胞存活率:细胞存活率=(实验组OD值-调零孔OD值)/(对照组OD值-调零孔OD值)×100%。
1.2.3 MDC荧光染色流式细胞仪检测H9c2细胞自噬率 采用对数生长期的心肌细胞,胰酶消化后用完全培养基调成单细胞悬液,分配至24孔板,每孔约500 μL(1 × 105个/孔)。按上述方法进行分组,每组设6个复孔。按上述分组处理后吸除培养基,每孔加入MDC工作液(50 μmol/L)约500 μL,37℃避光孵育20 min,PBS洗3遍后收集细胞,流式细胞仪检测其荧光强度。由于MDC的激发光为355与染料DAPI相近,故使用DAPI模式检测各组细胞群集中象限的荧光强度。记录数据并计算细胞自噬率:自噬率=实验组荧光强度/对照组荧光强度×100%。
1.2.4 实时荧光定量PCR法检测细胞内Atg5 mRNA的表达 采用总RNA提取试剂盒按照试剂盒说明提取细胞总RNA,检测其浓度与纯度。逆转录试剂盒合成单链cDNA,以cDNA为模板,SYBR Green掺入法进行PCR反应扩增。ATG5引物上游序列 5′⁃TGGACGGATTCCAACGTGCTTTAC⁃3′,下游序列 5′⁃TTTGTCAGTTACCAGCGTCAAATAGC⁃3′,内参GAPDH引物上游序列5′⁃AGTGCCAGCCT⁃CGTCTCATA⁃3′,下游序列5′⁃ACCAGCTTCCCATT⁃CTCAGC⁃3′。反应体系25 μL:含SYBR Green Master 12.5 μL,上下游引物各0.5 μL,cDNA 2.5 μL,ddH2O 9 μL。每组设2个复孔。反应条件如下:95℃3 min、95 ℃ 15 s、58℃ 15 s、72℃ 15 s共39个循环。应用Rio⁃Rad CFX Manager软件分析每个孔Atg5及GAPDH的荧光强度并计算Atg5 mRNA表达的相对量。每组实验至少重复2次。
1.3 统计学方法 利用Stata 13统计软件包处理数据。数据用均数±标准差表示,多组之间的比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 H/R对H9c2心肌细胞存活率的影响 与CON组相比,各H/R模型组细胞存活率均降低(P<0.05),其中0.5%FBS复合高糖DMEM、无糖培养基、PBS处理的各H/R组细胞存活率分别下降了15.2%、19.4%、25.9%。见图1。对照组细胞存活率取100%。
2.2 各组H9c2心肌细胞自噬率的变化 如图2A所示,取右下象限细胞群为阳性象限细胞群(P1),根据各组荧光强度统计结果显示,与CON组相比各H/R模型组心肌细胞自噬率差异有统计学意义(P<0.05),其中0.5%FBS复合高糖DMEM、无糖培养基处理的H/R心肌细胞自噬率分别增加了26.2%、8.6%,PBS处理的则下降了17.5%。见图2B。对照组细胞自噬率取100%。
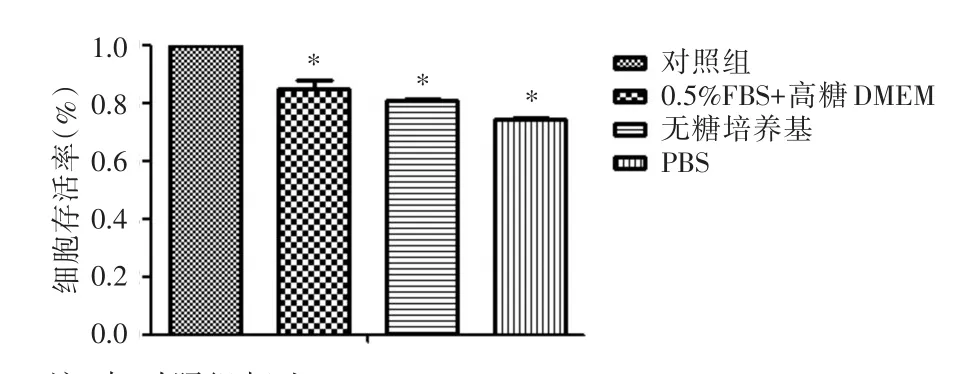
图1 MTT法检测各组H9c2心肌细胞存活率Fig.1 The survival rate of H9c2 cardiomyocytes determined by MTT method
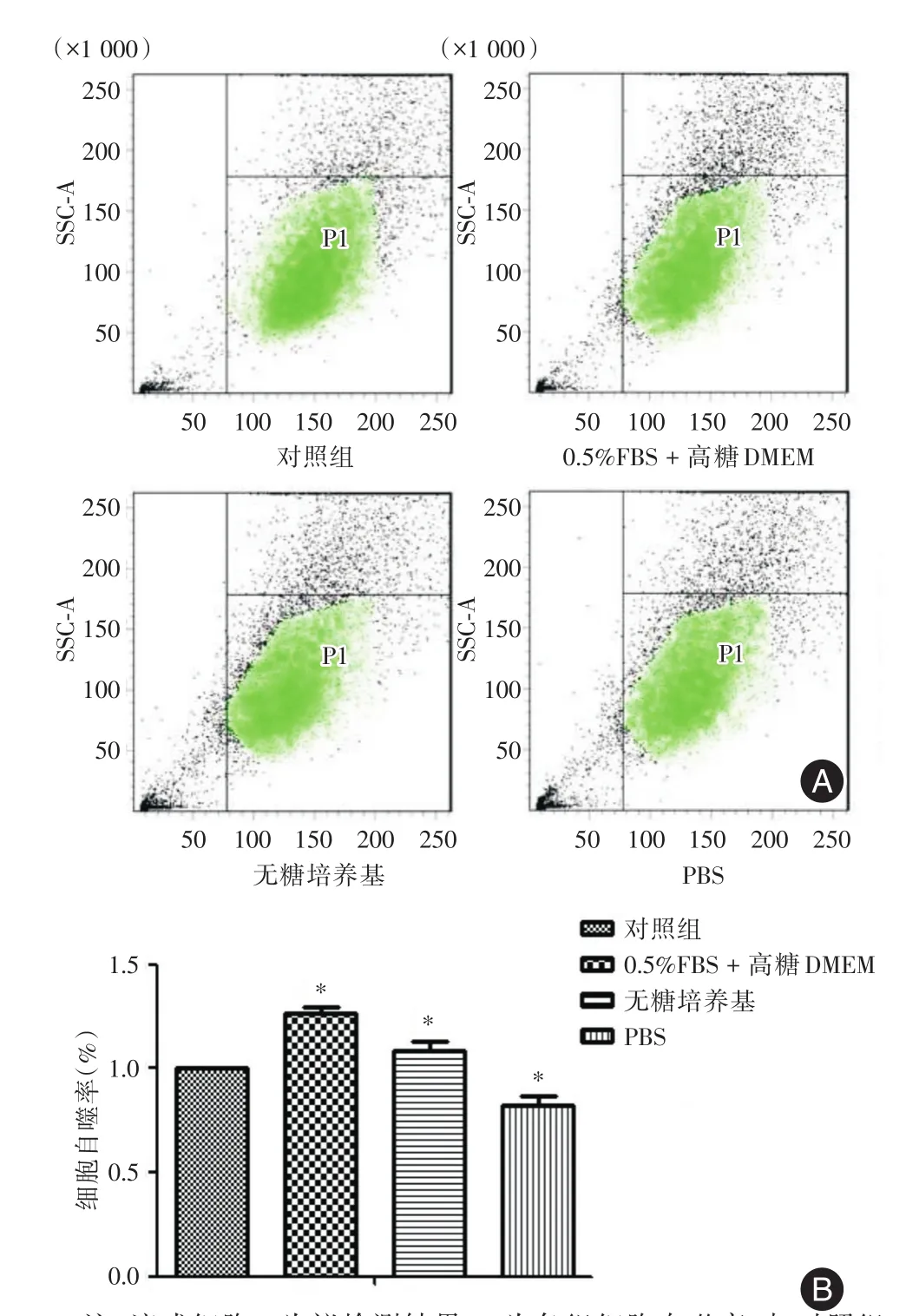
图2 流式细胞仪检测各组H9c2心肌细胞自噬率Fig.2 The autophagy rate of H9c2 cardiomyocytes determined by flow cytometer
2.3 Atg5 mRNA的表达 实时荧光定量PCR的结果显示,与对照组相比各H/R模型组心肌细胞Atg5 mRNA的表达差异有统计学意义(P<0.05),其中0.5%FBS复合高糖DMEM、无糖培养基处理的H/R心肌细胞Atg5 mRNA的表达分别增加了49%、10.5%,PBS处理的则下降了15.1%。见图3。对照组细胞Atg5 mRNA的表达取100%。

图3 实时荧光定量PCR法检测各组H9c2心肌细胞Atg5 mRNA的表达Fig.3 The mRNA expression levels of Atg5 analyzed by RT⁃PCR
3 讨论
缺血性心脏病是心血管系统中发病率及病死率较高的疾病,临床上多开展冠脉搭桥、冠状动脉介入术等进行治疗,但恢复冠脉血流灌注后,常引发H/R损伤[5]。因此,如何有效保护缺血心肌细胞,减轻H/R损伤是目前研究的重点。研究发现自噬在一些严重的心脏病理状况下,包括心肌梗死、缺血再灌注损伤及心力衰竭中发挥至关重要的作用[6],缺血性心脏病的发生发展及致死率与心肌细胞自噬的改变有很大的相关性[7]。自噬在心脏疾病中到底扮演着怎样的角色,取决于细胞自噬发生的水平及病理状态[8-10]。通过离体心脏研究发现自噬在缺血期处于较低水平,再灌注期则被高度激活,使用经典的抑制剂3-MA后,自噬水平降低,再灌注后心肌梗死面积减少,提示心肌细胞自噬水平与心肌缺血再灌注损伤的程度呈正相关[11]。
研究表明,H9c2细胞株来自大鼠胚胎的心肌细胞,虽然不能搏动,但因为具有与原代培养乳鼠心肌细胞相似的功能与特性,且易于分离培养并可传代,在H/R实验中具有广阔的应用前景。故本研究选用H9c2大鼠心肌细胞株作为研究对象。体外心肌细胞H/R模型一直被广泛应用于H/R损伤的研究,对于探讨H/R损伤的分子机制具有重要的意义。但国内外利用缺氧箱建立H/R细胞模型的条件并没有统一的标准。根据查阅的文献,目前构建H/R损伤模型时常常采用断氧及断糖两种方式,使用低血清或无血清缺氧液并置于缺氧箱中培养模拟心肌细胞缺血缺氧环境,通过恢复血清和氧的供应模拟再灌注。对于缺氧培养时的氧浓度主张从无氧到5%各有不同[12-13],缺氧复氧的时间和缺氧液也各有不同,常用的缺氧液有自配缺氧液[14]、无血清无糖培养液[3]、无糖Hanks液[15]等。本实验选用1%的氧浓度,分别以0.5%FBS复合高糖DMEM、无糖培养基和PBS为缺氧液缺氧3 h后复氧3 h来模拟H/R,实验结果发现各缺氧液处理的H/R模型组心肌细胞存活率均低于正常对照组(P<0.05),表明上述方法建立的离体细胞H/R损伤模型是可行的,利用缺氧培养箱可以造成H9c2心肌细胞H/R损伤。
多数研究者认为H/R发生的基础是能量代谢障碍[16]。从营养物质及能量供给方面考虑,0.5%FBS复合高糖DMEM优于无糖培养基,无糖培养基优于PBS。本研究结果表明三者作为缺氧液H/R损伤后细胞存活率逐渐下降,说明损伤的程度与其缺氧液物质和能量供给的优劣是相一致的;心肌细胞自噬率以及Atg5 mRNA的表达也逐渐下降,说明细胞自噬的水平也有可能和物质与能量的需求平衡相关。LUM等[17]研究认为,各种原因引起的细胞内ATP水平的下降均可诱发自噬,从而保证细胞能量代谢的稳定,利于细胞生存,但是过于严重或时间过长的“饥饿”状态反而抑制自噬。本研究的结果与上述的研究结论是一致的。0.5%FBS复合高糖DMEM、无糖培养基处理的心肌细胞自噬率以及Atg5 mRNA的表达相对对照组是增加的,这表明以上两种缺氧液H/R损伤后诱发自噬,且前者更明显;而PBS处理的相对对照组则是下降的,表明PBS作为缺氧液H/R损伤后反而抑制自噬。这说明H/R损伤心肌细胞自噬的水平可能与心肌缺氧的程度以及细胞的状态呈相关性,但尚需要进一步的实验进行证实。
综上,利用缺氧培养箱可以造成H9c2大鼠心肌细胞缺氧复氧损伤,缺氧复氧损伤心肌细胞自噬的水平与心肌缺氧的程度以及细胞的状态呈相关性。细胞适度缺氧复氧可以激活细胞自噬,但细胞过分缺氧反而抑制自噬。

