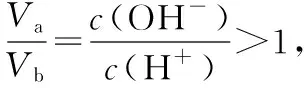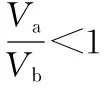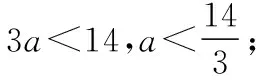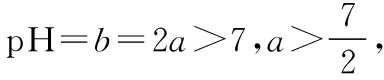一题多变思路宽 殊途同归好景致
孙 晶
山东
题海无边,只有“精做题、做精题”才会有收效。选择有代表性的典型题,做题时加以思考、深挖、变形、拓展就是精做。下面通过几道题的拓展,使大家明白“精做题、做精题”的道理。
一、一题多变
【例1】向50 mL 18 mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量是
( )
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.大于0.90 mol

【答案】A
【反思1】类似铜和浓硫酸反应的情况还有哪些?本题若换个角度考查又会怎样?
【变式训练1】在一定体积的18 mol/L H2SO4溶液中加入足量的铜片,加热使之反应,被还原的H2SO4物质的量为0.90 mol,则浓硫酸的实际体积为
( )
A.等于50 mL B.大于50 mL
C.等于100 mL D.大于100 mL
【解析】可假设浓H2SO4的体积为100 mL,则被还原的H2SO4小于0.90 mol,故浓H2SO4的实际体积必大于100 mL。
【答案】D
【变式训练2】25 mL 18 mol/L H2SO4溶液中加入足量的木炭并加热使之充分反应,则被还原的H2SO4的物质的量为
( )
A.等于0.23 mol B.大于0.23 mol
C.等于0.46 mol D.小于0.46 mol
【解析】非金属单质与浓硫酸的反应,应注意浓硫酸全部作氧化剂。
【答案】D
【反思2】上述题目及变式都是反应后由于酸的浓度变稀,反应自动停止,两种反应物都有剩余的情况。有没有浓酸变稀,但反应并未停止的情形呢?
【变式训练3】将一定量的锌与100 mL 18.5 mol/L的浓H2SO4充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,则下列叙述中错误的是
( )
A.气体A为SO2和H2的混合物
B.气体A中SO2和H2的体积比为4∶1
C.反应后共消耗Zn 97.5 g
D.反应中共转移电子3.0 mol
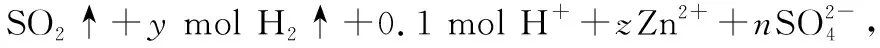
【答案】B
【反思3】变式训练3中,Zn在反应中只能生成Zn2+,因此浓硫酸变稀后,发生的反应只有一个。但若将Zn换成具有变价的金属Fe,情况又将怎样呢?
【变式训练4】1.0 mol 浓H2SO4与56 g Fe在加热条件下发生反应,试根据反应现象,写出有关的化学方程式,并判断产生的气体在标准状况下的体积与22.4 L的关系。
【解析】本题首先要判断铁与浓硫酸的相对用量问题。已知,H2SO4与Fe的物质的量之比为1∶1时,在产物中铁只能以FeSO4形式存在,由于产物中还有SO2,所以铁一定过量。
浓硫酸与铁在加热的条件下发生反应:
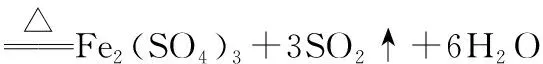

分析发现反应的铁应小于1.0 mol,且以Fe2+的形式存在,每生成1.0 mol SO2或H2,转移电子数均为2.0 mol,故生成气体的体积在标准状况下必小于22.4 L。
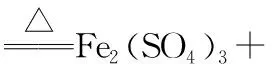
(2)小于22.4 L
二、一题多解
同一个问题,不同的人从不同的视角予以分析,会采取不同的分析角度,体现了“横看成岭侧成峰”的辩证思想,但最终都会殊途同归。下面从不同角度来赏析一道反应热计算的题目。
【例2】已知下列两个热化学方程式:

实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3 847 kJ,则混合气体中氢气和丙烷的体积比约为
( )
A.1∶3 B.3∶1
C.1∶2 D.1∶1
解法一:逐项代入法

【方法归纳】在解答选择题时,采用逐项代入法是解答的常用方法之一,此法也称逐项排除法。
解法二:估算法
设想如果两者按1∶1混合,即各为2.5 mol,则可放出热量为2.5 mol×285.8 kJ·mol-1+2.5 mol×2 220.0 kJ·mol-1=6 264.5 kJ。因6 264.5 kJ>3 847 kJ,分析两者的燃烧热数据,可知H2的燃烧热比C3H8小,若要使放出的热量减小,则两者混合物中H2占的比例应大于丙烷,即V(H2)∶V(C3H8)>1∶1,故此题只有B符合要求。
【方法归纳】估算法是解决客观型计算题常用的思维方法,该方法其实就是在合理的前提下估算,根据以往的化学原理和经验进行合理、科学的推断,从而不经过计算而得到答案的方法。该方法是常用的、应用极其广泛的简便方法。
方法三:极端假设法与十字交叉法联用
利用极端假设法,分别假设5 mol全是其中的某一气体,得出它们各自所能放出热量的最大值,然后再运用十字交叉法的思想,得出其体积比。
假设5 mol气体全是氢气,则应产生的热量为285.8 kJ·mol-1×5 mol=1 429 kJ;假设5 mol气体全是丙烷,则应产生的热量为2 220.0 kJ·mol-1×5 mol=11 100 kJ。而实际上混合气体产生的热量为3 847 kJ。则V(H2)∶V(C3H8)=(11 100-3 847)∶(3 847-1 429)≈3∶1,应选B。
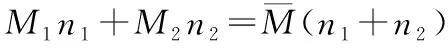
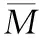
解法四:列方程组法
分别设出其物质的量,利用热化学方程式中的燃烧热,列出二元一次方程组求解,然后再求出两者的比值即可。
设氢气和丙烷的物质的量分别为x和y,则

则x∶y=3.75∶1.25=3∶1,应选B。
【方法归纳】该种方法容易被大多数人所接受,它的解题思路很容易想到,也是比较常用的常规解法,但计算量偏大、技巧性不强。
通过上述的例子,大家可以领略不同解题方法的巧妙之处,不要只满足于一般的解法,而要从多方位去寻求解题途径,要善于分析,选择最合理、最简捷的一种解法,这样才有利于开拓思路,逐步形成解题的灵活性和解题技巧。
三、多题一解
学习的最高境界是抓住“神似”而不是“形似”。而在pH计算类试题中往往会有一些“形不似而神似”的题目,这些题目往往和酸碱混合的计算有关。
【例3】在25℃时,有pH=a(a≤6)的盐酸VaL和pH=b(b≥8)的NaOH溶液VbL。二者混合恰好完全中和。问:



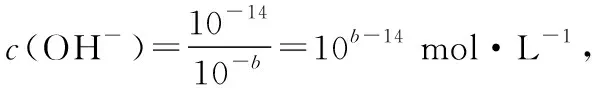
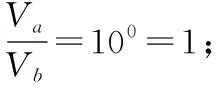
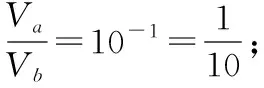

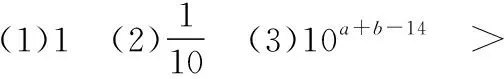
【反思】本题若换个角度考查又会怎样?类似酸碱混合pH计算的变向考查还有哪些形式?
【变式训练1】某强酸溶液的pH=a,强碱溶液的pH=b,已知a+b=16。在常温下,混合后pH=7,则酸溶液体积V酸和碱溶液体积V碱的正确关系是
( )
A.V酸=102V碱B.V酸=10-2V碱
C.V酸=V碱D.V碱=10V酸
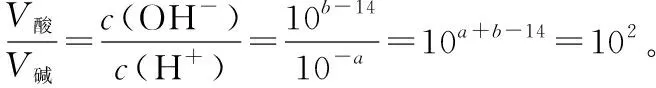
【答案】A
【变式训练2】室温时,xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7

【答案】D
【变式训练3】25℃时,向1 mL pH=a的盐酸中滴加10 mL pH=b的NaOH溶液,当溶液n(Cl-)=n(Na+)时,则a+b的值为多少?
【解析】由题意知n(Cl-)=n(Na+),根据离子所带电荷守恒得n(H+)=n(OH-),酸碱恰好中和,则有10-amol/L×1 mL=10b-14mol/L×10 mL,所以a+b=13。
【答案】13
【变式训练4】25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va (1)a值可否等于3________(填“是”或“否”)。 (2)a值可否等于5________(填“是”或“否”)。 (3)a的取值范围是__________________。 【解析】(1)若a=3,由a=0.5b可知b=6,由题设pH=b的是一元强碱,与题设矛盾,所以应答“否”。