低含量血清培养IBRS-2细胞及其增殖猪细小病毒N株的研究
卢冰霞,段群棚,梁家幸,周英宁,赵 武,何 颖,闭炳芬,秦毅斌,蒋冬福,卢敬专,李 斌,苏乾莲,陈忠伟
(广西壮族自治区兽医研究所 广西兽医生物技术重点实验室,南宁 530001)
猪细小病毒(Porcine parvovirus,PPV)是引起猪繁殖障碍病的主要病原之一,易引起母猪流产或产死胎、木乃伊胎,新生仔猪健康度差、死亡率高等[1,2]。近年来,PPV强毒株的出现使得猪繁殖障碍病在欧美国家的发病率急剧增加,在中国的发病率也呈上升趋势[3]。该病目前尚无有效的治疗方法,主要还是通过接种疫苗来预防[4,5]。目前国内PPV疫苗以灭活苗为主,但灭活苗也存在免疫应激大、免疫次数多和免疫保护期短等缺点[6]。PPV N株是广西兽医研究所从广西省初产母猪所产死胎中分离到自然弱毒株后,并进一步研发获得的免疫疫苗候选毒株,用该毒株免疫怀孕母猪,不产生病毒血症,并能抵抗强毒的攻击[7]。相关研究结果表明,该疫苗株能使猪产生良好的抗体反应,且对母猪安全无害[8]。PPV N株是PPV弱毒疫苗理想的候选毒株。目前多数动物疫苗生产厂家通常用含6%~10%新生牛血清的细胞培养体系[9-12]。牛血清价格昂贵,不同批次间质量可能存在差异,血清成分复杂,可能携带潜在病原,后期生物制品纯化存在很大困难,这些缺点使得血清在细胞大规模培养中的应用受到限制[13-15]。使用低含量血清培养PPV,具有提高疫苗质量安全性,降低生产综合成本,提高生产效率,减少异源蛋白免疫过敏反应发生率等优势,对疫苗生产具有重要意义。本研究以低含量血清培养细胞为目标,经过驯化培养,建立了IBRS-2细胞低含量血清培养体系,并应用于PPV N株的增殖,以期为传代细胞系低含量血清驯化培养及PPV在低含量血清培养细胞上的增殖研究奠定基础。
1 材料和方法
1.1 材料 PPV N株由广西兽医研究所病毒室分离保存,毒价为104.4TCID50/mL,HA为1∶128;IBRS-2细胞购自中国典型培养物保藏中心;MEM培养基和胰蛋白酶购自美国Gibco公司;小牛血清购自杭州四季青公司。
1.2 方法
1.2.1 IBRS-2细胞常规传代培养 取生长状态良好且铺满T75细胞培养瓶底的IBRS-2细胞,弃去培养瓶内培养液,加入5 mL胰酶-EDTA消化液洗细胞1次,更换新鲜消化液3 mL,于37℃恒温培养箱中消化3~5 min后,弃去消化液;吸取6 mL含10%小牛血清的培养液轻轻吹打,使之完全消化散开,按1∶3比例传至3个新的细胞培养瓶;每瓶加18 mL含10%小牛血清的培养液,37℃恒温培养箱培养备用。一般经过48 h需要进行下一次传代操作。
1.2.2 含8%小牛血清MEM培养基对 IBRS-2细胞的驯化培养 将已长成良好单层的IBRS-2细胞按1∶3比例传至3个新的细胞培养瓶。选择其中2瓶,用含8%小牛血清MEM培养基培养,另外1瓶加入含10%小牛血清MEM培养基培养作为对照。长满单层后各瓶均以1∶3比例继续连传5代。
1.2.3 含4%、2%、1%小牛血清MEM培养基对IBRS-2细胞的驯化培养 将用含8%小牛血清MEM培养基驯化的IBRS-2细胞按常规方法继续传代,培养基中血清降为4%、2%和1%,按1∶3比例继续连传5代。同时增设含8%小牛血清MEM培养基培养的细胞作为对照。其余浓度驯化操作步骤同上。
1.2.4 IBRS-2细胞计数及生长曲线测定 分别对正常传代IBRS-2细胞及用含8%、4%和2%小牛血清MEM培养基驯化的IBRS-2细胞进行生长曲线测定,在细胞传代后0、24、48、72、96 h,用血球计数板按常规方法进行活细胞计数。
1.2.5 驯化的IBRS-2细胞冻存及复苏 取生长良好的,用含2%小牛血清M E M培养基培养的细胞,经胰酶消化后加入适量冻存液(800 mL/L MEM培养基、100 mL/L小牛血清、100 mL/L DMSO)。用吸管吹打制成细胞悬液(细胞密度约为1×106~4×106/mL),加入1 mL 细胞于冻存管中,密封后标记冷冻细胞名称和冷冻日期。将冻存管放置在程序降温盒(NALGENE,USA)中,-80℃超低温化箱过夜,然后将冻存管从程序降温盒取出放在液氮罐中保存。细胞冻存7 d后,将冻存的IBRS-2细胞从液氮罐中取出,放于37℃温水中快速摇动,使其融化。在超净工作台上将其移入细胞培养瓶中,加入含2%小牛血清MEM培养液,37℃恒温培养。5~6 h后更换1次含2%小牛血清MEM培养液,继续置37℃恒温培养箱中培养。24 h后至细胞长成单层观察细胞状态。
1.2.6 PPV N株增殖试验 取低含量血清培养液(含2%小牛血清)驯化并生长良好的单层IBRS-2细胞按1∶3比例传代,传代同时按0.1% 接入PPV N株种毒,37℃培养96 h后收获病毒。同时设置用含10%小牛血清MEM培养液培养的IBRS-2细胞接毒的对照。
1.2.7 PPV N株病毒滴度测定 分别用TCID50和HA方法测定收获的病毒液的病毒滴度。
1.2.7.1 TCID50试验 按照常规方法培养IBRS-2细胞,将消化后的细胞铺于2块96孔细胞培养板上,长至1/3单层后弃去培养液;将收获的病毒液用含2%小牛血清MEM培养液做10倍系列稀释,取稀释好的病毒样品(10-1~10-8稀释度)加入上述96孔板,每个稀释度8个重复,每孔100 µL,同时每板设健康细胞对照孔8孔;置于5% CO2培养箱37℃培养96 h,逐日观察CPE,按Reed-Muench法计算TCID50。
1.2.7.2 HA试验 在 96 孔V型微量凝集板的第1~10孔,加入PBS(25 µL/孔)。第 1纵排依次加待检样品25 µL,自第 2 孔作2倍梯度浓度递增稀释至第10孔,最后弃去25 µL;各孔加 0.6%豚鼠红细胞悬液25 µL,同时设生理盐水、阴性血清和PPV抗原对照,4℃作用2 h,观察结果,以红细胞完全凝集的被检材料最高稀释度的倒数为凝集价。
2 结果
2.1 IBRS-2细胞培养结果 8%小牛血清MEM培养基培养的IBRS-2细胞传代48 h后,可长至良好的单层。生长良好的细胞边缘清晰,轮廓清楚,无悬浮的死细胞,培养液清澈(图1)。

图1 含8%小牛血清MEM培养的IBRS-2细胞单层(10×10)Fig.1 IBRS-2 cells in 8% NBS MEM(10×10)
2.2 含4%、2%小牛血清MEM培养基对IBRS-2细胞的驯化培养结果 分别用含4%、2%小牛血清MEM培养基培养的IBRS-2细胞,连传3代后,细胞均生长良好,边缘清晰,轮廓清楚,无悬浮死细胞,培养液清澈,无混浊现象,与对照无明显差别(图2、图3)。
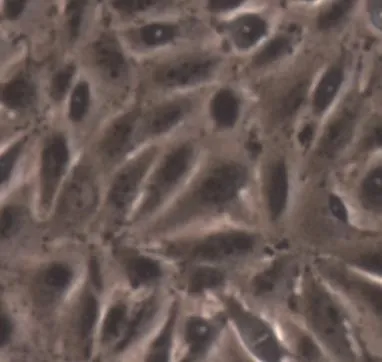
图2 含4%小牛血清MEM培养的IBRS-2细胞单层(10×10)Fig.2 IBRS-2 cells in 4% NBS MEM(10×10)

图3 含2%小牛血清MEM培养的IBRS-2细胞单层(10×10)Fig.3 IBRS-2 cells in 2% NBS MEM(10×10)
2.3 含1%小牛血清MEM培养基对IBRS-2细胞的驯化培养结果 用含1%小牛血清MEM培养基培养IBRS-2细胞,仅传1代后,细胞生长出现异常,细胞出现脱落拉网现象,接近死亡(图4),与对照组差别明显。继续传代后细胞几乎不再贴壁,全部死亡。
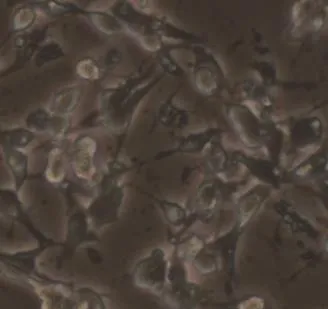
图4 含1%小牛血清MEM培养的IBRS-2细胞单层(10×10)Fig.4 IBRS-2 cells in 1% NBS MEM(10×10)
2.4 细胞计数及生长曲线测定结果 分别在细胞传代后0、24、48、72、96 h进行活细胞计数,对正常传代及含有8%、4%、2%小牛血清MEM培养基驯化的IBRS-2细胞测定生长曲线。结果显示,不同血清含量驯化的细胞在各个时期增殖情况与常规 IBRS-2细胞无显著差别(图5)。
2.5 PPV N株滴度测定结果 在驯化好的IBRS-2细胞上接入PPV N株,收获后测得TCID50平均值为 104.39/mL,HA效价平均值为1∶128;对照细胞接入PPV N株收获后测得TCID50的平均值为104.46/mL,HA效价平均值为1∶128。2种细胞培养的PPV N株病毒TCID50和HA效价均无明显差别,具体检测结果见表1。

图5 不同小牛血清浓度MEM培养基驯化的IBRS-2细胞生长曲线Fig.5 Growth curve of IBRS-2 cells in MEM medium with different concentration of the NBS

表1 PPV N株病毒TCID50 和HA效价检测结果Table 1 Detection results of TCID50 and HA titer of PPV N strain
3 讨论
随着对生物制品安全性和成本控制的要求越来越高,很多疫苗生产厂家都在不断优化生产工艺,其中细胞的低含量血清或无血清培养是需要优化的重点生产工艺[16]。血清在细胞培养以及病毒的增殖中都发挥着重要的作用。血清中含有细胞生长增殖所需的激素、生长因子,细胞贴壁所需的贴壁因子和扩展因子或提供合成培养基所缺乏的营养物质等。本研究在预试验中,直接将培养液的血清含量由10%降低到2%,结果细胞生长缓慢,贴壁不牢,培养液中悬浮的死细胞较多,细胞出现了不适应现象。
采用逐步降低细胞培养液中血清含量的方法,经过连续多代次传代驯化适应,使IBRS-2细胞逐步适应低含量血清培养。血清含量降低次序为8%、4%、2%、1%,在降低过程中,含8%、4%、2%血清浓度的体系中传代5次,都表现为较快适应,镜检观察无细胞衰老、变形,细胞停滞生长等常见的细胞衰老现象。但当血清含量为1%时,细胞出现了与预试验中直接将血清浓度降低至2%时出现的不适应表现:细胞生长缓慢,贴壁不牢,培养液中悬浮的死细胞较多等,无法继续进行传代驯化。
连续每隔24 h进行细胞计数,结果发现血清降低并未对细胞生长过程造成显著影响,计数结果均在常规误差范围内。细胞传代后24 h,细胞均表现常规性良好的对数生长现象,48 h后由于细胞平台效应,细胞数量不再增加。可见,该培养体系完全可以替代常规细胞培养体系。由于含有1%血清浓度的培养体系中细胞直接快速衰老死亡,本研究未进行该浓度下细胞计数试验。
本研究在驯化好的IBRS-2细胞上接入PPV N株,并设置常规培养的IBRS-2细胞对照组。3次测量结果(TCID50和HA效价)的平均值,与对照组并无明显差别,说明PPV N株在低血清培养的IBRS-2细胞中的增殖并未受到显著影响,这与张瑞永等[18]的研究结果类似。但病毒增殖培养本身是一个相对复杂的过程,病毒在该培养条件下的稳定性、免疫原性等关键参数是否变化仍需深入研究。李智力等[17]研究结果显示常规培养时血清浓度变化往往会对病毒增殖造成较大影响。
总之,本研究成功驯化出能在低含量血清培养条件下生长良好的IBRS-2细胞,血清浓度可以降低至2%,且PPV N株在低含量血清培养的IBRS-2细胞中增殖良好,降低了PPV N株细胞培养相关研究及规模生产成本,同时也降低了血清在疫苗中的潜在隐患风险,为促进PPV细胞培养研究及规模生产提供了参考和借鉴。

