白藜芦醇对新生大鼠七氟烷麻醉后认知功能改变的影响
谭宇亭,刘兰,廖芸茜,张攀,徐颖
随着儿科手术的发展及儿童医疗检查的需求,婴幼儿全身麻醉(简称全麻)的应用越来越广泛[1]。七氟烷(sevoflurane,SEVO)是一种新型吸入麻醉药,因其诱导和苏醒平稳而迅速,对气道刺激性较小,麻醉深度容易调节,对循环系统影响小,是小儿全麻诱导和维持的理想吸入麻醉药。但是大量研究证据表明,七氟烷对发育期的神经系统有一定的毒性作用[2-3],而对婴幼儿神经系统发育是否有长期影响目前尚无定论。因此,婴幼儿七氟烷麻醉对发育期大脑的影响是目前临床关注的热点问题。
白藜芦醇(resveratrol,RES)是一种从花生、葡萄、蓝莓中提取的非黄酮多酚类化合物,具有很强的生物学效应[4],能透过血脑屏障进入中枢神经系统,表现出有效的抗炎、抗氧化和抗凋亡作用[5-7]。RES作为沉默信息调节因子2相关酶Ⅰ(silent information adjustment factor 2 related enzyme Ⅰ,SIRT1)激动剂,以其抗氧化性能广泛作用于中枢神经系统,起神经保护作用。目前,有关RES在保护脑缺血-再灌注损伤,预防神经退行性疾病以及防止糖尿病神经病变等方面的研究颇多[8-9],但RES能否预防或治疗七氟烷引起的发育期脑损伤,目前少有报道。本研究以新生SD大鼠作为实验对象,采用腹腔注射RES预处理,观察七氟烷对于新生大鼠脑组织和认知功能的影响,以及RES是否可以预防或治疗由七氟烷引起的脑损伤及认知功能改变。
1 材料与方法
1.1 实验动物及材料 SPF级健康新生SD大鼠120只,平均体重9.28g,购自重庆医科大学动物实验中心。RES购自美国Sigma公司,七氟烷购自江苏恒瑞制药有限公司,SYBR Green购自日本Takara公司,PCR引物购自上海生工生物工程有限公司,半胱氨酸蛋白酶3(cysteinyl aspartate-specific proteinase,caspase 3)、SIRT1兔多克隆抗体购自北京博奥森生物技术有限公司,β-actin小鼠单克隆抗体购自浙江联科生物有限公司,辣根过氧化物酶标记的山羊抗兔二抗、辣根过氧化物酶标记的山羊抗小鼠二抗购自浙江联科生物有限公司,超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所,Morris水迷宫实验装置及分析系统购自北京硕林苑科技有限公司。
1.2 方法
1.2.1 动物模型制备及分组 动物实验通过重庆医科大学实验动物伦理委员会批准。SPF级健康6日龄SD大鼠120只,随机分为对照组、RES组、SEVO组和SEVO+RES组,每组30只。采用自制的麻醉箱将SEVO组与SEVO+RES组暴露于2.5%的七氟烷环境中,每天2h,连续3d。对照组与RES组的暴露环境除七氟烷的使用以外,其余与前述各组处理相同。暴露时维持环境温度为21~25℃,麻醉箱底部铺有钠石灰吸收CO2,同时使用数字测氧仪及麻醉机持续检测氧浓度及七氟烷浓度。每次暴露前30min,各组根据处理的不同通过腹腔注射RES(30mg/kg,溶于0.5% DMSO)或等量的安慰剂(0.5% DMSO)预处理。每次暴露结束后,待新生鼠反射恢复,完全苏醒后送回笼子与母鼠一起饲养,给予干净充足的食物和水。饲养环境温度维持在25±1℃,12h光照/黑暗循环(7:00-19:00)。
1.2.2 标本采集与处理 各组取20只新生鼠于最后一次暴露结束后(第8天,记为P8)在戊巴比妥钠麻醉下处死,收集标本。各组取4只采用心脏灌注4%多聚甲醛固定脑组织,用于HE染色。其余新生鼠均在戊巴比妥麻醉下直接断头,分离收集海马组织。其中各组取6只新生鼠海马组织用于Western blotting检测caspase 3、SIRT1蛋白表达;各组取6只新生鼠海马组织用于检测SIRT1、过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisomeproliferators activated receptor gamma co-activator 1 alpha,PGC-1α)、叉头蛋白转录因子3α(forkhead box O3 alpha,FOXO3α)mRNA的表达;各组取4只新生鼠海马组织用于检测MDA、SOD的含量;各组取余下的10只新生鼠在最后一次暴露结束后送回笼子与母鼠一起饲养至第30天(P30)行水迷宫实验。
1.2.3 脑组织病理形态学变化 采用HE染色观察。石蜡切片后经二甲苯脱蜡,梯度浓度(100%、95%、85%、75%)水化,自来水冲洗后以苏木素染色5min,自来水冲洗2min,1%盐酸乙醇分色,碳酸锂溶液返蓝后自来水冲洗,0.5%伊红染色30s,自来水冲洗后分别放入95%、100%的乙醇脱水1min,二甲苯透明,中性树胶封固,电子光学显微镜观察并拍照。
1.2.4 SIRT1、PGC-1α、FOXO3α mRNA表达变化 采用RT-PCR进行检测。将各组海马组织匀浆后按照Trizol法提取RNA,测定RNA的浓度和纯度,反转录合成cDNA,PCR反应体系10μl:cDNA 1μl,上下游引物各0.4μl,SYBR Green 4.5μl,ddH2O 4.7μl。反应条件:95℃预变性3min;95℃ 5s、63℃ 40s,共39个循环;72℃延伸5min。目的基因的相对表达量采用2–ΔΔCt法计算。PCR引物序列见表1。

表1 PCR引物序列Tab.1 Sequences of primers for PCR
1.2.5 SIRT1、Caspase 3蛋白水平检测 采用Western blotting进行检测。大鼠断头迅速分离脑组织,在冰上取下完整海马组织,使用蛋白提取试剂盒提取总蛋白后,采用BCA法检测蛋白浓度。各组蛋白调整浓度后经10% SDS-PAGE电泳后转移到PVDF膜上,5%脱脂奶粉室温封闭1h,TBST反复洗涤后,一抗(caspase 3,1:500;SIRT1,1:500;β-actin,1:5000)孵育过夜,TBST反复洗涤后室温孵育二抗1h,条带使用化学发光法显影。
1.2.6 SOD、MDA蛋白水平检测 将分离的完整海马组织制备成10%匀浆液后,4℃条件下,3000r/min离心10min取上清液,使用BCA法测定上清液蛋白浓度,随后按照SOD、MDA试剂盒说明书操作,分别使用酶标仪和可见光分光光度计测定吸光度值,根据说明书中的公式计算其含量。
1.2.7 Morris水迷宫实验 各组大鼠在出生后第30天(P30)开始进行水迷宫测试。采用Morris水迷宫系统(SLY-WMS 2.0),水池直径1.8m。大鼠进行定位航行实验与平台探索实验所需时间及路径由电脑系统自动跟踪记录。第1天为适应性训练,平台位于第三象限并高于水面1cm,将各组大鼠依序随机于不同象限放入水迷宫,记录寻找平台时间及路径,如大鼠未在60s内找到平台,则引导其进入平台并停留学习10s;第2~5天则将平台置于水面以下2cm,水中倒入墨汁混淆大鼠视野,将各组大鼠依序按照1、3、2、4象限和4、2、3、1象限交替放入水迷宫,记录其寻找平台的时间,如未找到平台,则引导其进入平台学习10s;第6天时撤去平台,从平台所在象限的对侧象限(第一象限)将各组大鼠依序放入水迷宫,记录各组大鼠在60s内进入原平台象限的次数及停留时间。整个水迷宫过程中维持水温在20~22℃,每天水迷宫结束后将每只大鼠擦干放回笼位饲养。
1.3 统计学处理 采用SPSS 18.0软件进行统计分析,计量资料呈正态分布的情况下以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。水迷宫数据采用重复测量方差分析,图片采用Image J 1.50i软件进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 病理形态学改变 HE染色可见对照组与RES组海马组织CA3区细胞形态完好,细胞周围间隙正常,无水肿,细胞核清晰可见;SEVO组神经细胞肿胀,部分胞质溶解,可见明显的细胞核固缩、碎裂;SEVO+RES组虽也可见细胞周围间隙增宽和固缩碎裂的细胞核,但其损伤程度较SEVO+RES组明显减轻(图1)。
2.2 海马组织中caspase 3、SIRT1蛋白表达 与对照组相比,SEVO组caspase 3蛋白表达明显增多(P<0.05);而相较于SEVO组,SEVO+RES组caspase 3表达则显著减少(P<0.05),与对照组无明显差异(图2A)。与对照组相比,SEVO组SIRT1蛋白表达明显减少(P<0.05);而与SEVO组相比,SEVO+RES组SIRT1蛋白表达明显增加(P<0.05),与对照组无明显差异(图2B)。
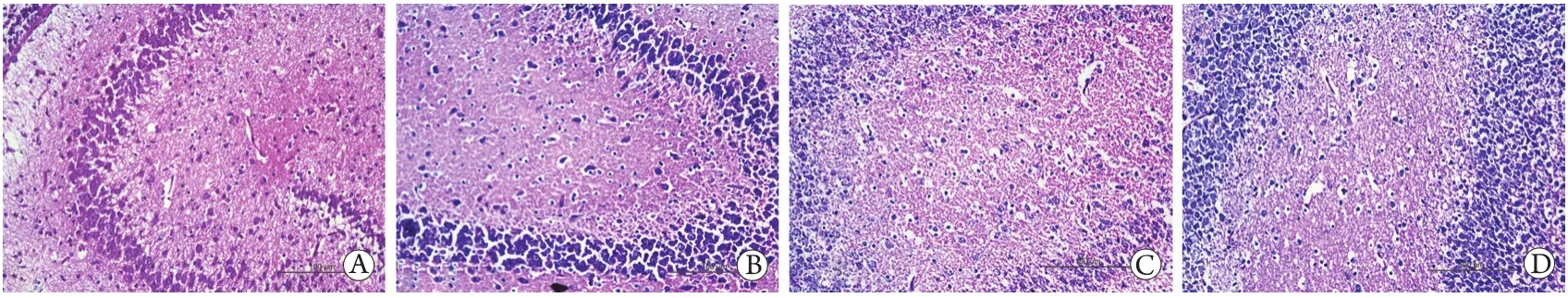
图1 各组海马组织CA3区病理形态学观察(HE ×200,n=4)Fig.1 Pathomorphological observations of CA3 region of the hippocampal tissues in each group (HE ×200,n=4)
2.3 SIRT1、PGC-1α与FOXO3α mRNA表达 与对照组比较,SEVO组海马组织SIRT1、PGC-1α与FOXO3α mRNA水平均有不同程度下降(P<0.05);白藜芦醇预处理后,SEVO+RES组三者的表达则明显高于SEVO组(P<0.05),略低于对照组(图3)。
2.4 海马组织中SOD、MDA含量检测 与对照组比较,SEVO组海马组织中SOD含量明显降低(P<0.05),MDA含量降低(P<0.05);而与SEVO组比较,SEVO+RES组海马组织中SOD含量和MDA含量则明显升高(P<0.05);SEVO+RES组海马组织中SOD含量和MDA含量与对照组无明显差异(图4)。
2.5 Morris水迷宫测试学习记忆功能 从水迷宫实验的结果来看,随着训练时间的增加,各组平台潜伏期时间均逐渐缩短。但是,无论是否给予RES预处理,七氟烷暴露后SEVO组及SEVO+RES组在平台潜伏期、目标象限停留时间以及穿越平台次数上均与对照组无明显差异(P>0.05,图5、6)。
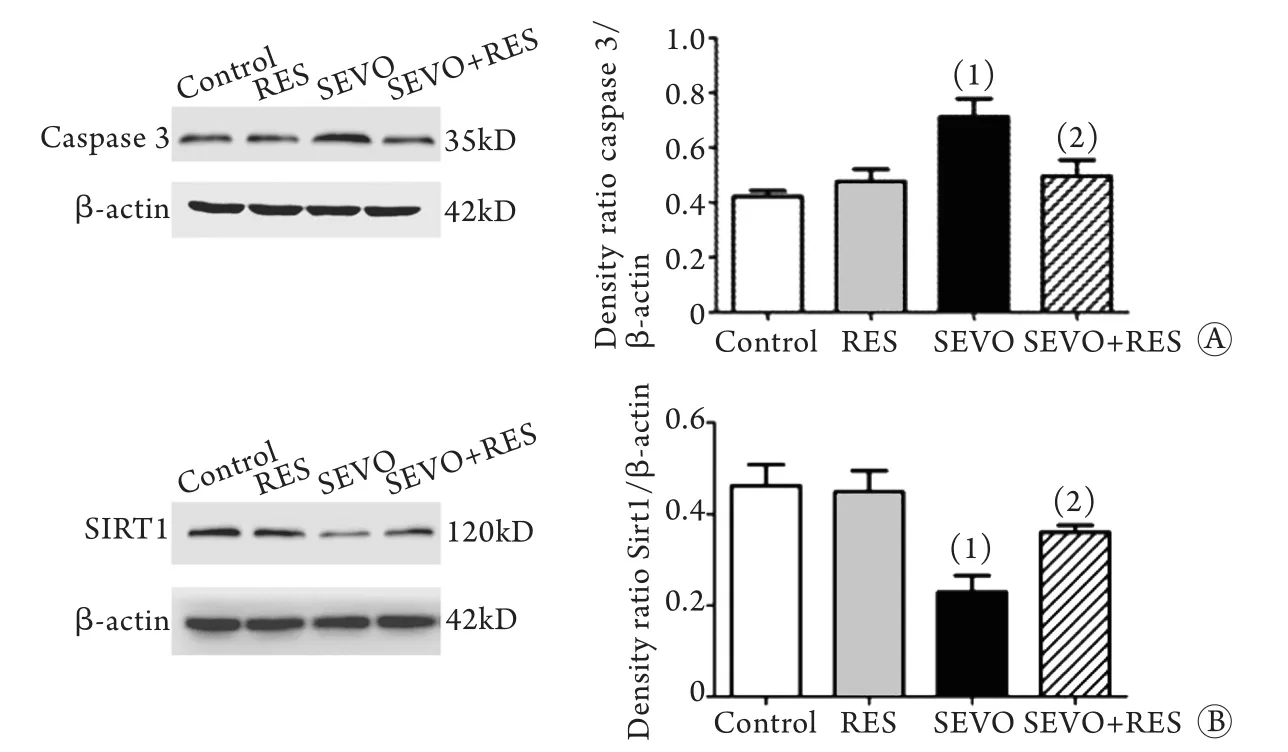
图2 各组海马组织caspase 3蛋白(A)和SIRT1蛋白(B)表达变化的影响(n=6)Fig.2 Expressions of caspase 3 protein (A) and SIRT1 protein (B) of hippocampus in each group (n=6)
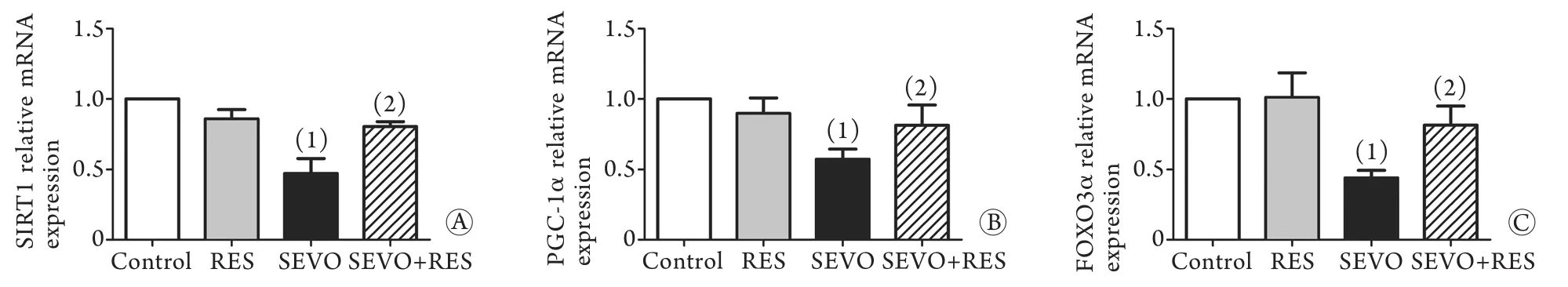
图3 各组海马组织SIRT1(A)、PGC-1α(B)与FOXO3α(C) mRNA表达的影响(n=6)Fig.3 Expressions of SIRT1(A), PGC-1α (B) and FOXO3α (C) mRNA of hippocampus in each group (n=6)
3 讨 论
婴幼儿脑发育时期是一个十分敏感的时期,在这个时期,任何不利的外部因素都可能影响脑正常发育[8]。七氟烷作为儿科麻醉中最常用的吸入麻醉药,其对发育期大脑的影响近年来已经成为医学研究的热点问题。临床回顾性研究发现,婴幼儿时期接受全身麻醉者长大后存在发生学习记忆障碍的风险[10-11],大量动物实验也表明,七氟烷暴露会引起新生动物神经细胞凋亡和行为学异常,并且海马区的神经细胞凋亡与学习记忆功能障碍密切相关[11-13]。本研究检测了新生大鼠海马区caspase 3蛋白的表达,新生大鼠暴露于2.5% SEVO 2h,连续3d会引起海马区caspase 3的大量激活,引发更多神经细胞的凋亡。然而在七氟烷暴露前30min给予RES预处理可以明显降低caspase 3的活性,减少细胞的损伤。这与RES在七氟烷暴露引起老年大鼠认知损伤中下调caspase 3表达产生神经保护作用是一致的[14]。因此,本研究认为RES可以减轻七氟烷暴露引起的新生大鼠神经细胞凋亡。
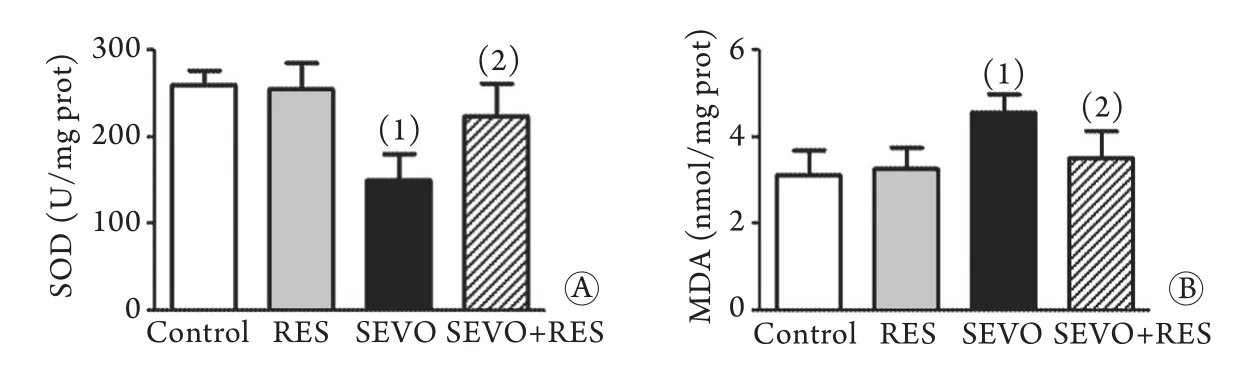
图4 各组海马组织中SOD(A)、MDA(B)含量(n=4)Fig.4 Contents of SOD (A) and MDA (B) of hippocampus in each group (n=4)
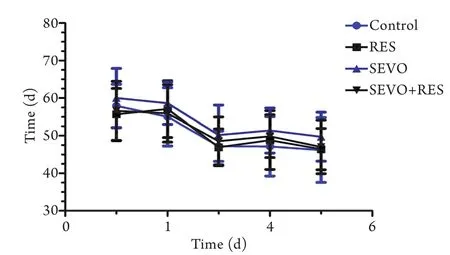
图5 各组大鼠逃避潜伏期的比较(n=10)Fig.5 Comparison of escape latency of rats in different groups (n=10)

图6 各组大鼠目标象限停留时间(A)和穿越平台次数(B)的比较(n=10)Fig.6 Comparison of the target quadrant residence (A) and the number of times of crossing platforms (B) in different group (n=10)
大脑是人体代谢最旺盛的器官之一,其耗氧量高,含有较多的不饱和脂肪酸,容易受到氧化应激的影响,发育期的大脑则对氧化应激尤为敏感。有研究指出,C57BL/6小鼠暴露于1.3%七氟烷中6h引起神经元的损伤的机制与线粒体功能障碍导致的氧化应激有关[15]。线粒体受到七氟烷的刺激,产生过量的氧自由基(ROS),ROS可以氧化细胞内的脂质和蛋白质,使蛋白质聚积,从而使线粒体肿胀,激活凋亡因子,引起细胞凋亡[16]。Boscolo等[17]的研究指出,使用ROS抑制剂可降低七氟烷暴露引起的ROS积聚,减轻对线粒体的损伤。本研究发现,RES预处理后,SEVO+RES组SOD活性明显增强,MDA含量明显下降,说明RES可能通过其抗氧化作用减轻脂质过氧化,从而减少七氟烷暴露引起的发育期神经元损伤。
SIRT1是一种NAD+依赖的组蛋白去乙酰化酶,广泛表达于哺乳动物组织。已有研究表明,SIRT1在调节糖脂代谢、延缓细胞衰老以及抵抗氧化应激方面有积极作用[16]。近年来有大量研究发现,SIRT1高表达也具有明显的神经保护作用。PGC-1α与FOXO3α均是SIRT1下游底物,两者均与氧化应激密切相关。其中PGC-1α是一种转录调节因子,可以促进线粒体生物合成关键蛋白质如线粒体转录因子A(mitochondrial transcription factor A,TFAM)、细胞核呼吸因子1(nuclear respiratory factor 1,Nrf1)和Nrf2的转录和表达[18],对线粒体的能量代谢与生物合成具有重要作用[19],当线粒体生物合成受到RNA干扰时可介导PGC-1α水平降低,导致海马神经元回路发育突触的形成明显减少[20]。研究指出在多发性硬化症小鼠模型中,PGC-1α表达上调可以增强线粒体功能,减少氧化应激带来的损伤,从而产生神经保护作用[21];核转录因子FOXO3α属于叉头框蛋白家族,其广泛地参与了细胞周期调节、细胞凋亡、抗氧化应激损伤等多种生物调控过程[22-23],是氧化应激的重要感受器。它可以通过清除ROS降低细胞活性氧水平,同时调节抗氧化酶活性,防止脑内神经元凋亡[24]。SIRT1可以对这两者进行调节,通过去乙酰化,提高PGC-1α与FOXO3α活性,调控线粒体的生物合成,增强细胞抗氧化应激的能力,减轻细胞凋亡。本研究使用SIRT1激动剂RES有效地增强了SIRT1蛋白及其下游底物PGC-1α与FOXO3α基因的表达,说明RES可能通过提高SIRT1及其下游基因PGC-1α与FOXO3α的表达,协同促进脑内氧化应激水平降低,从而减轻神经细胞凋亡,产生脑保护作用。
Morris水迷宫是研究动物空间学习记忆能力的经典实验,常用于神经科学的研究中。为了测试新生大鼠七氟烷反复暴露后对远期学习记忆功能的影响,在出生后30d开始,我们进行了Morris水迷宫实验。有研究指出,单次或多次七氟烷暴露均会使大鼠产生不同程度的学习记忆障碍[2,20],但是也有其他研究结果表明,单次七氟烷暴露对大鼠学习记忆和行为没有影响[3,21]。本研究结果发现,无论是否进行干预,七氟烷暴露后各组大鼠在逃避潜伏期、目标象限停留时间、穿越平台次数等指标上均无明显差异。
综上,本研究发现七氟烷多次暴露可引起新生大鼠脑内氧化应激水平增高,神经细胞发生凋亡。RES预处理可通过上调SIRT1及其下游基因PGC-1α与FOXO3α的表达,降低七氟烷暴露后的氧化应激水平,减轻脑内神经细胞凋亡。但是,新生大鼠七氟烷暴露后并没有引起成长后的学习记忆损害,需要结合临床进一步长期观察进行确认。

