低温等离子体对 MCF-7 乳腺癌细胞的化疗增敏作用
易志健 江 敏 崔浩东 王 菲 周文华 黄逸凡 喻学锋
(中国科学院深圳先进技术研究院 生物医药与技术研究所 深圳 518055)
1 引 言
低温等离子体(Cold Atmospheric Plasma,CAP),作为一种由电子和离子群组成的近电中性电离气体,因其温度接近室温,且在大气压下即可产生,也被称作大气压低温等离子体,其组分主要包括活性粒子、紫外辐射、带电粒子及瞬时电场。其中,活性粒子主要有活性氧(Reactive Oxygen Species,ROS)和活性氮(Reactive Nitrogen Species,RNS)两大类。活性氧主要包括 O2-、H2O2、·OH、1O2等;活性氮主要包括·NO、·NO2、NO3-、ONOO-等[1,2]。研究表明,等离子体技术在生物医学领域表现出其特有的价值,广泛应用于血液凝固、伤口愈合、消毒灭菌、牙齿美白及肿瘤治疗等方面[3,4]。其中在肿瘤治疗方面的应用引起了国内外学者的广泛关注[5]。化疗作为当前治疗肿瘤的主要方式,在多次给药后,肿瘤细胞对化疗药物表现出明显的耐药性,极大地影响了治疗效果。为此,逆转肿瘤细胞的耐药性,寻找新型癌症治疗手段具有重大意义[6,7]。研究显示,在低温等离子体与细胞作用过程中,培养基内的 ROS 等物质浓度显著增加,从而诱发细胞凋亡[8,9],而且产生的 ROS可以影响细胞膜通透性,有利于细胞内吞的发生[10]。此外,低温等离子体可以选择性杀伤肿瘤细胞,而对正常细胞影响较小[11]。
阿霉素(Doxorubicin,DOX)作为一种广谱的化疗药物,但其本身对细胞没有选择性,容易导致肿瘤细胞产生耐药性,进而影响药效发挥[12]。而金纳米棒(Gold Nanorods,Au NRs)被细胞摄取以后,对溶酶体膜产生作用,致使溶酶体破裂,进而引发细胞坏死和凋亡[13]。相对于DOX,Au NRs 通过受体介导的内吞作用被内含体包裹后进入细胞,逃避 P-糖蛋白识别,可对耐药细胞产生杀伤[14],但也受到药物浓度和作用时间的限制。
本文提出一种双介质阻挡放电低温等离子体射流装置(以下统称“CAP”)来杀伤肿瘤细胞。同时,针对肿瘤细胞对 DOX 及 Au NRs 的耐药性,对 MCF-7 乳腺癌细胞进行化疗增敏,并探讨了化疗增敏的作用机理。
2 实验方法
2.1 实验装置的搭建

图1 低温等离子体联合化疗药物杀伤肿瘤细胞示意图Fig. 1 Scheme of cold atmospheric plasma combined chemotherapeutic drugs for cancer cell killing
实验装置如图1所示,低温等离子体负载采用双介质阻挡放电装置。其中,高压电极为直径2 mm 的铜棒,内介质为内径 2 mm、外径 4 mm的 U 型石英管,外介质为 5 mL 的石英针筒。接地电极采用细铜丝,缠绕在针筒的喷嘴处,与高压电极之间距离为 10 mm。整个实验装置作用气体选用高纯氩气,电源采用苏曼 CTP-2000K 的高压交流电源。
实验过程中,利用高压探头 Tektronix P6015A、电流探头 Pearson 6585 和示波器Tektronix TBS1102 测得放电电压峰值为 18 kV,电流峰值为 128.8 mA。利用 Fluke TiS75 红外热像仪,测得低温等离子体射流温度为 26.7℃。
2.2 低温等离子体作用后培养基内活性氧水平检测
(1)ROS 探针配制:获得 2', 7'-二氯荧光素二乙酸盐(DCFDA),溶于二甲基亚砜(DMSO)中,得到 10 mmol/L 的储备液,于-20℃ 避光保存。
(2)细胞培养:MCF-7 乳腺癌细胞于 37℃、5% CO2培养箱内培养,培养基为包含 10% 牛血清白蛋白(FBS)的改良杜氏伊格尔培养基(DMEM)。
(3)MCF-7 细胞以每孔 5×104个的密度种植于 24 孔板内,过夜培养以后,换为 500 μL 新鲜DMEM 培养基。其中,在空白 24 孔板中加入等量 DMEM 培养基,作培养基组。
(4)搭建低温等离子体设备,调节参数,调整等离子体与培养基液面的距离,进行等离子体处理。
(5)选择适当的培养时间,取 100 μL 培养基,加入 10 μmol/L DCFDA 荧光探针,于 37℃孵育 30 min,然后通过荧光光谱仪(HITACHI F-4600)检测荧光变化,激发波长为 485 nm。
2.3 低温等离子体作用后细胞内活性氧及钙离子水平检测
(1)ROS 探针配制:获得 2', 7'-二氯荧光素二乙酸酯(DCFH-DA),溶于 DMSO 中,得到10 mmol/L 的储备液,于-20℃ 避光保存。
(2)Ca2+检测探针配制:获得 Fluo 3-AM,溶于 DMSO 中,得到 2 mmol/L 的储备液,于-20℃ 避光保存。
(3)MCF-7 以每孔 5×104个的细胞密度种植于 24 孔板内,过夜培养以后,换为 500 μL 新鲜DMEM 培养基。
(4)调节等离子体参数,调整同培养基液面间的高度,进行等离子体处理。
单独紫外(UV)处理:在等离子体和孔板间加装接地铁丝网,用石英片盖住孔板,再进行处理。
单独电场处理:用防紫外玻璃片盖住孔板,再用等离子体处理。
(5)细胞于 37℃、5% CO2培养箱内继续培养2 h,然后通过荧光倒置显微镜(Olympus IX71)进行 ROS 及 Ca2+检测。
(6)细胞内 ROS 检测:采用磷酸盐缓冲液(PBS)对(5)中细胞进行清洗后,加入分散于 PBS的 10 μmol/L DCFH-DA 荧光探针。继续孵育 30 min后,进行 PBS 清洗,于 490 nm 蓝光激发下进行荧光成像检测。
(7)细胞内 Ca2+检测:采用 PBS 对(5)中细胞进行清洗后,加入分散于杜氏磷酸盐缓冲液(DPBS)的 2 μmol/L Fluo 3-AM 荧光探针。继续孵育 20 min 后,加入含有 1% FBS 的 DPBS 继续孵育 40 min。DPBS 清洗后,于 490 nm 蓝光激发下进行荧光成像检测。
2.4 金纳米棒的制备
金纳米棒(Au NRs)采用种子生长法进行制备[15],合成路径如下。
(1)制备种子液:将 5 mL 5 mmol/L 氯金酸(HAuCl4)溶液和 5 mL 0.2 mol/L 十六烷基三甲基溴化铵(CTAB)溶液互溶后,加入 4.5 mL 的超纯水,混匀。再加入用冰水现配的 600 µL 10 mmol/L硼氢化钠(NaBH4)溶液,充分搅拌 2 min,获得种子液,于室温下备用。
(2)制备生长液:先后加入 0.2 mol/L CTAB溶液 6 mL、5 mmol/L HAuCl4溶液 1.2 mL、0.1 mol/L 硝酸银(AgNO3)溶液 15 µL 和 1.2 mol/L盐酸(HCl)溶液 12 µL,再加入 10 mmol/L 抗坏血酸溶液 700 µL,轻旋使溶液由暗红色变为无色。
(3)在生长液中迅速注入 12 µL 种子液,37℃过夜反应,然后使用 12 000 rpm 离心 10 min,得到的沉淀用等体积的超纯水再分散,获得 Au NRs。经过透射电镜(JEM-3200FS)观察,Au NRs 长轴50~60 nm,短轴 10~20 nm。
2.5 低温等离子体联合化疗药物协同杀伤肿瘤细胞
(1)MCF-7 以每孔 5×104个的细胞密度种植于 24 孔板内,过夜培养以后,换为 500 μL 新鲜DMEM 培养基。DOX 及 Au NRs 按照不同浓度分散于培养基内。
(2)调节等离子体参数,稳定气流,调整升降台,使等离子体至培养基液面距离为 25 mm,进行等离子体处理。
(3)处理完成后,关闭等离子体设备,细胞于 37℃、5% CO2培养箱内继续培养至 24 h。
(4)CCK-8 细胞存活率检测:移除培养基,加入 300 μL 的 CCK-8 工作液。继续孵育 1 h后,吸取 150 μL 培养液至 96 孔板,用酶标仪测试 450 nm 处吸收值。其中,对照组为同样浓度未进行等离子体处理的化疗药物组。
(5)钙黄绿素-AM/碘化丙啶(Calcein-AM/PI)染色实验:移除培养基,加入 300 μL 分散于 PBS的 Calcein-AM/PI 工作液(2 μg/mL Calcein-AM,3 μg/mL PI),继续孵育 10 min,PBS 清洗后进行荧光成像。其中,Calcein-AM 使活细胞在蓝光(490 nm)激发下呈绿色荧光(515 nm),PI 使死细胞在绿光(535 nm)激发下呈红色荧光(617 nm)。
3 结果与讨论
3.1 低温等离子体处理后培养基内活性氧检测
低温等离子体作用细胞培养基,可以增加培养基内活性粒子的含量,主要是 ROS 的浓度有所增加。为此,通过调节等离子体参数,设定一定的电压,处理种植于 24 孔板的 MCF-7 细胞培养基,等离子体距离液面间距设定为 25 mm。处理完成后,取 100 μL 培养基用于 ROS 检测。ROS 可以将非荧光的 DCFDA 探针氧化为具有荧光信号的氧化型二氯荧光素(DCF),进而可通过荧光增加的幅度来评估培养基内 ROS的水平。等离子体处理 10% FBS 的 DMEM 培养基,不同处理时间的结果如图2(a)所示。由图2(a)可以发现,经等离子体处理后,培养基内的 ROS 浓度增加。同时,处理 10~80 s 后发现,随着处理时间的延长,ROS 浓度明显增加。此外,细胞存在的情况下,相同处理时间,培养基内 ROS 浓度有一定的降幅,认为细胞消耗了一定量的 ROS 用于磷脂和膜蛋白的氧化。同时用等离子体处理磷酸盐缓冲液(PBS)发现,荧光信号很弱,且没有随处理时间的延长而增加。推测等离子体作用培养基后产生的ROS,多数来自于等离子体与培养基内组分的相互作用。因而针对培养基内不同的组分,检测等离子体作用前后 ROS 的变化。
首先,检测培养基内 FBS 对 ROS 的影响,结果如图2(b)所示。由图2(b)可以看到,FBS浓度在 0~10% 时,ROS 的水平随着 FBS 浓度的增加而增强。但当 FBS 浓度增加至 15% 时,ROS 水平含量有所下降,且无论细胞存在与否,结果均显示出一定的降幅,表明 ROS 水平受到培养基内 FBS 的直接影响,该结论与不同 FBS浓度下 U87 细胞存活率一致[16]。其次,检测了培养基内葡萄糖浓度对等离子体处理后 ROS 的影响,结果如图2(c)所示。当无 FBS 存在时,随着葡萄糖浓度的增加,ROS 水平没有显著变化;而培养基内存在 10% FBS 时,随着葡萄糖浓度的增加,ROS 水平显著升高,进一步揭示了 FBS 对等离子体处理后培养基内 ROS 的影响。最后,检测了培养基内其他组分对 ROS 的影响,结果如图2(d)所示。在培养基内加入谷胱甘肽、丙酮酸钠及L-半胱氨酸后,培养基内 ROS 的浓度明显降低,且 FBS 存在与否没有直接影响,表明这些物质起到了抑制 ROS 的作用。综上所述,FBS 和葡萄糖对等离子体处理后培养基内 ROS 的水平存在显著的影响。因此,在进行等离子体杀伤肿瘤细胞实验时,培养基选择包含 10% FBS 的高糖 DMEM。
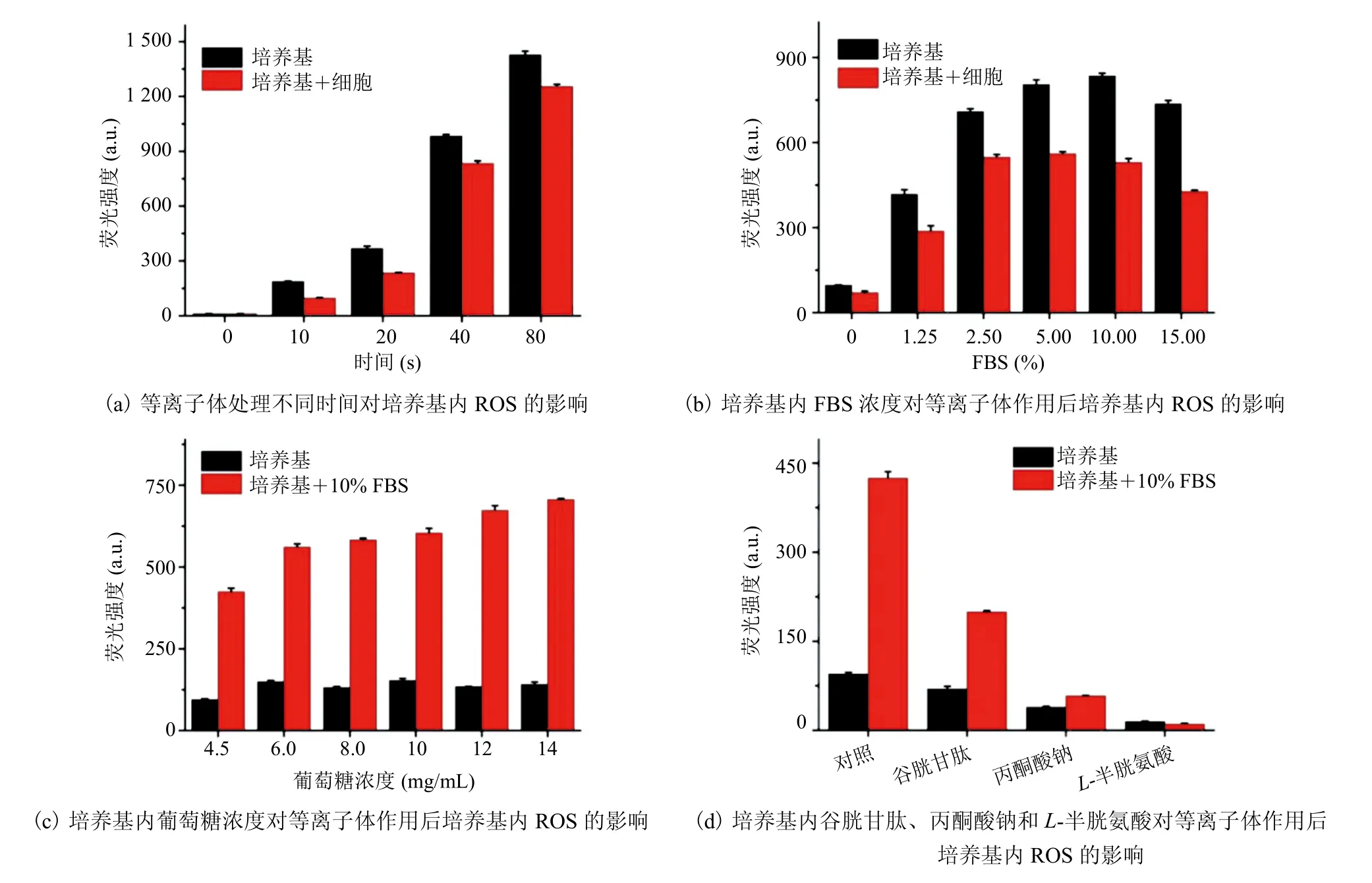
图2 低温等离子体作用后培养基内活性氧水平检测Fig. 2 Detection of reactive oxygen species levels in medium after cold atmospheric plasma treatment
3.2 细胞内活性氧及钙离子水平检测
由于培养基内 ROS 水平的变化会进一步影响细胞的存活状态,因此探究了杀伤细胞的机制。将 MCF-7 细胞种植于 24 孔板,过夜培养后,更换为 500 μL 新鲜 10% DMEM 培养基,等离子体处理时间设定为 40 s。处理完成后,细胞于 37℃ 培养箱内继续孵育 2 h,然后进行细胞内ROS 及 Ca2+水平检测。其中,细胞内 ROS 检测选择 DCFH-DA 探针,该探针本身没有荧光,被细胞摄取后,细胞内的酯酶将其水解为不能透过细胞膜的还原型二氯荧光素(DCFH),接着细胞内的 ROS 将其氧化为具有绿色荧光信号的DCF,通过细胞内荧光信号的强弱从而评估细胞内 ROS 水平。细胞内 Ca2+水平通过荧光探针Fluo 3-AM 进行检测:细胞摄取 Fluo 3-AM 后,酯酶将其水解为 Fluo 3 而滞留在细胞内,Fluo 3与细胞内 Ca2+结合后,表现出显著的绿色荧光。细胞内 ROS 及 Ca2+水平检测结果如图3所示,等离子体处理细胞后,细胞质显示出绿色荧光信号,表明细胞内存在 ROS 和 Ca2+。而处理前加入 ROS 抑制剂 N-乙酰半胱氨酸(NAC)后,荧光信号显著降低减弱,表明细胞内的 ROS、Ca2+主要来自于培养基。此外,单独电场及 UV作用细胞后,细胞内的荧光信号并没有增加,表明培养基内的 ROS 可能来自于等离子体产生的活性粒子与培养基内组分的相互作用。培养基内的 ROS 作用于细胞膜,改变了细胞膜的通透性,进而将细胞外的 ROS、Ca2+及其他物质转运至细胞内,而细胞内 ROS、Ca2+水平的增加进一步诱导细胞凋亡的发生。
3.3 低温等离子体联合化疗药物杀伤肿瘤细胞
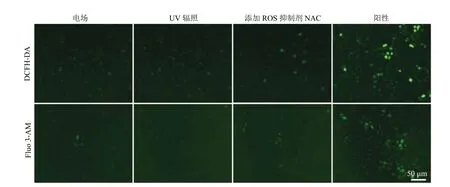
图3 低温等离子体作用后细胞内活性氧及 Ca2+ 水平检测(比例尺均为 50 μm)Fig. 3 Detection of intracellular reactive oxygen species and Ca2+ levels after cold atmospheric plasma treatment
低温等离子体作用培养基产生大量的 ROS,使得细胞膜通透性发生改变,将外源 ROS 和Ca2+转运至细胞内,诱发细胞凋亡。与此同时,细胞膜通透性的改变,一定程度上增加了细胞对外源物质的摄取,因而可以将一些化疗药物或具有化疗效果的纳米材料更多地转运至细胞内,从而显示出增敏耐药性细胞化疗的效果。本文选择 DOX 和 Au NRs 联合等离子体来杀伤肿瘤细胞。首先,将化疗药物按照不同浓度加入到细胞培养基中,等离子体处理 40 s后,MCF-7 细胞继续孵育至 24 h;然后,通过CCK-8 法检测细胞存活率,同时通过 Calcein-AM/PI 进行细胞活死染色。等离子体联合 DOX杀伤细胞的 CCK-8 结果如图4(a)所示。由图4(a)可以看到,等离子体单独作用细胞,显示出 20% 的细胞杀伤效率。MCF-7 细胞对 DOX表现出浓度依赖的细胞毒性:当 DOX 浓度为4 μg/mL 时,显示出 46% 的细胞杀伤效率;而联合等离子体治疗后,细胞杀伤效率增加至 88%。表明除了等离子体带来的细胞毒性外,通过改善细胞膜通透性,增加细胞对 DOX 的摄取,进而增敏了 DOX 的化疗效果。等离子体联合 Au NRs 杀伤肿瘤的 CCK-8 结果如图4(b)所示。联合治疗的细胞杀伤率为 90%,而 16 μg/mL Au NRs 带来的细胞杀伤效率仅为 64%,也显示出等离子体增敏化疗的效果。相对于等离子体联合 Au NRs 的治疗效果,联合 DOX 表现出更好的增敏效果。表明细胞膜通透性的增加对于小分子药物的转运好于稍大尺寸的 Au NRs(长轴:(55.8±3.54)nm;短轴:(12.4±1.43)nm)。接下来,分别选择2 μg/mL DOX、16 μg/mL Au NRs 联合等离子体治疗癌细胞。在相应浓度下,2 种药物单独杀伤效率都在 50% 以上。分别取药物单独处理或药物联合等离子体处理后 24 h 的细胞进行 Calcein-AM/PI 活死细胞染色实验,其中绿色荧光信号表示活细胞,而红色荧光表示死细胞,染色结果如图4(c)所示。相对于单独药物组,等离子体联合治疗后,红色荧光信号显著增加,进一步证实了等离子体对 MCF-7 乳腺癌细胞显示出化疗增敏的效应。
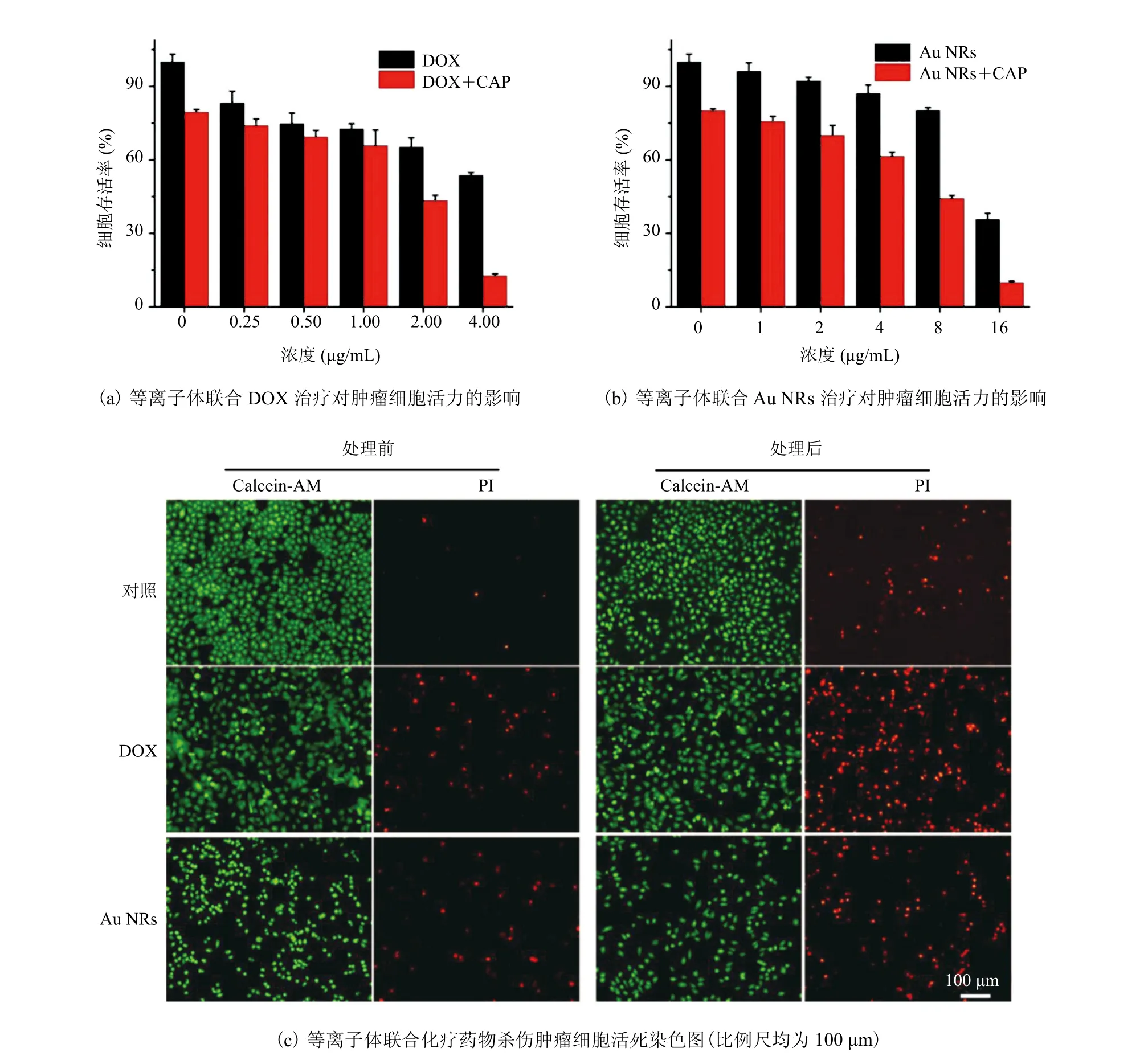
图4 低温等离子体联合化疗药物杀伤肿瘤细胞Fig. 4 Cold atmospheric plasma combined chemotherapeutic drugs for cancer cell killing
4 与国内外相似研究对比分析
Graves 与 Bauer[17]认为低温等离子体产生的活性氧/氮物质引发了凋亡介导的信号通路。Yan等[16]使用低温等离子体装置处理含不同 FBS 浓度(0、10%、20%、30%)的培养基发现,随着培养基中 FBS 浓度的增加,U87 细胞存活率增加。本文中 15% FBS 的培养基经过等离子体处理后,培养基内 ROS 水平有所降低,细胞存活率上升,与 Yan 等[16]实验结果一致。但是 0~10% FBS 的培养基经处理后,ROS 水平上升,对应的细胞存活率降低,填补了 FBS 浓度小于 10% 时等离子处理对细胞影响的空白。
Torii 等[18]发现低温等离子体能有效诱导胃癌细胞凋亡,且对正常成纤维细胞(WI-38)没有显著的凋亡发生。Mirpour 等[19]发现等离子体能显著降低乳腺癌细胞活力,对正常细胞影响不大。Jalili 等[20]使用低温等离子体联合铁纳米颗粒降低MCF-7 细胞存活率。Cheng 等[21]使用等离子体处理 U87 人胶质瘤细胞后,细胞摄取金纳米颗粒的效率显著增加,而正常人星形胶质细胞(E6/E7)对金纳米颗粒的摄取速率没有显著增加,其表现出的细胞选择性,使低温等离子体可以联合金纳米颗粒对肿瘤细胞进行杀伤。Zhu 等[22]认为等离子体联合载药核壳纳米颗粒杀伤肿瘤,主要通过下调癌细胞增值和转移相关基因的表达,以及增加细胞对载药核壳纳米颗粒的摄取,来有效改善化疗中细胞的耐药性。本文通过等离子体联合 DOX及 Au NRs 杀伤肿瘤细胞,通过改善细胞膜通透性,增加了肿瘤细胞对药物的摄取速率,进一步增敏了 DOX 和 Au NRs 的化疗效果。
5 结论与展望
低温等离子体作用细胞以后,培养基内 ROS水平随着处理时间的增加而显著上升,且细胞的存在一定程度上消耗了培养基内的 ROS。在 0~10% FBS 范围内,培养基内 ROS 水平随着 FBS 浓度的增加而升高;而 FBS 浓度增加至15% 时,ROS 水平开始下降,且细胞存活率同FBS 浓度呈负相关。同时葡萄糖浓度的改变也对培养基内 ROS 的增加有所贡献。培养基内存在谷胱甘肽、丙酮酸钠和L-半胱氨酸时,ROS 会显著降低,揭示其起到抑制 ROS 的作用。培养基内 ROS 的增加进一步改善了细胞膜通透性,使得外源 ROS 和 Ca2+水平显著增加,而单独电场及 UV 作用并没有增加细胞内的 ROS 和 Ca2+。与此同时,处理前添加 ROS 抑制剂 NAC 后,细胞内 ROS、Ca2+浓度也显著降低。表明等离子体作用培养基产生的 ROS,通过影响细胞膜通透性来提高细胞内 ROS 和 Ca2+水平,进一步诱导细胞凋亡。等离子体单独作用细胞,可以杀伤 20%的 MCF-7 乳腺癌细胞。分别联合 DOX、Au NRs治疗后,细胞杀伤效率增加为 88% 和 90%,而单独药物治疗的杀伤效率只有 46% 和 64%,揭示了等离子体对 MCF-7 乳腺癌细胞的化疗增敏效果。
低温等离子体作用细胞产生 ROS 的机理还不够明确,细胞膜通透性改变的机制还需要进一步研究。但等离子体能选择性致死肿瘤细胞、改善细胞膜通透性及增敏化疗效果,可为抗肿瘤提供一种新的思路。等离子体技术与抗癌药物或纳米材料有机结合,能够极大地提高癌细胞的灭活效果,在癌症治疗领域尤其是皮下治疗具有广阔的应用前景。

