中性粒细胞/淋巴细胞比值对伴脏器损害过敏性紫癜的临床意义
姜启海 薛晓彤, 党宁宁
IgA型血管炎(IgAV),又称为过敏性紫癜(Henoch-Schönlein Purpura, HSP),是一种免疫复合物介导的小血管白细胞碎裂性血管炎,本病好发于学龄前儿童,儿童发病率高于成人[1]。其主要特征为非血小板减少性可触及皮肤紫癜样皮疹,并伴有腹痛、便血或黑便、关节疼痛和肿胀、蛋白尿或血尿等其他临床表现。相比于儿童过敏性紫癜而言,成年HSP患者更容易发生脏器受累,出现消化道出血并发展为慢性肾病,因此迫切需要找到一种预后标志物来预测疾病的发展。中性粒细胞与淋巴细胞比率(Neutrophils to lymphocytes ratio, NLR)是一种便宜且易于获得的判断炎症性疾病的定量实验室指标,已被用于预测各种系统恶性肿瘤、心血管疾病和肝硬化患者的临床预后[2-6]。由于该比值整合了两种有关免疫途径的信息,因此它可能有超过其他炎症参数的预测能力。本研究回顾分析HSP患者NLR值等血液学指标,以判断其对于诊断与预测伴脏器损害型HSP预后的临床价值。
1 资料与方法
1.1 临床资料 76例过敏性紫癜患者来自2011-2017年山东大学附属济南市中心医院皮肤科住院患者,其中男39例,女37例;年龄5~75岁,平均年龄(24.88±19.59)岁。收集患者初次就诊时的相关资料,包括:门诊病历,出入院记录,病程记录,最初的实验室检查数据及治疗效果。
1.2 方法
1.2.1 诊断标准与剔除标准 HSP的诊断标准:①分批反复出现于下肢为主的可触及性紫癜;②伴有胃肠道或关节的症状或肾脏受累的表现;③血小板计数及凝血功能正常;④排除其他原因所致的血管炎及紫癜。
过敏性紫癜(腹型)的诊断标准:①明显的紫癜;②腹痛;③消化道出血(呕血,黑便,便血);④否认特殊用药史;⑤腹部CT或B 超排除其他因素导致的腹痛。符合3 条或3 条以上可以诊断为腹型过敏性紫癜。
过敏性紫癜(肾型)的诊断标准:HSP病程中(6个月内)出现血尿(在没有并发尿路感染、尿路结石以及抗凝治疗的情况下,离心标本中,每个高倍视野中>5个红细胞)和(或)蛋白尿(>150 mg/24 h),或者肾活检标本中显示在系膜区存在IgA为主的免疫复合物沉积。
2种以上并存的称之为混合型过敏性紫癜。
伴脏器损害型过敏性紫癜包含肾型HSP、腹型HSP和混合型(肾型+腹型)HSP,注意要排除关节型HSP。
剔除标准:①曾予以糖皮质激素或免疫抑制剂治疗;②有免疫学异常、恶性肿瘤、血液病、冷球蛋白血症、慢性肾病和胃肠疾病;③近期有上呼吸道感染等感染病史。
1.2.2 病理随访及标本采集和检测 初次就诊时,76例HSP患者中,32例诊断为单纯型HSP,13例诊断为肾型HSP,13例诊断为腹型HSP,18例诊断为混合型(肾型+腹型)HSP。所有患者于治疗前采集清晨空腹静脉血,行血细胞分析,记录中性粒细胞、淋巴细胞、红细胞、白细胞计数、血小板、血红蛋白等绝对值,并计算NLR(中性粒细胞计数/淋巴细胞计数)值;检测红细胞沉降率(ESR)等指标。
1.3 统计学方法 采用SPSS 18.0软件进行分析,计量资料采用均数±标准差表示,两组样本之间比较采用Studentt检验;多组样本之间的比较用方差分析;计数资料采用卡方检验。P<0.05为差异具有统计学意义。ROC工作曲线计算曲线下面积评估NLR、ESR、WBC等对脏器损害的HSP的临床诊断价值。
2 结果
2.1 两组患者一般情况及血液学指标比较 累积脏器损害的HSP组中,男28例,女16例,年龄平均(21.21±16.79)岁。单纯型HSP组中,男11例,女21例,平均年龄(29.94±22.17)岁。两组患者年龄无统计学差异(P>0.05),具有可比性。
伴脏器损害的HSP组患者中性粒细胞/淋巴细胞比值(NLR)为(3.22±1.31),单纯型HSP组的HLR比值为(2.43±1.14),两组比较有统计学差异(P<0.05)。伴脏器损害HSP组患者血沉为(26.91±21.86)mm/h,单纯型HSP组为(25.45±15.35)mm/h,组间比较无统计学差异(P>0.05)。伴脏器损害HSP组中白细胞计数为(10.30±3.33)×109/L,高于单纯型HSP组的(9.06±2.39)×109/L,组间比较差异无统计学意义(P>0.05)。伴脏器损害的HSP组患者与单纯型HSP组患者相比,其血红蛋白、红细胞计数以及血小板计数指标也均无统计学差异(P>0.05)。见表1。

表1 两组间患者血液学指标比较
2.2 伴脏器损害的HSP患者一般情况及血液学指标比较 我们将伴脏器损害的HSP患者细分为肾型HSP组、腹型HSP组和混合型(肾型+腹型)HSP组。三组之间患者年龄无统计学差异(P>0.05),具有可比性。
根据方差分析结果显示:伴脏器损害的HSP患者中,肾型HSP组NLR比值为(3.22±1.43),腹型HSP组NLR值为(3.33±1.45),混合型(肾型+腹型)组NLR值为(3.13±1.16),组间比较无统计学差异(P>0.05);肾型HSP组患者血沉为(24.07±22.43)mm/h,腹型组血沉为(31.30±23.61)mm/h,混合型组为(25.78±20.46)mm/h,组间比较无统计学差异(P>0.05);伴脏器损害HSP组中,肾型组白细胞计数为(10.654±3.71)×109/L,腹型组白细胞计数为(11.23±3.81)×109/L,混合型白细胞计数为(9.37±2.52)×109/L,组间比较无统计学差异(P>0.05);腹型、肾型、混合型HSP三组相比,其血红蛋白、红细胞计数以及血小板计数指标均无统计学差异(P>0.05),见表2。
2.3 血液学指标对伴脏器损害HSP诊断的评价 ROC曲线下面积评估血液学指标对伴脏器损害HSP的诊断意义,NLR的AUC为0.708,比较差异具有统计学意义(P<0.05),对伴脏器损害的HSP有一定的临床诊断价值;白细胞计数和血红蛋白的AUC均大于0.5,但差异并无统计学意义(P>0.05),因此对伴脏器损害的HSP并无临床诊断价值;血沉的AUC为0.442,小于0.5,对伴脏器损害的HSP无临床诊断价值。根据约登指数(Youden index)得出NLR的最佳临界值为2.40,敏感度和特异度分别为68.2%、78.1%。见表3。
2.4 HSP患者NLR与其他血液学指标间的相关性 将HSP患者NLR比值与其他相关血液学指标作比较,Pearson相关分析结果显示:NLR与白细胞计数P<0.05)有相关性,但与血沉(P>0.05)、血红蛋白(P>0.05)、红细胞计数(P>0.05)以及血小板计数(P>0.05)均不相关。将白细胞计数和NLR数据绘制散点图,可见两数值之间存在一种依存变化的关系,白细胞计数增加,NLR比值也随之增加,且散点呈线性正相关。见表4,图1。

表2 伴脏器损害HSP患者血液学指标比较
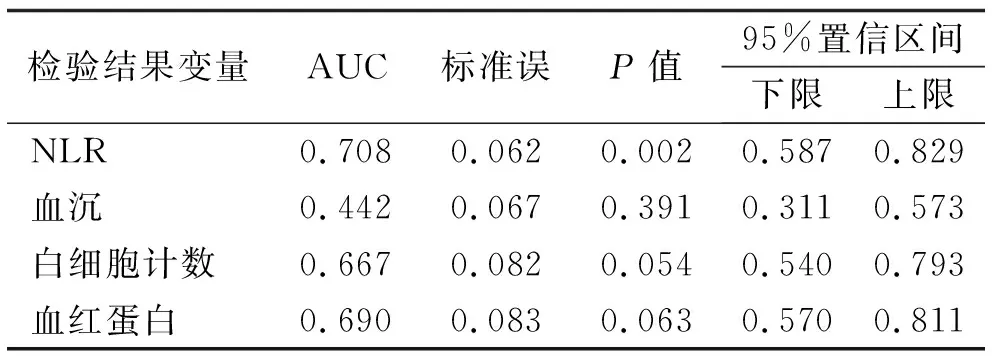
表3 血液学指标对脏器损害型HSP的诊断评价

表4 HSP患者NLR与其他血清标志物的相关性

图1 WBC与NLR的散点图
3 讨论
过敏性紫癜,即IgA型血管炎,是一种主要发生于儿童和青少年时期、以小血管炎为主要病变的全身性血管炎综合征,其典型临床表现为可触及的皮肤紫癜,常伴有关节胀痛、腹痛、便血等其他表现。 此外,许多HSP患者可能会有血尿或蛋白尿作为肾脏受累的证据,但这很少进展为永久性肾脏损害[7]。 HSP的发病原因复杂,主要与遗传因素与环境因素有关,如各种病原体感染,异体蛋白食物的摄入以及特殊药物等都有可能诱发HSP的发生[8]。HSP的致病机制主要与免疫系统和免疫炎症反应调节紊乱相关,发生III型变态反应,致使大量IgA免疫复合物沉积于小血管壁,激活补体,引起毛细血管和小血管壁及其周围产生炎症[9]。基本病理改变为真皮浅层毛细血管和细小血管的内皮细胞肿胀,管壁有纤维蛋白沉积、变性和坏死,血管及周围有中性粒细胞浸润,有核破碎、水肿及红细胞外渗。HSP被认为是一种自限性疾病,一般预后良好。近期预后与消化道受累的程度有关,远期预后与肾脏受累的严重程度有关。HSP短期内潜在的消化道严重并发症可表现为肠出血、肠梗阻、肠穿孔以及肠套叠,而临床上以消化道症状为首发症状或腹痛为唯一临床表现的HSP常易被误诊为消化道溃疡、急性肠胃炎等延误治疗。此外,有研究表明,皮疹持续时间长更易造成肾脏组织损伤,成人HSP患者更容易出现延迟肾脏受累。因此,探索部分血液学指标与脏器损害型过敏性紫癜的相关性,对伴脏器损害的HSP临床诊断、疗效评估及预测预后具有一定的研究意义。
NLR(中性粒细胞/淋巴细胞)比值被认为是可以预测疾病炎症程度的一种潜在有用性指标。例如,近些年研究显示,NLR比值与心血管疾病、恶性肿瘤、囊性纤维瘤和家族性地中海热患者的预后不良密切相关[10-12]。尽管NLR比值不能阐明过敏性紫癜中炎症与免疫反应之间的复杂联系,但是HSP是一种以中性粒细胞为主的全身性血管炎,所以我们有理由认为,在HSP中,高NLR比值是与免疫反应的严重程度有一定的相关性。中性粒细胞计数升高和淋巴细胞计数降低常见于各种感染性和非感染性因素引起的系统性炎症疾病以及应激反应中[13,14]。此外,有研究发现,淋巴细胞减少症可能发生于一些炎症性疾病,如败血症等,这是由于淋巴细胞凋亡数增加所导致的[15]。已有相关研究表明,HSP患者的中性粒细胞计数显著高于健康人群,同时HSP患者中NLR比值也明显高于正常人群[16]。而近期也有研究证实,NLR比值对HSP中胃肠道出血症状的预测具有一定的临床意义[17]。最近,匈牙利研究者的一篇回顾性分析显示,NLR比值是成人HSP累及系统损害的潜在诊断指标,可用于诊断有发生皮外表现风险的HSP患者[7]。同时文中数据表明,NLR比值与疾病严重性评分呈显著正相关[7]。并且,也有研究表明NLR比值可以评估HSP消化道并发症的严重性[18]。因此,我们推断NLR可能与HSP的严重程度有关。
本研究结果显示,伴脏器损害的HSP患者的NLR比值明显高于单纯型组的患者,差异有统计学意义(P<0.05)。而其他血液学指标如白细胞计数、红细胞计数、血小板计数及血沉等,两组比较均无统计学意义(P>0.05)。该研究结果表明,NLR比值对于HSP伴脏器损害的诊断与预测具有一定的临床意义。随后我们又将伴脏器损害HSP患者细分为腹型HSP患者、肾型HSP患者以及混合型(肾型+腹型)HSP患者,进行两两比较分析各项血液学指标,结果显示NLR比值及其他血液学指标均无明显差异(P>0.05)。该结果证明,NLR比值在不同脏器损害的HSP患者之间是没有差异的,NLR比值并非器官特异性的预后指标。
另一方面,利用ROC曲线评估血液学指标对伴脏器损害HSP的临床诊断价值,结果显示NLR比值的AUC为0.708,可作为HSP伴脏器损害的诊断指标;其最佳临界值为2.40,敏感度和特异度分别为68.2%和78.1%,即NLR>2.40可作为诊断和预测HSP伴脏器损害的简易实验室指标。
综上所述,HSP伴脏器损害患者的NLR比值明显高于单纯型HSP患者,且NLR比值与白细胞计数呈显著正相关关系;ROC工作曲线分析,NLR的AUC为0.708,NLR比值>2.40可作为诊断和预测HSP伴脏器损害预后的简易实验室指标,对伴有脏器损害HSP的临床诊断和预测预后有一定的临床价值。

