生物解离大豆乳状液中蛋白质结构特征分析
王立敏,陈 思,丁 俭,齐宝坤,王中江,江连洲,隋晓楠,Olga Olegovna BABICH,李 杨*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
生物解离作为一种新兴的经济、安全、绿色提油技术,以机械破碎和酶解为手段,提取条件温和,且提取的油脂品质较高、色泽较好[1]。但是,提油过程中由于双亲性磷脂、蛋白质对油脂的亲和力,导致大部分油脂被包裹在乳状液中,限制了油脂提取率,很大程度降低了该技术的经济效益[2]。因此,探究乳状液的稳定特性,从而选择合适的破除技术是提高油脂提取率的重要途径之一。其中具有特殊功能性质的蛋白质是乳状液失稳的关键因素[3]。
近年来,较多关于酶解对乳液中蛋白质结构性能的研究。这些研究通常利用不同水解度(degree of hydrolysis,DH)的蛋白质制备乳液,分析酶解后蛋白质的结构特征变化。Avramenko等[4]研究表明酶解可以改变蛋白质的疏水位点,从而使表面疏水性及乳化特性发生变化;Zheng Lin等[5]研究表明酶解过程也可以改变蛋白亚基、构象及疏水性氨基酸组成,从而改变乳液的稳定性。也有利用相反的方法来研究酶解对乳液中蛋白结构影响,即利用不同DH的天然乳液,从乳液中分离具有不同DH的肽,并分析不同酶解程度的蛋白质结构变化,Zhang Shaobing等[6]比较了水酶法花生乳状液中蛋白与未酶解的花生蛋白表面特性(表面疏水性、二硫键、乳化特性、表面张力),发现经过酶解后乳状液中蛋白质的二硫键、表面疏水性、乳化特性均下降,且发现由酶解引起的蛋白质分子质量、二硫键含量及表面疏水性的急剧下降有助于乳液的失稳。但是目前缺乏关于生物解离大豆乳状液蛋白质的研究,且具有特殊功能性质的蛋白质是稳定乳状液的关键因素,分析乳状液蛋白质结构及表面特性是实现乳状液失稳的有效途径。
Morales等[7]研究指出随着酶解程度加深,生物解离大豆乳状液越来越不稳定。因此为了探究蛋白质/多肽稳定乳状液机制,采用酶解时间(1、2、3 h)、酶添加量(1%、2%)作为研究条件,通过扫描电子显微镜观察、乳化特性、表面疏水性、氨基酸分析及傅里叶变换红外光谱对不同酶解程度下的乳状液蛋白质/多肽表面性质及结构进行分析,以期为大豆生物解离过程中避免或减少乳状液形成、寻求适当的破乳方法提供依据与应用指导。
1 材料与方法
1.1 材料与试剂
挤压膨化大豆粉(挤压膨化后的豆粕经研磨过60 目筛;成分:蛋白质质量分数40%,脂肪质量分数17%,纤维素质量分数7%) 山东高唐蓝山股份有限公司;碱性蛋白酶Protex 6L(8 900 U/mL) 诺维信生物技术有限公司;盐酸、氢氧化钠、丙酮等化学试剂均为分析纯。
1.2 仪器与设备
磁力搅拌器 广州仪科实验仪器有限公司;水浴锅英国IKA公司;PHS-25数显台式酸度计 上海雷磁仪器厂;FD5-3型冷冻干燥机 美国SIM公司;L-8900全自动氨基酸分析仪Allegra64R台式高速冷冻离心机、S-3400扫描电子显微镜 日本Hitachi公司;MAGNA-IR560傅里叶变换红外光谱仪 美国尼高丽公司。
1.3 方法
1.3.1 生物解离大豆乳状液蛋白质的制备
根据江连洲等[8]的方法制备生物解离大豆乳状液,首先称取一定量的挤压膨化大豆粉,按照质量比1∶6加入蒸馏水,再加入精准量取的Protex 6L碱性蛋白酶添加量1%、2%,用玻璃棒快速搅拌均匀并放入55 ℃水浴锅中进行恒温酶解,用2 mol/L NaOH溶液调节匀浆pH值为9.0,分别酶解1、2、3 h后,再利用2 mol/L HCl溶液调节pH值至7,然后100 ℃加热5 min进行灭酶处理。灭酶后于4 ℃、9 000×g离心20 min,离心后吸取游离油,倒出水解液后得到乳状液。乳状液水相中蛋白质提取方法采用丙酮沉淀法[9],将冰丙酮与乳状液按照体积比20∶1于-18 ℃反应2 h,然后于4 ℃、12 000×g离心15 min,除去上清液后的沉淀利用冰丙酮洗涤5~6 次,直到溶剂由黄色变成无色,最后蛋白质经冻干成粉末。
1.3.2 扫描电子显微镜观察
将冻干后的乳状液蛋白样品固定在样品台上镀金,镀金方法:离子溅射;镀金条件:15 kV、15 mA、2.5 min。最后将样品置于扫描电子显微镜(15 kV)下观察其显微结构。
1.3.3 乳化活性和乳化稳定性的测定
参照Zhang Shaobing等[6]的方法测定乳状液蛋白质的乳化活性指数(emulsion activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI):取30 mL不同酶解条件下乳状液蛋白质溶液,分别加入10 mL大豆油均质使其混合均匀,取50 μL上述乳液加入5 mL 0.1 g/100 mL十二烷基硫酸钠溶液,涡旋振荡混匀后在500 nm波长处测定吸光度A0。静置30 min后再次测定吸光度A30。EAI和ESI按公式(1)、(2)计算:
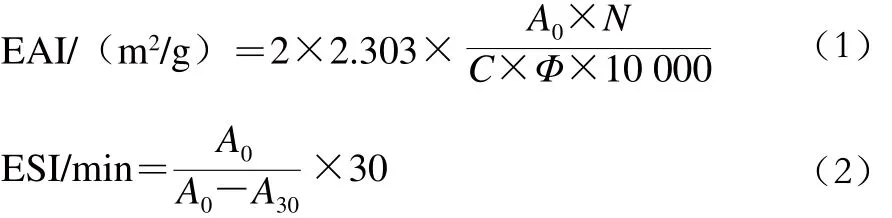
式中:N为稀释倍数(250);C为乳液在形成前蛋白质水溶液中蛋白质的质量浓度/(g/mL);Φ为乳状液中油相体积分数/%;A0、A30分别为0、30 min时的吸光度。
1.3.4 表面疏水性的测定
依据Kato等[11]的方法,即ANS荧光探针法。称取0.025 g不同酶解条件下的蛋白质样品溶于50 mL 0.01 mol/L pH值为7的磷酸盐缓冲液中,25 ℃搅拌1 h,然后以10 000×g离心30 min,利用Lowry法测定上清液蛋白质浓度,用0.01 mol/L磷酸盐缓冲溶液依次将样品稀释,得到浓度为0.005~0.5 mol/mL蛋白质溶液,取溶液4 mL,分别加入40 μL 8 mmol/L的ANS溶液,快速振荡静置5 min后,测定样品的荧光强度。测定条件:激发波长390 nm,发射波长468 nm,夹缝5 nm,扫描速率10 nm/s。以荧光强度和蛋白质浓度作图,表面疏水性指数(S0)为蛋白质分子的初始段斜率。
1.3.5 氨基酸组成测定
利用氨基酸全自动分析仪酸水解法分别测定不同样品氨基酸组成,取一定的样品加入6 mol/L盐酸溶液封管,然后在110 ℃烘箱中水解22 h,水解后用0.45 μm滤膜进行过滤,将滤液倒入50 mL容量瓶中,并用水定容。取1 mL浓缩,复溶,重复2~3 次后过滤进样,进样量50 μL。测定乳状液蛋白质中17 种氨基酸含量[12]。
1.3.6 傅里叶变换红外光谱的测定
红外光谱测定采用KBr压片法,称取真空冻干蛋白样品1 mg,加入溴化钾100 mg,然后在玛瑙研钵中研磨约15 min,随后进行压片处理,压片机在14 kg压力下约保持1 min压片后进行测定。在室温条件下,设定扫描波数谱段范围4 000~400 cm-1,分辨率设定为4 cm-1,在波数精度0.01 cm-1条件下扫描64 次,不同处理的图谱扫描重复3 次。利用Peakfit Version软件分析谱图,采用Gauss峰形进行拟合后估算出子峰的位置和个数,根据各子峰与二级结构对应关系,利用积分面积计算各二级结构的相对含量[13]。
1.4 数据统计
所有实验均重复3 次,利用ANOVA进行差异显著性分析,并用Origin 8.0和Excel统计分析数据并绘图,P小于0.05为具有显著性差异。
2 结果与分析
2.1 不同酶解条件下乳状液蛋白质微观形态


图1 不同酶解条件下乳状液蛋白的扫描电子显微镜(×3 000)Fig. 1 Scanning electron microscope images of protein emulsions prepared under different enzymatic hydrolysis conditions ( × 3 000)
扫描电子显微镜可以直观地观察到酶解后乳状液蛋白质的结构变化(颗粒大小、形状),分析油滴被蛋白包裹状态,进而分析乳液的稳定性[14]。前人研究了乳状液结构,其球状油滴由表面蛋白包裹而成[1],且发现酶解刚开始油滴被蛋白包裹,油脂与蛋白两相分明,且大小分布均匀;随着酶解进行,覆盖在油滴表面的蛋白进入游离油相中,油滴发生聚集。据前期研究可知[15],随着酶解程度加深,DH逐渐增大。由图1可知,在相同条件下观察不同酶解程度的乳状液蛋白质,发现其结构发生了明显变化。酶解1 h时,乳状液蛋白表现为致密有序的网状结构,根据乳状液结构分析,油脂可以较好地填充在蛋白质的网络空间内,使乳状液结构更加稳定、均一,这与前期的研究[15]一致。随着酶解程度的增加,乳状液表面蛋白从油滴表面脱落,其结构由致密网状结构变成了无规则的絮状如图1C、D所示,从而导致油滴发生聚集,乳状液逐渐不稳定[2]。酶解3 h时乳状液蛋白质的电子显微镜图更是发生了明显变化,结构和质地变得疏松,紧密性逐渐减弱,并出现微小孔洞如图1E、F所示。这主要由于刚开始DH比较低,部分蛋白质尚未水解掉,如图1A、B中尚残留有部分片状蛋白质;随着酶解程度的增加,乳状液中的蛋白分子骨架被打开,酶分子进入蛋白分子内部,加深了蛋白质的酶解程度使其结构及质地变得疏松,紧密性越来越弱[16],导致蛋白质越发失去了稳定乳状液的作用。
2.2 不同酶解条件对乳状液蛋白质EAI和ESI的影响
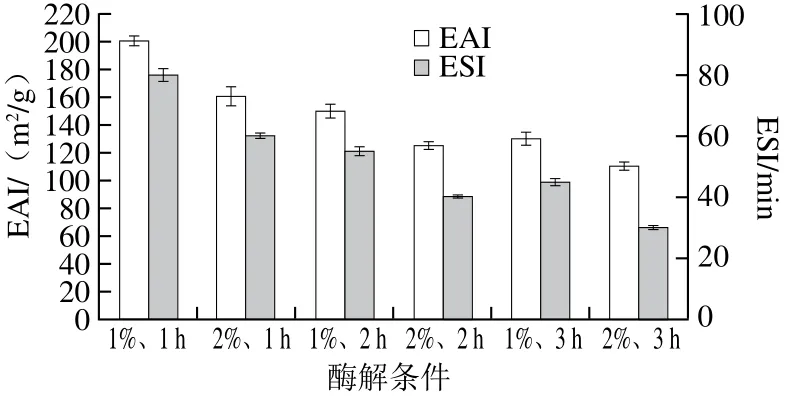
图2 不同酶解条件对乳状液蛋白质EAI及ESI的影响Fig. 2 Effect of different hydrolysis conditions on emulsion activity index and stability index of protein emulsions
EAI表示的是乳状液中蛋白质/肽能够强烈吸附在油-水界面形成乳化层的能力;ESI代表乳状液中乳滴的稳定能力。EAI和ESI为乳状液中蛋白质/肽乳化特性及稳定性的重要指标之一[17]。Zhao Qiang[18]及Lam[19]等研究发现酶解不利于蛋白质的乳化特性,蛋白质的乳化特性和肽的尺寸之间存在明确联系,即酶解产生的小分子质量肽会使蛋白质溶解性增加,降低蛋白质的乳化特性;同时,小分子质量肽会降低界面张力不足以稳定乳液,也会削弱其乳化特性。经由不同酶解时间(1、2、3 h)及不同酶添加量(1%、2%)后,从图2可以看出,随着酶解的进行,EAI和ESI总体也都呈现逐渐降低的变化趋势,且变化较明显,由酶解条件1%、1 h(EAI为200 m2/g,ESI为80 min)变化到2%、3 h(EAI 为110 m2/g,ESI为30 min),这主要由于随着酶解过程的进行,吸附在油滴表面的蛋白被酶解成小分子质量的肽,导致其从油滴表面脱落,再重新与油滴吸附时,不能迅速吸附在油滴表面,界面膜遭受破坏,无法保持完整性,其EAI和ESI大幅度降低[20]。另外,蛋白酶的过度酶解也会使维持界面蛋白的内部结构力(包括氢键、范德华力、离子键等)逐渐被破坏,使包裹油滴的保护膜越来越薄,导致EAI和ESI的降低[21],这也是乳状液失稳的重要原因之一。
2.3 表面疏水性结果
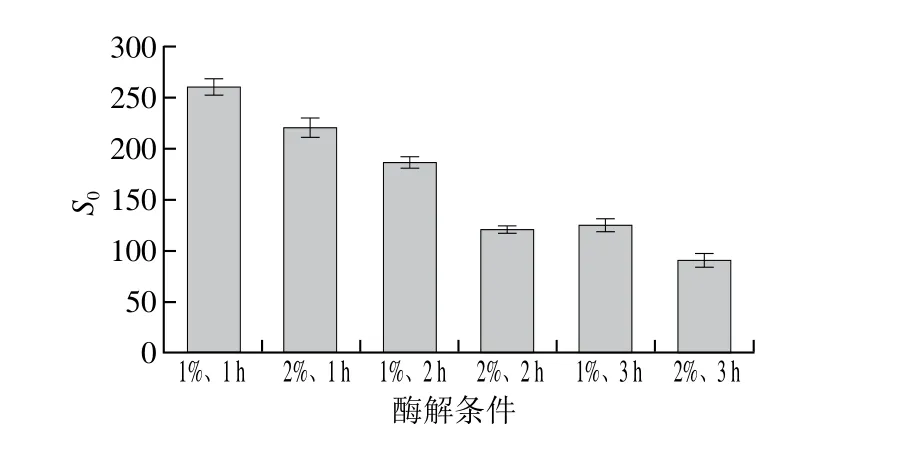
图3 不同酶解条件对乳状液蛋白质表面疏水性的影响Fig. 3 Effect of different hydrolysis conditions on surface hydrophobicity of protein emulsions
S0是用来表征蛋白表面疏水基团数量的一个重要指数,也是反映蛋白质分子结构变化的重要指标之一[22]。Zhang Shaobing[6]与Betancur[23]等发现蛋白质发生酶解时会暴露出大量的疏水性残基,同时在酶解反应过程中,暴露出的疏水性残基会发生交联聚集,导致蛋白质疏水性下降。图3为不同酶解条件下的乳状液蛋白质表面疏水性,酶添加量1%、酶解时间1 h时,S0最大(260),随着酶解时间延长及酶添加量的增加,S0逐渐减小,酶添加量2%、酶解时间3 h时,S0达到最小值(90),这与Betancur等[23]结果一致。推测是由于酶解过程中,蛋白质发生变性而暴露出内部的疏水残基,亚基之间通过疏水相互作用而发生聚集,形成可溶性或不可溶性的聚集体,这些聚集体会对蛋白质的疏水区域产生屏蔽作用,阻碍了疏水基团与荧光探针ANS的有效结合,导致乳状液蛋白质表面疏水性降低[24],蛋白疏水性降低使其不容易吸附于油滴表面,从而使乳状液失稳。
2.4 乳状液中蛋白质的氨基酸组成分析
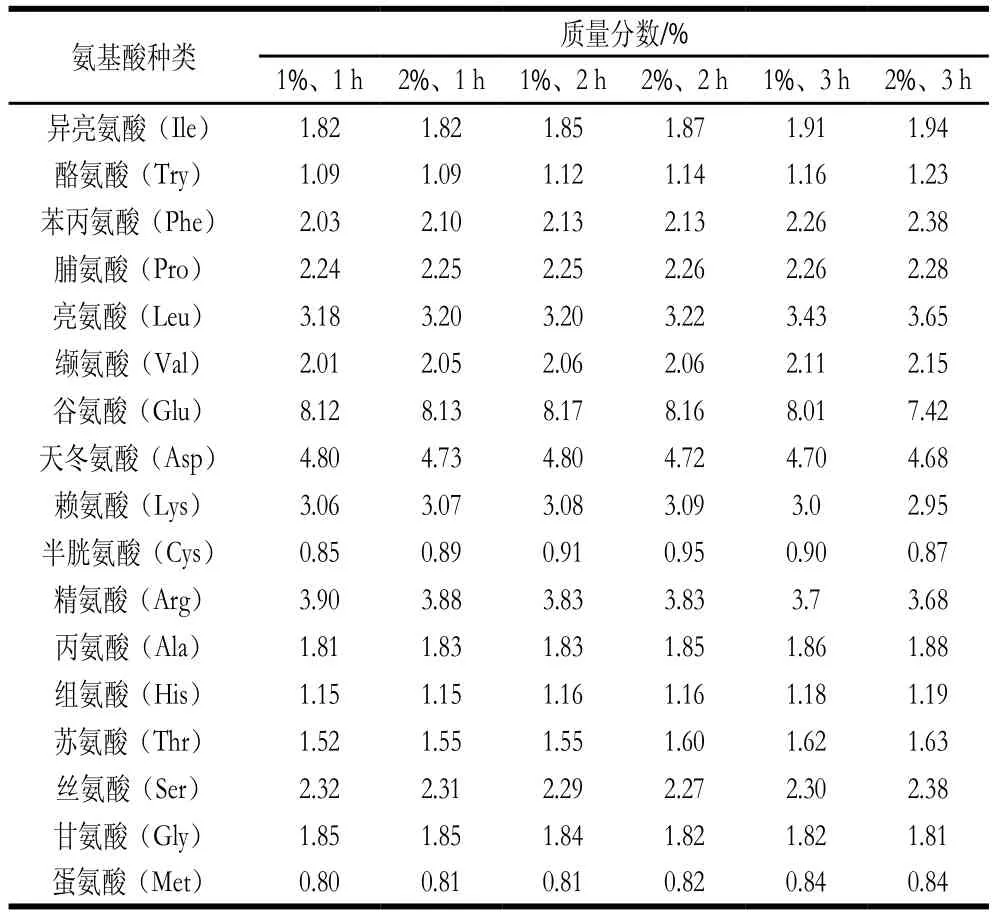
表 1 不同酶解条件下乳状液中蛋白质/多肽的氨基酸组成及含量Table 1 Amino acid composition of protein emulsions obtained under different enzymatic hydrolysis conditions
表面疏水性和疏水性氨基酸是2 个相关性指标。从表1可以看出,随着酶解程度的进行,乳状液蛋白质中Ile、Try、Phe、Leu、Val、Ala等比例增加,其中Ile、Leu、Phe、Val均为疏水氨基酸,这与Zheng Lin等[5]的研究一致。这是由于在酶解过程中,蛋白质的构象发生变化,使一些脂肪族和芳香族氨基酸侧链基团从蛋白质分子的内部结构暴露出来,酶解程度越深,这些芳香族氨基酸暴露的越多,而一些带有苯环的芳香族氨基酸大多是疏水性氨基酸(如Phe、Try、Trp),因此酶解导致疏水性氨基酸比例增加[25]。另外,Fischer等[26]研究表明酶解后由高比例的疏水性氨基酸引起的疏水性相互作用对肽聚集有很大贡献,酶解使蛋白质的肽链越来越短,其受到的空间阻碍越来越弱,这时肽链更容易通过疏水相互作用发生聚集,从而减少了与荧光探针相结合的疏水基团数量,S0呈下降趋势,且酶解程度越深,其疏水性指数降低的越明显,表面疏水性降低使其不容易吸附于油滴表面,导致乳状液失稳,这与上述S0结论一致。
2.5 傅里叶变换红外光谱分析
傅里叶变换红外光谱图可提供蛋白质酰胺I带、酰胺II带、酰胺III带信息以及蛋白质结构中的C—C振动和C=O等振动信息[27]。另外,傅里叶变换红外光谱中蛋白质酰胺I带(1 600~1 700 cm-1)频率的迁移与蛋白质二级结构紧密相关。根据已有研究,蛋白质二级结构与各子峰间的对应关系为:α-螺旋结构对应波数为1 646~1 664 cm-1;β-折叠结构对应波数为1 615~1 637 cm-1和1 682~1 700 cm-1;β-转角结构对应波数为1 664~1 681 cm-1;无规则卷曲结构对应波数为1 637~1 645 cm-1[28]。采用Peakfit软件对蛋白质红外光谱酰胺I带(1 600~1 700 cm-1)进行二阶导数红外去卷积光谱拟合,通过峰位归属确定二级结构种类和相对含量,计算结果见表2。
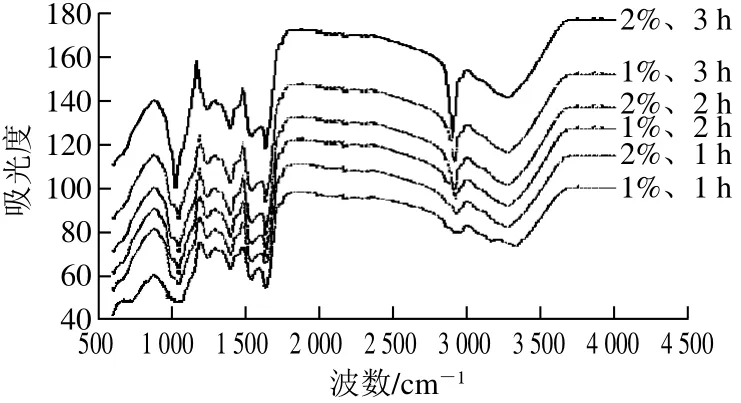
图4 不同酶解条件下乳状液中蛋白质红外光谱分析Fig. 4 FTIR spectra of protein emulsions prepared under different enzymatic hydrolysis conditions

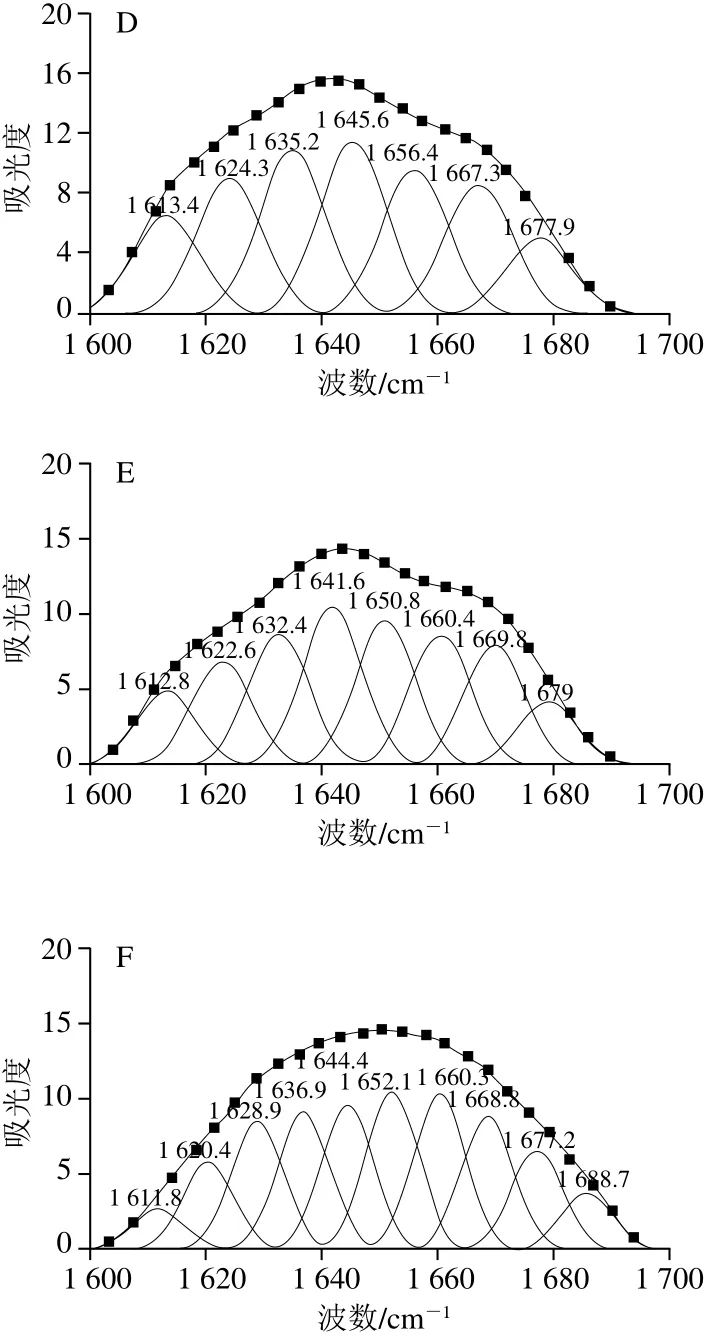
图5 不同酶解条件下乳状液中蛋白质酰胺I带的拟合图谱Fig. 5 Second-derivative FTIR spectra in the amide I region and Gaussian curve fitting for protein emulsions prepared under different enzymatic hydrolysis conditions
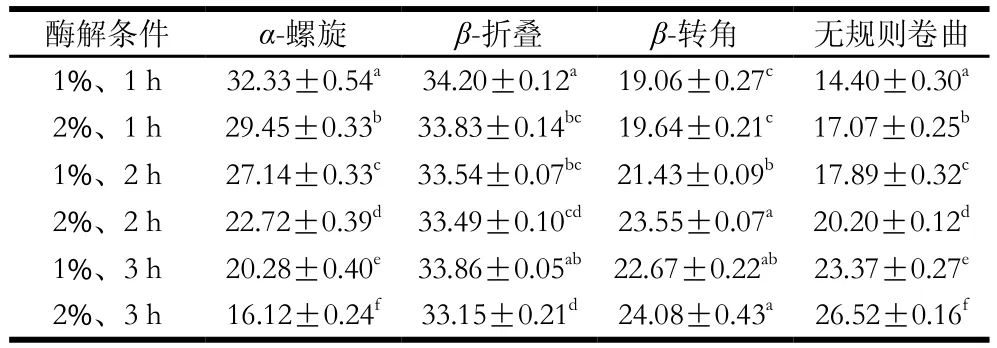
表2 不同酶解条件下乳状液中蛋白质的二级结构相对含量Table 2 Contents of the secondary structures of protein emulsions obtained under different enzymatic hydrolysis conditions%
由图4可以看出,随着酶解程度的加深,峰的强度及峰面积发生了变化。3 200~3 700 cm-1之间的吸收峰变强、面积增大,这主要由于酶解过程中肽键断裂引入H2O分子,导致—OH的伸缩振动和—NH的振动[29]。另外,由图5得出,酶解过程中只是峰的强度及峰面积发生了改变,乳状液蛋白质分子上的化学基团没有发生本质的变化,说明酶解改变了乳状液蛋白质构象所占的比例,导致二级结构发生不同程度的变化(表2)。随着酶解程度的加深,α-螺旋及β-折叠结构均呈现降低趋势,且转变为无规则卷曲结构,在蛋白质二级结构中,无规则卷曲与其他几种构象相比显然是一种更加松散的结构,无规则卷曲增加,说明蛋白质稳定乳液的能力降低。推测是由于酶解过程使得维持界面蛋白的内部结构力(包括氢键、范德华力、离子键等)逐渐被破坏,改变了乳状液蛋白质的空间构象,乳状液逐渐失去稳定性[30]。
3 结 论
本实验选用不同酶解时间(1、2、3 h)、酶添加量(1%、2%)条件下得到的生物解离大豆乳状液蛋白质,分析了不同酶解条件对乳状液蛋白质/多肽表面性质及结构特征的影响。
通过扫描电子显微镜结果显示:酶解刚开始由于DH较低,乳状液蛋白表现为致密有序的网状结构,酶解时间3 h时乳状液蛋白发生了明显变化,结构和质地开始疏松,并伴随微小孔洞出现。根据乳状液的结构分析,刚开始酶解时,油脂可以较好地填充在蛋白质的网络空间内,使乳状液结构更加稳定、均一;酶解时间3 h时的蛋白质越发失去了稳定乳状液的作用。
EAI和ESI分析表明,随着酶解的进行,EAI和ESI皆呈现逐渐降低趋势。主要由于随着酶解过程进行,吸附在油滴表面的蛋白被酶解成小分子质量的肽,导致其从油滴表面脱落,再重新与油滴吸附时,不能迅速吸附在油滴表面,这也是乳状液失稳的重要原因之一。
氨基酸组成及表面疏水性分析发现,随着酶解的进行,表面疏水性下降。由于酶解后的疏水性残基之间通过疏水相互作用发生聚集,形成可溶性或不可溶性的聚集体,对蛋白质的疏水区域产生屏蔽作用,导致表面疏水性下降;同时高比例疏水氨基酸引起的肽聚集,减少了与荧光探针相结合的疏水基团数量,导致表面疏水性降低。表面疏水性降低使其不容易吸附于油滴表面,使乳状液失稳。
通过拟合红外光谱酰胺I带发现,随着酶解程度的增加,α-螺旋、β-折叠结构呈现降低趋势,趋于更加松散的无规则卷曲结构增加,导致蛋白质稳定乳液的能力降低。
生物解离乳状液为半固体状,属于食品胶体,因此通过上述指标研究乳状液中蛋白质/肽稳定乳状液机制,发现酶解过程中乳状液蛋白EAI和ESI降低,部分蛋白质疏水性氨基酸残基比例增大,蛋白质二级结构α-螺旋、β-折叠结构转化为无规则卷曲。这是酶解过程中乳状液失稳主要原因之一。该结论为生物解离乳状液破乳机制提供理论支持。

