沙漠干热环境下创伤失血性休克猪模型血清炎症因子的变化特点
沈才福,刘江伟,夏亮,是文辉,董翔,安宗仁,段越
创伤失血性休克(traumatic hemorrhagic shock,THS)时由于机体血容量锐减,微循环灌注不足,伴随伤后剧烈疼痛、恐惧等各种因素,可引起代谢失调综合征,甚至危及生命[1-2]。创伤失血性休克死亡发生率高[3],有报道指出,伊拉克战争中87%的战场死亡发生于到达医院前,其中91%与失血性休克有关[4]。沙漠具有夏季气温高、昼夜温差大、干燥等气候特征。我国西北部地区分布着大面积的戈壁沙漠,总面积约为130万平方公里[1,5]。本课题组前期研究表明,沙漠干热环境下创伤失血性休克的损伤发生早且严重[1,5],而炎症反应则是参与损伤甚至是威胁生命的关键因素。沙漠干热环境下创伤失血性休克时血清炎症因子的变化特点目前国内外尚未见报道。本实验在西北特殊环境人工实验舱(新疆军区总医院研制)建立沙漠干热环境下创伤失血性休克模型,比较分析沙漠干热环境和常温环境下创伤失血性休克病程中肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)、IL-6、IL-10等炎症因子的变化特点。
1 材料与方法
1.1 分组及主要材料 9周龄本地雄性长白仔猪40只,体重25~35kg,由新疆天康畜牧生物技术股份有限公司提供。将实验动物随机分为常温假手术组(NS组)、常温创伤失血性休克组(NTHS组)、干热假手术组(DS组)、干热创伤失血性休克组(DTHS组),每组10只。TNF-α、IL-1β、IL-6、IL-10 ELISA试剂盒购自上海乔伊生物科技有限公司。环境模拟置于新疆军区总医院自主研制的“西北特殊环境人工实验舱”内。
1.2 模型建立 按以上分组将实验动物分别置于已提前设置相应环境(常温环境:温度25.0±0.5℃,湿度35%±5%;沙漠干热环境:温度40.5±0.5℃,湿度10%±2%)的实验舱内暴露3h。采用氯胺酮20mg/kg、阿托品0.05mg/kg肌内注射诱导麻醉,以1.5%~3.0%七氟烷混入50%的氧气中维持麻醉,连接心电监护,BL-420生物机能实验系统监测体温。麻醉满意后,分离暴露右侧颈外静脉,插入漂浮导管以监测血流动力学及取混合静脉血液样本,并于右侧股动脉插管监测动脉血压,左侧股动脉用于放血及血液样本的采集。中线开腹、膀胱造瘘。NTHS组和DTHS组行脾切除术及左下叶部分肝脏切除术、称重,并输入3倍脾重的乳酸林格液[6-7]。休克模型采用固定血压的中度创伤失血性休克模型[8],自髂外动脉快速放血致平均动脉压(MAP)为45±5mmHg,稳定20min后记录为休克0h,稳定期间可通过再放血或静脉输入乳酸林格液稳定目标血压。NS组和DS组按照上述方法完成监测后,行剖腹术及膀胱造瘘术后结束手术操作,未予创伤失血性休克处理,故无切脾切肝及输入乳酸林格液等步骤。NS组在NTHS组存活最长时间基础上延长约30min后处死,DS组在DTHS组存活最长时间的基础上延长约30min后处死。模型建立示意图见图1。
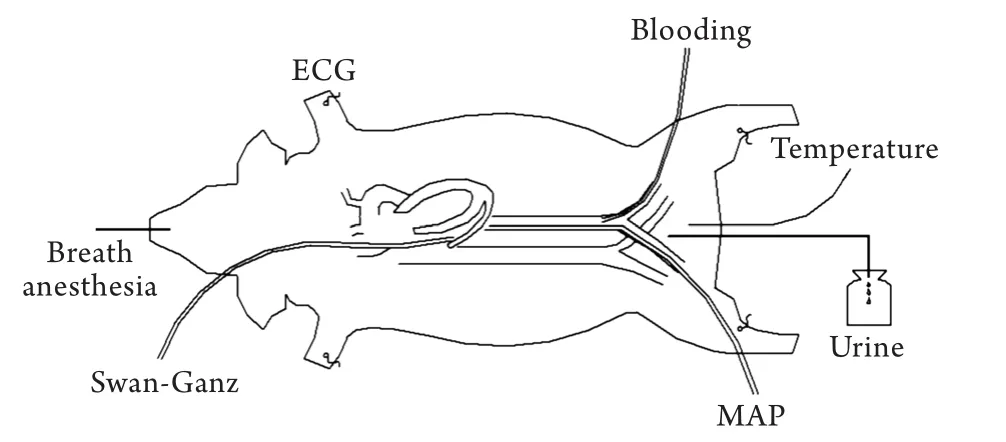
图1 创伤失血性休克猪模型示意图Fig.1 Schematic diagram of traumatic hemorrhagic shock porcine model
1.3 标本收集与处理 暴露前、暴露后、休克0h及休克后每30min采集静脉血液,直至动物自然死亡,静置30min,3000r/min离心10min后储存于–20℃冰箱中待测。
1.4 标本检测 分别将标本和不同浓度标准品(100μl/孔)加入相应孔中,用封板胶纸封住反应孔,室温(25~28℃)孵育120min;5次洗板后加入生物素化抗体工作液(100μl/孔)孵育60min;洗板5次后加入HRP酶结合物工作液(100μl/孔)孵育20min;再洗板后加入显色剂TMB(100μl/孔)避光孵育20min,加入终止液50μl/孔,混匀后于酶标仪测量波长450nm处所有孔板的光密度(A)值,计算TNF-α、IL-1β、IL-6、IL-10水平。
1.5 统计学处理 采用SPSS 21.0软件进行统计分析。计量资料以表示,组间比较采用重复测量方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
在实验过程中,所有实验动物均未发生手术或麻醉意外。DTHS组实验动物的生存时间为3h左右,NTHS组的生存时间长达10.5h[5]。故本研究中干热环境组留取了暴露后及休克后0、1、2、3h共5个时间点的标本,而常温环境组增加休克后8h(TNF-α为6h)及10h两个时间点。
2.1 血清TNF-α水平变化 NS组血清TNF-α水平呈逐渐上升趋势,但各时间点间比较差异无统计学意义。NTHS组休克后血清TNF-α水平逐渐上升,至6h达峰值并明显高于NS组(P<0.05),此后逐渐下降。DS组各时间点血清TNF-α水平均明显高于NS组,差异有统计学意义(P<0.05)。DTHS组血清TNF-α水平自休克后迅速上升,在休克后1h左右达峰值,且明显高于NTHS组及DS组,差异有统计学意义(P<0.05),随后逐渐下降(表1)。
2.2 血清IL-1β水平变化 NS组血清IL-1β水平各时间点间比较差异无统计学意义。NTHS组血清IL-1β水平随时间延长逐渐上升,且从休克后1h起即明显高于NS组,差异有统计学意义(P<0.05),并于8h左右达峰值。干热环境暴露后DS组和DTHS组血清IL-1β水平高于常温暴露的NS组和NTHS组,但差异无统计学意义(P>0.05)。观察期间DS组血清IL-1β水平始终呈增长趋势,DTHS组休克后血清IL-1β水平快速升高,于休克后1h即明显高于NTHS组和DS组(P<0.05),休克后2h达峰值,休克后3h明显降低,与NTHS组和DS组比较差异已无统计学意义(P>0.05,表2)。
表1 各组血清TNF-α水平 (pg/mg,,n=10)Tab.1 Serum levels of TNF-α in each group (pg/mg, , n=10)
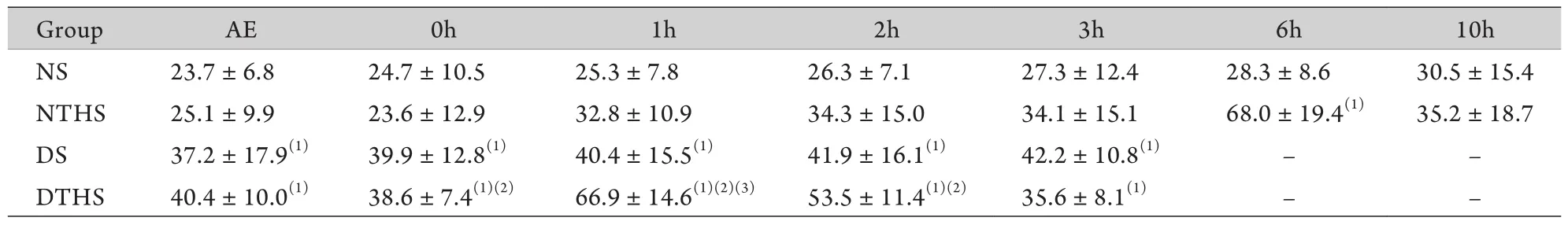
表1 各组血清TNF-α水平 (pg/mg,,n=10)Tab.1 Serum levels of TNF-α in each group (pg/mg, , n=10)
AE.After exposure; NS.Normal temperature sham group; NTHS.Normal temperature traumatic hemorrhagic shock group; DS.Dry-heat sham group; DTHS.Dry-heat traumatic hemorrhagic shock group.(1)P<0.05 compared with NS group; (2)P<0.05 compare with NTHS group; (3)P<0.05 compare with DS group
Group AE 0h 1h 2h 3h 6h 10h NS 23.7±6.8 24.7±10.5 25.3±7.8 26.3±7.1 27.3±12.4 28.3±8.6 30.5±15.4 NTHS 25.1±9.9 23.6±12.9 32.8±10.9 34.3±15.0 34.1±15.1 68.0±19.4(1) 35.2±18.7 DS 37.2±17.9(1) 39.9±12.8(1) 40.4±15.5(1) 41.9±16.1(1) 42.2±10.8(1) – –DTHS 40.4±10.0(1) 38.6±7.4(1)(2) 66.9±14.6(1)(2)(3) 53.5±11.4(1)(2) 35.6±8.1(1) – –
2.3 血清IL-6水平变化 NS组休克后血清IL-6水平呈逐渐上升趋势,至休克后3h即明显高于暴露后,差异有统计学意义(P<0.05)。NTHS组休克后血清IL-6水平始终呈较快升高趋势。干热环境暴露后DS组和DTHS组血清IL-6水平明显高于常温暴露的NS组和NTHS组,差异有统计学意义(P<0.05)。DTHS组休克后血清IL-6水平逐渐升高,且在各时间点均明显高于NTHS组(P<0.05),但从休克后2h起才高于DS组(P<0.05,表3)。
表2 各组血清IL-1β水平 (pg/mg,,n=10)Tab.2 Serum levels of IL-1β in each group (pg/mg, , n=10)
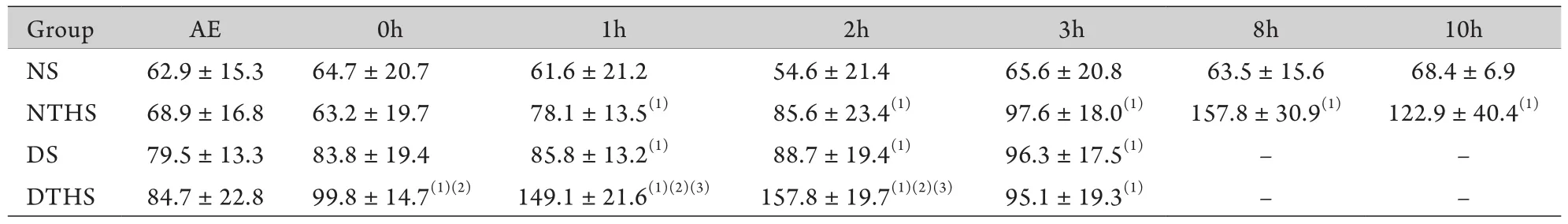
表2 各组血清IL-1β水平 (pg/mg,,n=10)Tab.2 Serum levels of IL-1β in each group (pg/mg, , n=10)
AE.After exposure; NS.Normal temperature sham group; NTHS.Normal temperature traumatic hemorrhagic shock group; DS.Dry-heat sham group; DTHS.Dry-heat traumatic hemorrhagic shock group.(1)P<0.05 compared with NS group; (2)P<0.05 compare with NTHS group; (3)P<0.05 compare with DS group
Group AE 0h 1h 2h 3h 8h 10h NS 62.9±15.3 64.7±20.7 61.6±21.2 54.6±21.4 65.6±20.8 63.5±15.6 68.4±6.9 NTHS 68.9±16.8 63.2±19.7 78.1±13.5(1) 85.6±23.4(1) 97.6±18.0(1) 157.8±30.9(1) 122.9±40.4(1)DS 79.5±13.3 83.8±19.4 85.8±13.2(1) 88.7±19.4(1) 96.3±17.5(1) – –DTHS 84.7±22.8 99.8±14.7(1)(2) 149.1±21.6(1)(2)(3) 157.8±19.7(1)(2)(3) 95.1±19.3(1) – –
2.4 血清IL-10水平变化 NS组及NTHS组休克后血清IL-10水平逐渐升高,休克后8、10h明显高于暴露后,差异有统计学意义(P<0.05)。NTHS组休克后血清IL-10水平增长较快,自2h起及明显高于NS组,差异有统计学意义(P<0.05)。干热环境暴露后DS组和DTHS组血清IL-10水平明显高于常温暴露的NS组和NTHS组,差异有统计学意义(P<0.05)。DS组和DTHS组休克后血清IL-10水平均逐渐上升,但DTHS组上升速度更快,休克后1h即达峰值,且在1、2、3h时间点均明显高于DS组,差异有统计学意义(P<0.05,表4)。
表3 各组血清IL-6水平比较(pg/mg,,n=10)Tab.3 Serum levels of IL-6 in swine (pg/mg, , n=10)

表3 各组血清IL-6水平比较(pg/mg,,n=10)Tab.3 Serum levels of IL-6 in swine (pg/mg, , n=10)
AE.After exposure; NS.Normal temperature sham group; NTHS.Normal temperature traumatic hemorrhagic shock group; DS.Dry-heat sham group; DTHS.Dry-heat traumatic hemorrhagic shock group.(1)P<0.05 compare with AE; (2)P<0.05 compared with NS group; (3)P<0.05 compare with NTHS group; (4)P<0.05 compare with DS group
Group AE 0h 1h 2h 3h 8h 10h NS 34.5±14.5 38.7±10.5 41.3±15.9 42.4±13.9 50.6±14.7(1) 114.8±19.1(1) 152.9±24.3(1)NTHS 38.1±18.2 42.8±16.9 54.0±17.3 59.6±24.8 95.9±21.8(2) 505.4±34.7(2) 826.4±28.0(2)DS 90.6±20.5(2)(3) 110.1±20.0(2)(3) 114.4±27.5(2)(3) 124.8±19.4(2)(3) 139.4±23.8(2)(3) – –DTHS 91.7±18.5(2)(3) 101.4±19.4(2)(3) 121.4±19.2(2)(3) 186.4±27.9(2)(3)(4) 354.8±27.1(2)(3)(4) – –
表4 各组血清IL-10水平比较(pg/mg,,n=10)Tab.4 Serum levels of IL-10 in swine (pg/mg, , n=10)

表4 各组血清IL-10水平比较(pg/mg,,n=10)Tab.4 Serum levels of IL-10 in swine (pg/mg, , n=10)
AE.After exposure; NS.Normal temperature sham group; NTHS.Normal temperature traumatic hemorrhagic shock group; DS.Dry-heat sham group; DTHS.Dry-heat traumatic hemorrhagic shock group.(1)P<0.05 compare with AE; (2)P<0.05 compared with NS group; (3)P<0.05 compare with NTHS group; (4)P<0.05 compare with DS group
Group AE 0h 1h 2h 3h 8h 10h NS 35.7±13.3 33.8±15.6 35.6±16.3 40.8±16.0 45.7±22.9 70.0±21.3(1) 75.8±15.1(1)NTHS 34.8±12.0 26.4±11.2 47.7±25.5 69.9±23.2(2) 114.2±25.2(2) 205.8±22.7(1)(2)242.8±21.1(1)(2)DS 56.5±25.3(2)(3) 60.0±27.8 68.7±27.8 83.6±10.8 86.9±14.6 – –DTHS 54.5±23.9(2)(3) 43.3±24.9 190.5±28.3(2)(3)(4) 126.8±19.7(2)(3)(4) 77.2±10.6(3)(4) – –
3 讨 论
热应激、创伤、失血性休克均可通过直接或者间接作用损伤机体,导致多脏器功能损伤。炎症是多种疾病的共同通路,受多种应激因素的影响,多种细胞分子参与了炎症反应的应答过程,在细胞水平包括中性粒细胞、B淋巴细胞、T淋巴细胞等[9-10],在分子水平包括丝裂原活化蛋白酶(MAPs)、细胞黏附分子(CAMs)[11]等。促炎介质IL-1β、IL-6、TNF-α为常用的评价炎症反应的指标,其中TNF-α是最早且最关键的炎症介质[10]。本研究中NTHS组血清TNF-α水平在休克后6h达峰值,而DTHS组在休克后1h即达峰值,且热暴露后血清TNF-α水平高于常温组,提示热应激与THS的复合作用,提前启动了炎症因子的释放并提高了其释放浓度。TNF-α对启动炎症反应起着决定性的作用[12-13],因此在TNF-α释放后,一般会相继出现大量IL-1β、IL-6等炎症级联反应的关键介质[10]。本研究中NTHS组在TNF-α大量释放后,相继出现IL-1β、IL-6的大量释放,与其他研究结果一致[6,12]。但由于干热应激与THS的双重打击,DTHS组的血清IL-1β、IL-6水平升高紧随TNF-α水平升高之后,提示与常温环境下的THS相比,其炎症“瀑布式爆发”的时间更早、病情发展更快、预后更差。
促炎因子释放的同时也会刺激抑炎因子(如IL-10)的释放,以抵抗多种促炎因子对脏器的损伤,在机体免疫平衡中具有重要作用[12]。本研究中由于干热的环境刺激,DS组和DTHS组暴露后血清IL-10水平均明显高于NS组和NTHS组,考虑是由于热环境刺激引起的免疫应答所致,也可能正是由于这种免疫应答机制在干热环境暴露时提前激活,导致DTHS组血清IL-10水平在休克后1h左右就迅速达到峰值,而NTHS组从休克0h开始逐渐升高,至休克后8h才达峰值。
创伤失血性休克可刺激机体释放大量的炎症介质,使机体发生全身炎症反应综合征,最终引起多器官功能障碍综合征(multiple organ dysfunctionsyndrome,MODS)[14]。在本研究中,沙漠干热环境的打击作用使THS猪过早、过量地释放TNF-α、IL-1β、IL-6、IL-10等炎症因子,从而使其比常温环境下THS猪的炎症瀑布样连锁放大反应发生时间更早,对脏器损伤更严重,病情发展更快,预后更差。
本研究成功建立了沙漠干热环境THS猪模型,与本课题组前期建立的沙漠干热环境THS大鼠[1]相比,猪具有与人类相似的心血管反应[15],体积更大,易于操作,标本量易收集,建模成功率更高。但猪的脾脏较大(约为人类的3倍)[8,15],存储的血液较多,在失血性休克时更易发生自体输血,所以许多研究者在建模时会切除猪的脾脏并输入3倍体积的乳酸林格液[16-17]来平衡体液的丢失。乳酸林格液是与人类组织液离子浓度相似的等张液,大量输注后对炎症因子、凝血因子等具有稀释作用。常温和干热环境下的THS组暴露后到休克后1h血清TNF-α、IL-10水平均有所下降,推测主要与乳酸林格液的稀释作用有关;失血性休克后组织液的自体回输可能是导致休克后炎症因子浓度降低的另一个原因。因此THS猪早期血清炎症因子浓度不高或者降低可能是稀释性的,并不能准确反映机体的炎症反应状态,因此在综合分析炎症因子变化趋势时应予以考虑。
虽然对沙漠干热环境THS的发展过程、病理生理机制尚未完全清晰,但本研究结果提示沙漠干热环境的应激作用和THS的双重打击在全身炎症反应及其病理生理发展过程中扮演着重要角色,其具体作用机制尚需进一步深入研究。

