干旱胁迫下拟南芥磷脂酶Dδ与一氧化氮在种子萌发中的信号关系
张旭强 赵 敏 陈 璐 安炎黄 杨鹏军 王新霞 杨 宁
(西北师范大学生命科学学院,兰州 730070)
植物的生长会受到环境非生物因素的极大影响,如干旱、高盐、低温等。植物要响应并适应这些胁迫条件从而在逆境中生存,在这些非生物胁迫中,干旱是限制植物生长和作物产量最严重的环境因子[1]。目前由于全球气候变化致使气温不断升高,加之中国水资源的分布不均衡,限制了作物的区域分布及生存,作物生长及产量等问题越来越受到社会各界专家学者的广泛关注。因此,阐明植物适应和耐受干旱的生理和分子机理对提高农作物的抗旱性、降低干旱对农作物产量和品质的影响具有十分重要的意义。
植物遭受胁迫最重要的表现之一是细胞膜受到破坏,磷脂和糖脂等类脂构成的双分子层是细胞膜的基本骨架成分,其中磷脂对维持细胞结构稳定具有重要作用,其代谢产物调控许多重要的生理过程及细胞反应。磷脂酶是催化磷脂降解的关键酶,其中PLD是植物组织中普遍存在的一类水解酶,它催化水解磷脂末端的磷酸二酯键,其水解产物为PA和亲水性的胆碱等,例如:肌醇三磷酸(IP3)、乙酰胆碱等,它们在维持细胞膜稳定性及调节各种细胞信号传导功能过程中起着至关重要的作用。PLD是一个多基因家族的酶,迄今包括水稻、杨树和拟南芥在内的至少8种植物的15种PLD已经得到克隆[2]。姚腾[3]发现水稻的多数PLDs包括PLDα1、PLDα3、PLDδ2、PLDζ1、PLDζ2、PLDφ及PLDβ2均能被盐胁迫所诱导,暗示水稻PLDs参与盐胁迫响应。王海燕[4]在杨树中的研究结果表明,PLDα1和PLDδ3通过渗透调节机制、膜稳定性机制以及其他的一些抗旱机制增强了84K杨树的抗旱能力。己经发现拟南芥存在12种不同的PLD基因,共分成6类:PLDα(3),β(2),γ(3),δ,ε,ζ(2),它们具有不同的生化、调节和结构特征[5~6]。近年来越来越多的研究将重点放在了PLD信号转导功能上,PLD及PA参与包括种子萌发、根毛生长、气孔运动、叶片衰老和果实成熟等植物的各个阶段的生长发育过程[7~9],越来越多的证据表明PLD和PA参与渗透胁迫[10~11]、低温胁迫[12]和氧化胁迫[13]等多种非生物胁迫。NO是一种极其简单的脂溶性气体小分子物质,容易透过细胞膜进行扩散,扩散进入细胞后在生物体内发挥重要的功能[14]。在植物中,NO主要有NOS、NR、其它酶促反应和非酶促等4种产生途径。大量实验证据表明NO是一种多功能的信号分子,在植物非生物胁迫的反应中也起着关键的作用[15~16]。NO也参与了植物的种子的萌发,叶片衰老和开花生理等生长发育过程[17~19]。
PLDα1和PLDδ是拟南芥中含量最丰富的PLD,是内源PA的主要来源之一[20~21]。目前,关于PLDα1在逆境下的研究较多,徐霁[22]的研究表明,PLDα1/PA可以诱导盐胁迫下叶肉细胞原生质体中NO的产生,而对干旱胁迫下PLDδ/PA和NO信号转导关系的研究则未见报道。因此我们选择pldδ,noa1,nia1和nia2四种缺失型突变体和WT幼苗为材料,来研究PLDδ与NO在拟南芥耐旱性中的关系,旨在为PLD和NO在种子萌发中的关系研究及它们参与植物的抗旱机制提供部分理论依据。
1 材料与方法
1.1 材料培养
拟南芥种子分别为WT、pldδ(SALK_092469c)、noa1(CS6511)、nia1(CS6936)和nia2(CS2355)。其中WT和pldδ种子由本实验室课题组提供,其余T-DNA插入突变体种子均购自美国俄亥俄州立大学拟南芥生物资源中心(ABRC)。
将拟南芥种子置于4℃冰箱中春化3 d,消毒后接种于MS培养基,在温度22℃,光照2 000 lux,光周期为16/8 h的培养箱中培养。
1.2 突变体鉴定
1.2.1 DNA提取
称取拟南芥新鲜叶片0.2 g,按照EasyPure® Plant Genomic DNA Kit提取DNA。
1.2.2 引物设计
通过http://signal.salk.edu/tdnaprimers.html网站查得,插入T-DNA片段的特异性通用引物序列LBa1:TGGTTCACGTAGTGGGCCATCG。
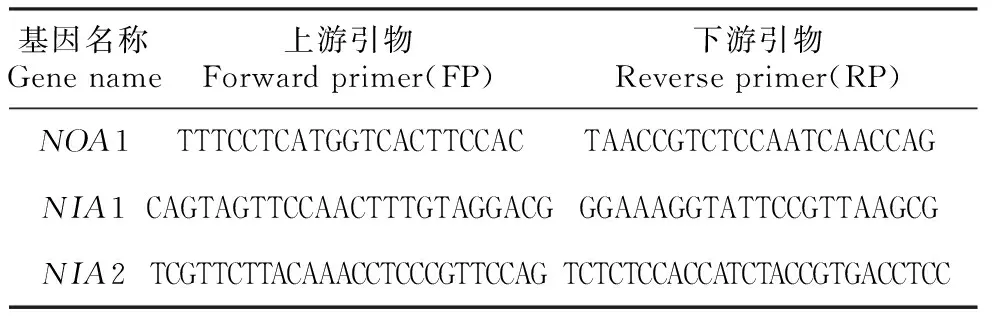
表1 引物序列Table 1 Primer sequences

表2 PCR体系Table 2 PCR system
1.2.3 PCR体系
PCR循环条件:Cycle1(1×):94℃ 10 min;Cycle2(35×):94℃ 30 s,退火30 s,72℃ 30 s;Cycle3(1×):72℃ 10 min,以WT为对照进行PCR反应。
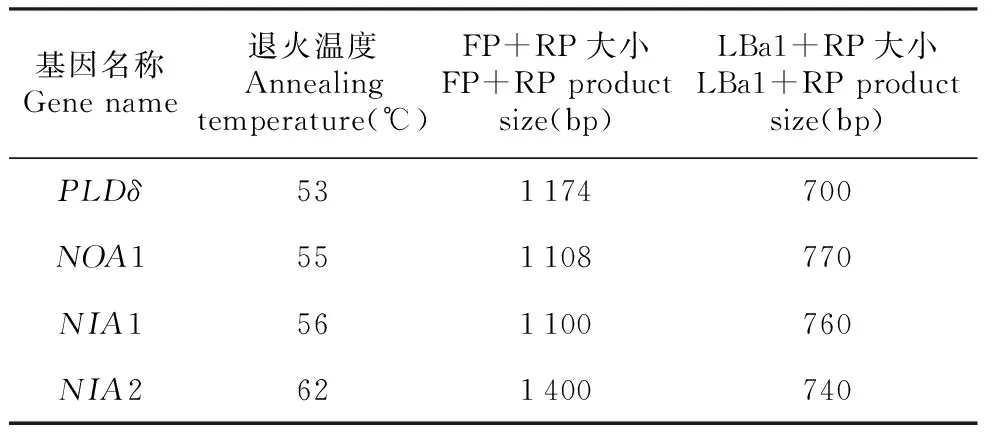
表3 退火温度及产物大小Table 3 Annealing temperature and product size
1.3 材料处理
经前期实验筛选,选择100 μmol·L-1SNP作为外源NO供体浓度,选择80 μmol·L-1PA作为外源PA供给浓度。以0.3 mol·L-1甘露醇模拟干旱胁迫,以WT和经“三引物法”鉴定出的pldδ-2,noa1-3,nia1-2和nia2-5四个拟南芥纯合突变体株系的T1代种子为材料,取生长15 d、长势一致的幼苗进行胁迫处理,处理时间为6、12、24、48和72 h,每个处理设置3个平行。
1.4 RNA提取和RT-qPCR检测
1.4.1 总RNA提取
使用TaKaRa公司的Trizol试剂盒进行总RNA提取,提取出的RNA用PrimerScriptTMRT reagent Kit With gCDNA Eraser(Perfect Real Time)反转录试剂盒反转录成cDNA。
1.4.2 RT-qPCR反应体系
RT-qPCR反应程序为:Cycle 1(1×):95℃ 10 min;Cycle 2(40×):95℃ 15 s,60℃ 30 s;Cycle3(81×):72℃ 30 s。
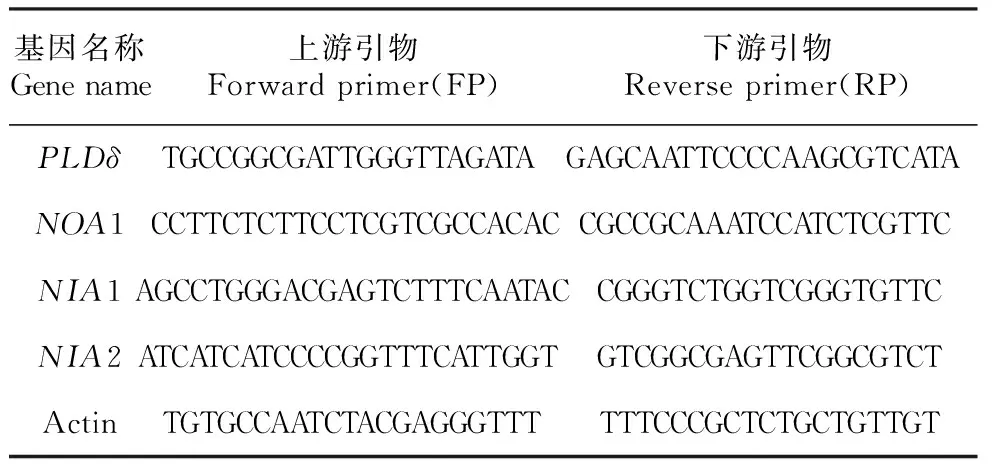
表4 引物序列Table 4 Primer sequences

表5 RT-qPCR反应体系Table 5 RT-qPCR reaction system
1.5 PLD,NOS,NR活性及NO含量测定
PLD活性由上海酶联生物公司的试剂盒测定,NOS,NR活性及NO含量由南京建成生物公司提供的试剂盒测定,详细操作见说明书。
1.6 种子萌发率测定
每个处理设3个重复,每个重复有50颗种子,从开始光照培养时起,以露白作为萌发标准每日统计萌发的种子数目,以萌发数目不再增加为止。
1.7 数据处理
所有试验3次独立重复,数据采用SPSS17.0软件进行单因素方差分析(one-way ANOVA),采用最小显著差异法(Duncan)分析不同数据组间的差异性,显著性水平设置为α=0.05。作图使用Origin9.0软件完成。
2 结果与分析
2.1 noa1,nia1和nia2纯合突变体鉴定
通过“三引物法”鉴定筛选T-DNA插入纯合突变体(图1),WT基因特异性引物(FP+RP)均可以扩增出对应的目的条带,noa1-3,nia1-2和nia2-5三个突变体株系用基因特异性引物(FP+RP)无法扩增出条带,而用T-DNA特异性引物LBa1和RP可以扩增出目的条带,说明三种突变体株系均为T-DNA插入纯合突变体,以纯合株系的T1代种子为材料进行后续实验。
2.2 干旱胁迫对PLD活性和NO含量的影响
不同浓度甘露醇均导致PLD活性发生显著变化(图2),其中PLD活性在0.3 mol·L-1甘露醇处理下除24 h低于其他浓度外,其他胁迫时间PLD活性均显著高于其他浓度的甘露醇处理,并随胁迫时间表现为前期降低,后期升高的变化趋势,因此后续的实验采用0.3 mol·L-1甘露醇来模拟干旱胁迫。干旱胁迫使得WT幼苗NO含量增加(图3),表现为随胁迫处理时间逐渐上升的趋势,并在72 h达到最大。

图1 noa1,nia1和nia2纯合突变体的筛选 A~C分别表示noa1-3,nia1-2和nia2-5纯合突变体鉴定结果;1.WT(FP+RP);2.突变体(FP+RP);3.突变体(LB+RP)Fig.1 Identification of noa1,nia1 and nia2 homozygous mutants A-C show the results of identification of noa1-3,nia1-2 and nia2-5 homozygous mutants; 1.WT(FP+RP); 2.Mutants(FP+RP); 3.Mutants(LB+RP)
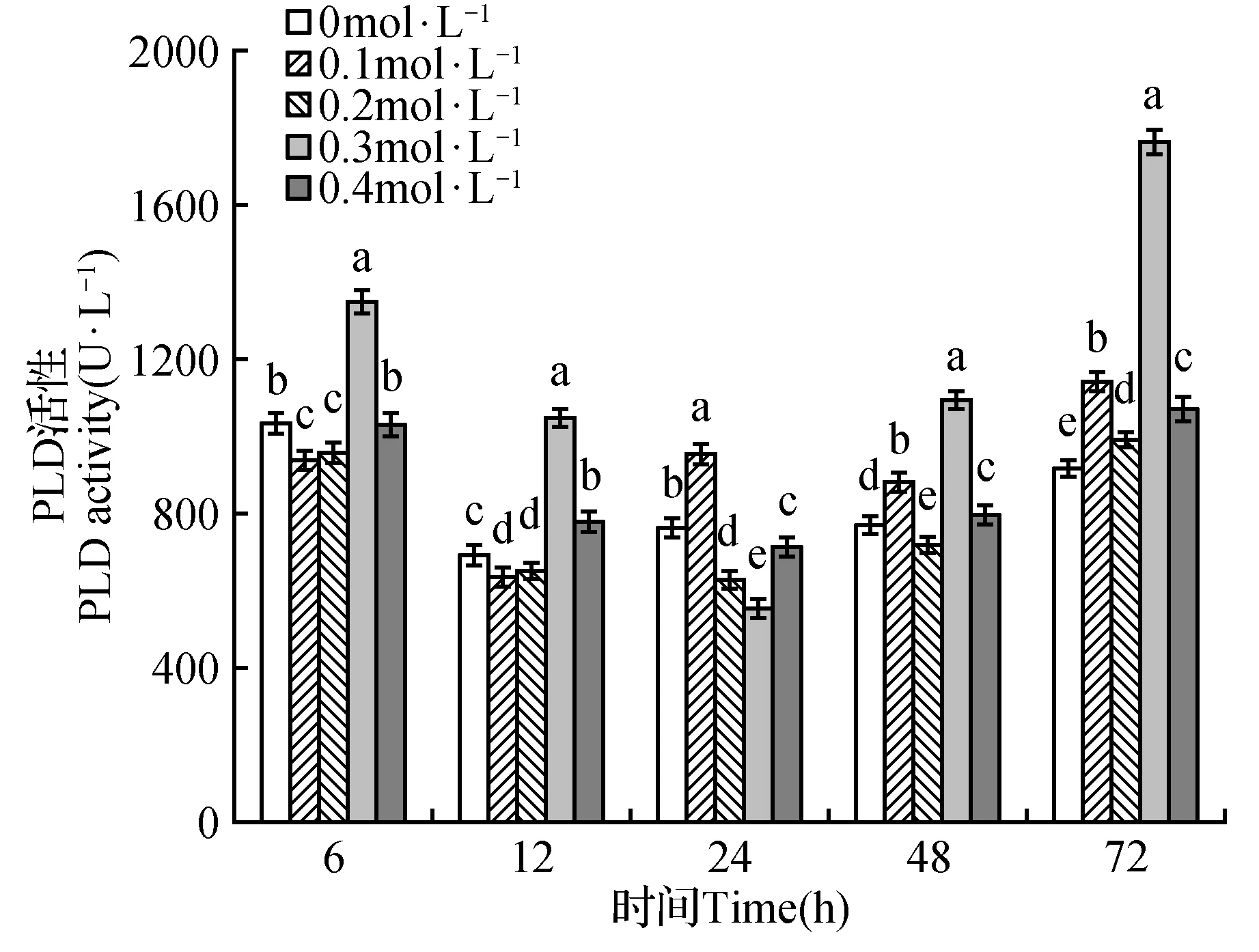
图2 干旱胁迫对PLD活性的影响 小写字母表示同一时间不同处理组在P≤0.05时的显著性差异,下同。Fig.2 Effects of PLD activity on drought stress Lowercase letters in the figure indicate the significant differences among the different treatment groups at the same time P≤0.05, the same as below.

图3 干旱胁迫对NO含量的影响 大写字母表示不同时间相同处理组在P≤0.05时的显著性差异,下同。Fig.3 Effects of NO content on drought stress Capital letters indicate significant differences among the same treatment groups at different times P≤0.05,the same as below.
2.3 干旱胁迫对NOS和NR活性的影响
干旱胁迫下WT幼苗NOS活性除24 h降低外,其他时间段均较对照组显著升高(图4A),在胁迫后期达到最大且趋于稳定。干旱导致NR活性显著升高(图4B),并随胁迫时间整体表现为上升趋势,在72 h时NR活性达到最大,其中NR活性相较于NOS活性变化更为显著。
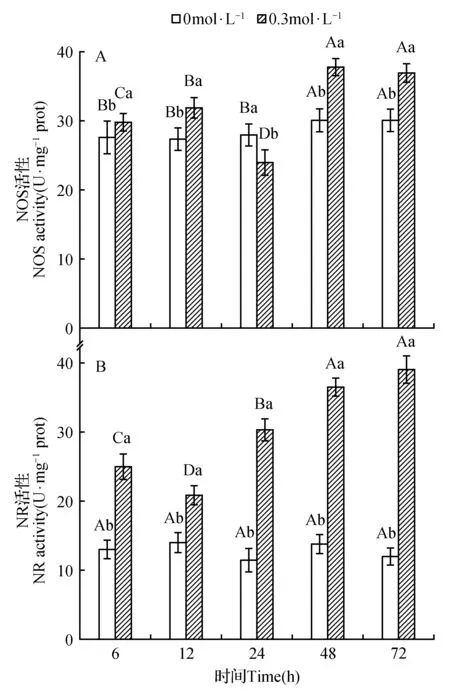
图4 干旱胁迫对NOS和NR活性的影响Fig.4 Effects of NOS and NR activity on drought stress
2.4 干旱胁迫下NOS和NR缺失对NO含量的影响
为了研究干旱胁迫下NO的主要产生途径,我们检测了noa1,nia1和nia2幼苗NO含量(图5),无论干旱还是未干旱处理noa1,nia1和nia2均显著低于WT幼苗NO含量,其中以nia2幼苗NO含量最低,表明干旱胁迫下内源NO生成过程中NR2相较于NR1和NOS可能发挥更为重要的作用。

图5 干旱胁迫对noa1,nia1和nia2幼苗NO含量的影响Fig.5 Effects of noa1,nia1 and nia2 seedling NO concent on drought stress
2.5 干旱胁迫对PLDδ、NOA1、NIA1和NIA2基因相对表达量的影响
为了研究干旱胁迫下PLD,NOS和NR活性变化的原因,我们检测了PLDδ,NOA1,NIA1和NIA2的基因表达量的变化情况。PLDδ基因相对表达量(图6A)除12 h降低外其他处理时间均显著增加,并表现为胁迫前期迅速降低后期有所升高的变化趋势,与PLD活性在0.3 mol·L-1甘露醇胁迫下的变化趋势相似(图2)。NOA1相对表达量(图6B)在胁迫前期迅速升高,胁迫后期下降。干旱胁迫下NIA1和NIA2(图6:C~D)基因相对表达量升高,并均表现为随胁迫时间的延长而持续升高的变化趋势,其中NIA2基因表达量变化更为显著。
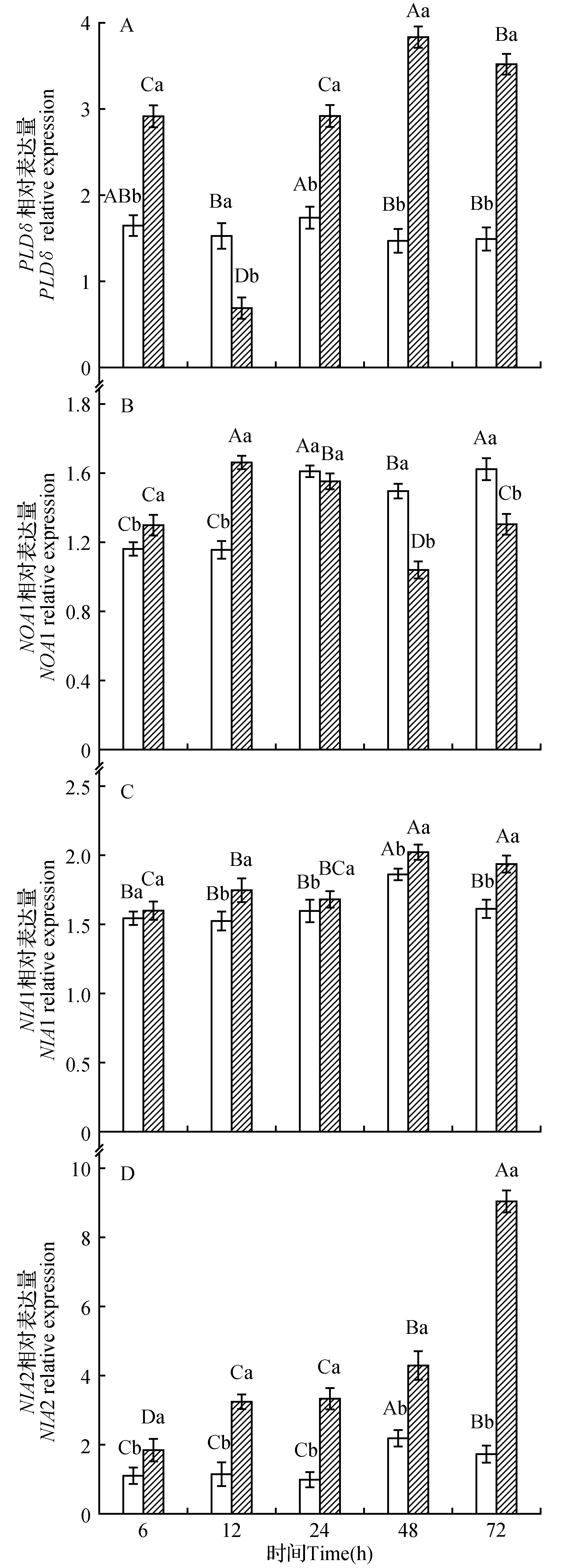
图6 干旱胁迫对PLDδ,NOA1,NIA1和NIA2基因相对表达量的影响Fig.6 Relative expression of PLDδ,NOA1,NIA1 and NIA2 on drought stress
2.6 干旱胁迫对pldδ和nia2种子萌发的影响
由于NR活性及NIA2基因相对表达量在干旱胁迫下上升更加明显,所以我们选择了pldδ和nia2两种突变体来研究PLDδ和NO在种子萌发中的关系。图7A为干旱处理10 d的种子萌发情况,干旱胁迫抑制了pldδ和nia2的种子萌发,处理3 d即与WT有显著差异,随后萌发数缓慢增加,但差异一直存在,最终pldδ和nia2的种子萌发率低于WT,且nia2的种子萌发抑制较pldδ更为明显。100 μmol·L-1SNP可以促进干旱胁迫下WT,pldδ和nia2的种子萌发,且SNP对nia2的促进效果更为显著(图7B);80 μmol·L-1PA可以显著促进干旱胁迫下WT和pldδ的种子萌发,但不能促进nia2的种子萌发。干旱胁迫下外源补充的NO和PA并不能使pldδ和nia2的萌发率恢复到WT的水平。图8为萌发20 d后WT,pldδ和nia2幼苗的生长状况,未干旱处理的对照组(CK)中pldδ,nia2与WT在叶片颜色,大小以及植株大小上均无明显差异,而干旱胁迫对pldδ和nia2幼苗的影响比WT幼苗更加明显,pldδ和nia2幼苗较WT均表现为生长缓慢,种子萌发率和成活率显著降低。外施PA显著促进了干旱胁迫下WT和pldδ的种子萌发率和成活率,但PA对nia2无明显促进作用,外施SNP均显著促进WT、pldδ和nia2的种子萌发率和成活率。
2.7 干旱胁迫下外源SNP和PA处理对内源NO含量的影响
为了研究干旱胁迫下pldδ和nia2的萌发抑制是否与内源NO含量变化有关,我们检测了干旱胁迫下外源SNP和PA对nia2和pldδ中NO产生的影响作为补偿实验。正常和干旱胁迫下pldδ和nia2的内源NO含量均显著低于WT(图9)。SNP均可促进干旱胁迫下pldδ和nia2中NO产生,而PA可以促进干旱胁迫下pldδ中NO的含量,但不能促进nia2中NO的产生。
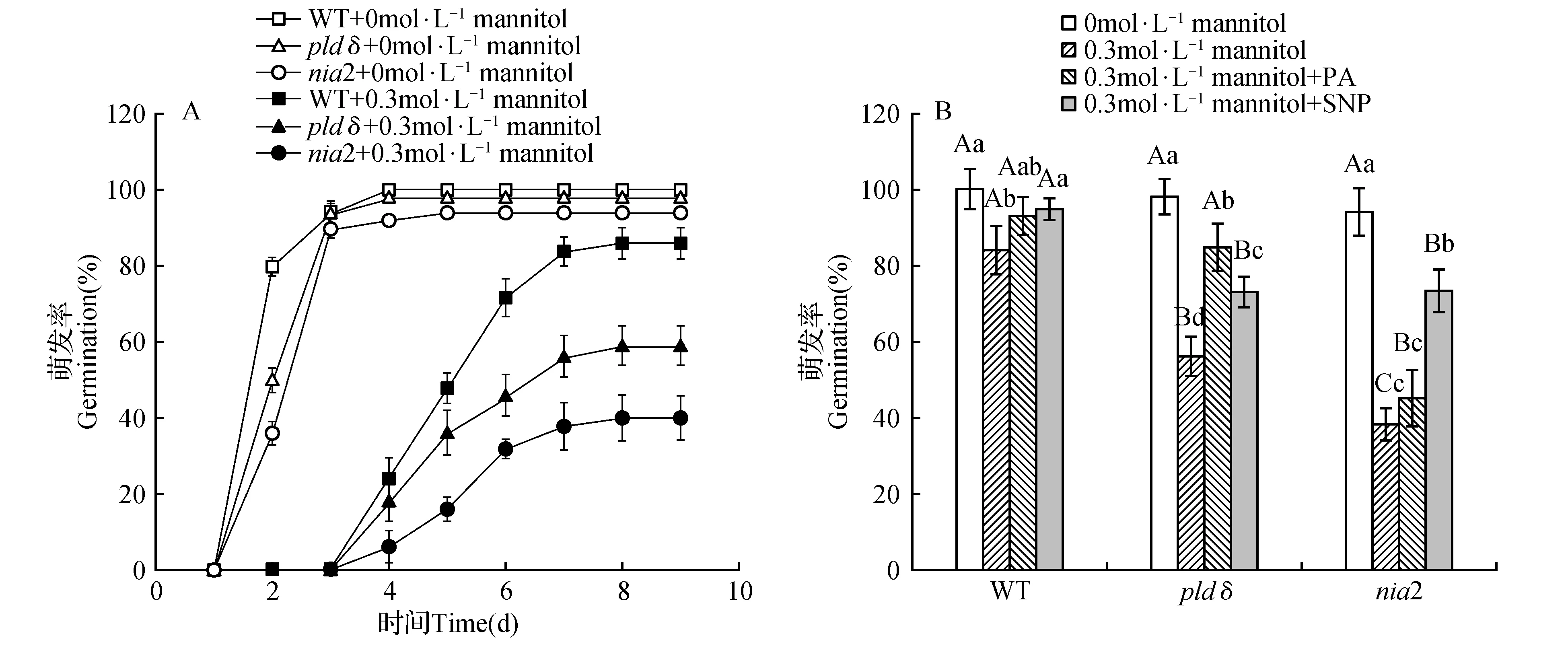
图7 干旱胁迫对pldδ和nia2种子萌发的影响Fig.7 Effect of drought stress on germination of pldδ and nia2 seeds
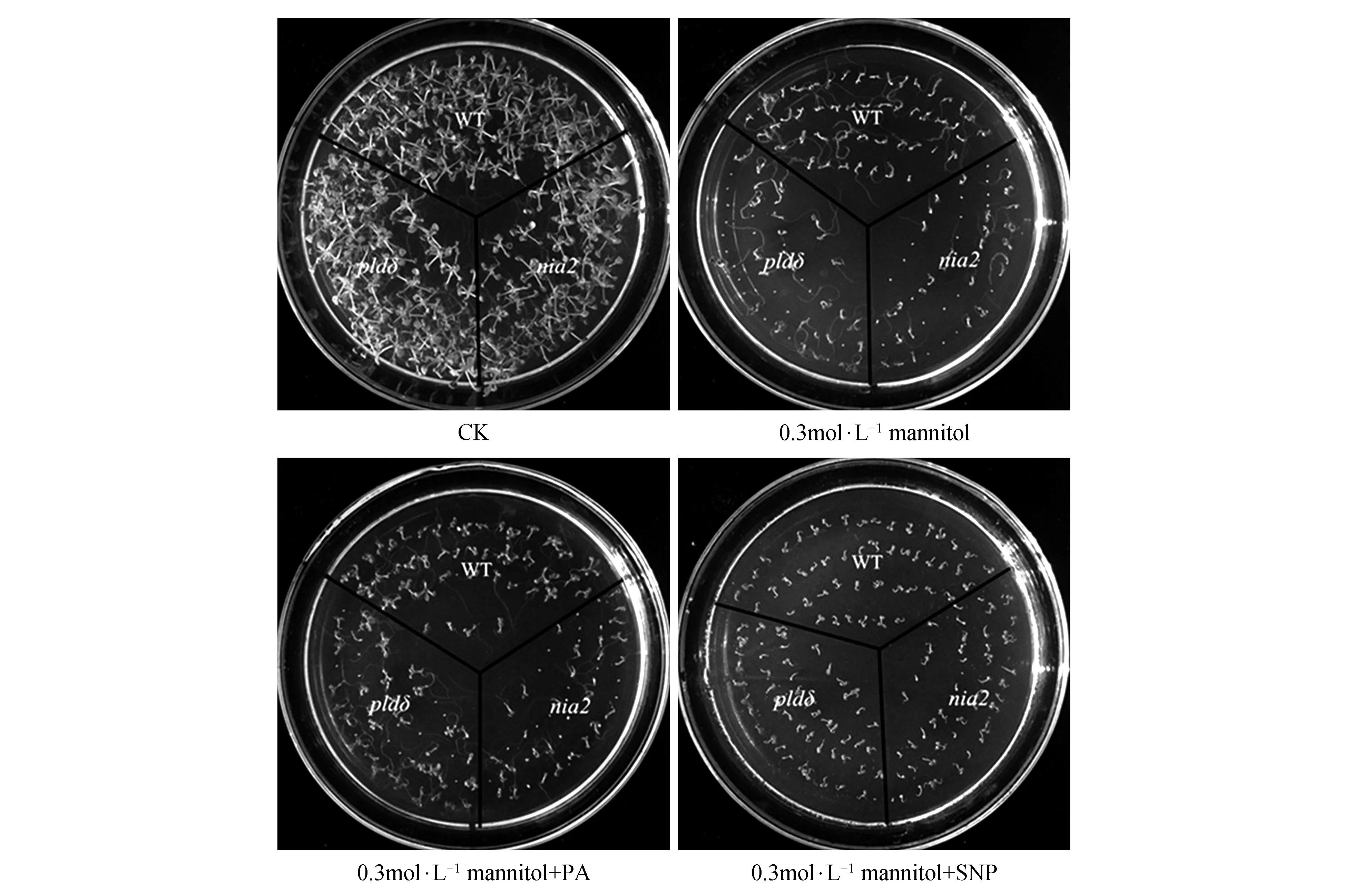
图8 干旱胁迫对WT,pldδ和nia2种子生长的影响Fig.8 Effect of drought stress on growth of WT,pldδ and nia2 seeds
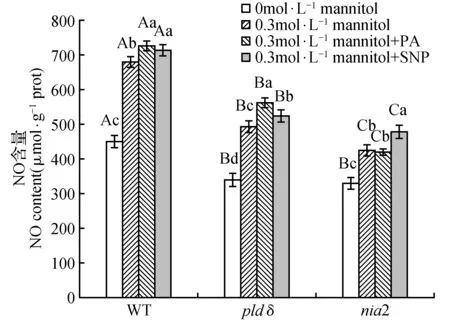
图9 外源SNP和PA对干旱胁迫下pldδ和nia2中NO含量的影响Fig.9 Effects of exogenous SNP and PA on NO contents of pldδ and nia2 under drought stress
3 讨论
3.1 PLDδ和NO参与干旱胁迫下拟南芥的信号转导过程
细胞膜是植物感受外界环境刺激最初的部位,而PLD是一类重要的跨膜信号转导酶类[23]。低温胁迫下对PLDδ的研究较多[24],而对干旱胁迫下PLDδ的作用研究较少。本研究发现0.3 mol·L-1甘露醇处理下PLD活性变化最为显著,PLD活性除24 h低于对照组外,其他时间均显著升高(图2),干旱胁迫下PLDδ基因相对表达量发生显著变化,除12 h降低外其他时间段均显著升高(图6A),推测PLD活性在24 h的降低与PLDδ基因表达降低有关,PLDδ基因表达与PLD活性均随胁迫时间表现为先降低而后上升的趋势,说明PLD活性变化与PLDδ的基因表达呈正相关,且基因表达先于酶活变化。
大量研究结果表明,NO能够通过调节植物渗透调节物质的积累[25]、气孔运动[26]光合作用和抗氧化酶活性[27]等生理过程来缓解干旱胁迫造成的不良影响,以此来增强植物对干旱的耐受性。植物体内NO来源非常丰富,主要通过NOS和NR途径产生[28],但系统的研究干旱胁迫下NO主要产生途径的实验依据较少。本研究发现NO含量,NOS和NR活性在干旱胁迫下均显著变化(图3~4),其中NR活性增加比NOS活性更为显著;通过检测NO三种突变体中NO含量变化情况(图5),发现干旱胁迫下三种突变体幼苗NO含量均较WT显著降低,其中nia2中NO含量最少,以上结果表明NOS途径和NR途径均参与干旱胁迫下NO的产生,且NR途径对NO产生的贡献更大,这与Xuan[29]和Lozano-Juste J[30]等的研究结果相似。为了研究NOS和NR活性变化的原因,我们研究了与NOS和NR相关的基因NOA1,NIA1和NIA2的表达情况,发现NOA1基因表达量(图6B)在前期上调而在后期下调,这与NOS活性变化并没有表现出相同趋势,有研究表明,NOA1基因是目前唯一在植物中报道的以L-精氨酸(L-Arg)为原料参与NO合成的酶的基因[31],根据本实验结果我们推测,由NOA1基因调控的NOS途径可能主要参与了干旱胁迫早期NO的生成,说明植物中还存在依赖L-Arg的其它基因参与NOS诱导的NO合成途径。Yu等[32]发现拟南芥NR1和NR2有着相似的氨基酸序列,但也有完全不同的区域,在信号转导和氮同化过程中起着不同的作用,本研究中NIA1和NIA2基因表达量均随胁迫时间逐渐上调(图6:C~D),这与NR活性具有相同变化趋势,表明干旱胁迫下NR活性的上升与NIA1和NIA2两个基因表达呈正相关,其中NIA2的表达量显著高于NIA1,说明NR活性的升高主要与NIA2基因表达有关,NR2途径是干旱胁迫下NO的主要产生途径。
3.2 PLDδ,NIA2缺失影响干旱胁迫下拟南芥的种子萌发
在实验中我们发现pldδ和nia2两种突变体对干旱胁迫更为敏感,干旱显著抑制了pldδ和nia2的种子萌发,且对nia2的萌发抑制效果更为显著(图7A,图8),推测NR2和PLDδ这两个酶在干旱胁迫下的种子萌发过程中发挥了重要作用,NR2在这一过程中可能起着更重要的作用。糊粉层被认为是种子休眠的决定因素,拟南芥糊粉层细胞能够产生NO,诱导储存蛋白的液泡化,进而促进种子萌发[33]。Zhang等[34]发现0.1和0.5 mmol·L-1的SNP明显促进渗透胁迫下小麦种子萌发,胚根和胚芽的伸长,提高萌发过程中淀粉酶和内肽酶的活力,加速贮藏物质的降解,同时还能促进渗透胁迫下的过氧化氢酶(CAT)、抗坏血酸酶(APX)活性的上升和脯氨酸酶含量的积累,抑制脂氧合酶(LOX)的活性,从而提高渗透胁迫下小麦种子萌发过程中的抗氧化能力。Zhang[35]等在玉米中的研究发现PLD/PA参与NO传递盐信号过程,暗示PLD和NO之间存在某种信号转导关系。NR2和PLDδ缺失最直接的效应便是下游产物的减少,因此我们添加NO供体SNP以及PLDδ产物PA进行补偿实验(图7B),发现SNP和PA处理均可以不同程度的逆转干旱胁迫对WT种子萌发的抑制,SNP可以缓解干旱胁迫对nia2萌发的抑制,而PA处理则没有效果,说明干旱胁迫下PA信号转导依赖于NR2;PA和SNP处理均可促进干旱胁迫下pldδ的种子萌发,推测干旱胁迫下NO信号转导不依赖于PLDδ;PA和SNP对pldδ和nia2中NO含量的影响也得到了相似的结果,SNP能促进WT,pldδ和nia2中NO的产生,PA能促进WT和pldδ中NO的生成,但不能促进nia2中NO的产生(图9),表明PLDδ/PA可通过NR2途径产生的NO参与干旱胁迫下的种子萌发过程,PLDδ位于NO信号的上游。干旱胁迫下pldδ和nia2补偿PA和NO后种子萌发并不能恢复到与WT相同的水平,说明NR2和PLDδ还通过其他途径影响干旱胁迫下的种子萌发过程。
综上所述,PLD和NO能积极响应干旱胁迫,PLD活性变化与PLDδ基因的表达呈正相关;由NR2途径产生的NO是干旱胁迫下NO的主要生成途径,其活性的上升与NIA2基因表达呈正相关;由NOA1基因调控的NOS途径主要参与了干旱胁迫早期NO的生成;干旱胁迫下PLDδ/PA位于NO信号的上游,且PLDδ的产物PA主要通过NR2途径产生的NO促进拟南芥的种子萌发。本研究将细胞膜重要的信号转导酶PLD与气体信号分子NO联系起来,揭示了干旱胁迫下拟南芥种子萌发中PLDδ及NO的信号转导关系,为PLD和NO的信号研究提供了新的思路,但PA本身作为一种第二信使,具有复杂的信号转导途径,并且与靶蛋白有着很多的结合及激活方式[36],本研究中PA与NR2具体的结合或激活方式还需要进一步深入的细胞生物学和分子生物学方面的实验来验证。

