27例乳腺实性乳头状癌临床病理特征及预后分析
孔 源 潘婷婷 马小鹏 邓福生
乳腺实性乳头状癌(solid papillary carcinoma, SPC)是一种罕见的乳腺癌,占乳腺癌比例不足1%, Maluf等[1]1995年首次提出SPC的概念,2012年WHO乳腺肿瘤分类[2-3]将SPC定义为特殊类型的乳头状癌,以致密排列、膨胀性生长、富含细胞的结节为特征,并将其分为原位癌和浸润性癌2种类型。现回顾性分析27例SPC患者临床病理资料,旨在增进对SPC临床病理特征的认识,探讨其免疫表型特点,深入认识SPC的生物学行为及预后特点。
1 资料与方法
1.1 一般资料 纳入研究的病例均选自中国科学技术大学附属第一医院普外科甲状腺乳腺诊疗中心2013年1月至2017年7月收治的乳房肿块或者乳头溢液患者,经手术切除肿块,2名病理医生阅片诊断,符合2012年乳腺肿瘤WHO分类[2]中SPC的形态学描述,包括伴有黏液癌、神经内分泌癌等浸润性癌的病例,共纳入27例,其中单纯SPC患者12例,SPC伴有不同程度浸润性癌者15例。
1.2 观察指标及随访 收集所有患者的临床病例资料,包括确诊时年龄、性别、肿瘤大小、肿瘤数目、淋巴结转移情况、组织学分级以及肿瘤TNM分期等。所有患者随访资料完整,随访截止日期为2017年7月31日。无病生存期(disease free survival, DFS)定义为从手术之日至影像学证实肿瘤复发或者转移,或者由于任何原因导致死亡的时间。总生存期(overall survival, OS)定义为从手术之日到因任何原因所致死亡的时间或随访截止。
1.3 免疫组织化学染色 将手术切除的乳房肿块标本经10%中性福尔马林固定,石蜡包埋,常规连续切片(4 μm) ,先行HE 染色,然后按说明书行免疫组化SP法染色。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)、Ki-67、突触素(synaptic element syn,Syn)、嗜铬素A (chromogranin A,CgA)、神经细胞黏连分子(neural cell adhesion protein,CD56) 染色结果取自我院病理科常规病理报告,对于病理报告中缺失染色项目,采用SP二步法进行免疫组织化学染色。由2位病理科医生分别进行染色结果判定及复核。
1.4 荧光原位杂交技术(FISH检测) 对于免疫组化染色结果,HER-2 (++)病例进一步进行FISH检测,当HER2/CWP17比值> 2.0 或每个细胞中HER-2扩增数目大于6定义为HER-2阳性[4]。

2 结果
2.1 SPC临床特征 所有患者均为女性,单纯SPC组患者年龄45~68岁,中位年龄66岁,SPC伴有浸润组患者年龄45 ~ 68岁,中位年龄57岁,患者首诊症状主要是无痛性乳房肿块、乳头溢液或者两者同时存在。12例单纯SPC组患者中8例患者(8/12,66.7%)仅表现为血性乳头溢液,仅4例患者(4/12,33.3%)因可触及的乳房肿块就诊;而15例SPC伴有浸润组中,所有患者均可触及无痛性乳房肿块,其中7例(7/15, 46.7%)同时伴有血性乳头溢液。单纯SPC组66.7%患者肿瘤直径≤2 cm,而SPC伴浸润组73.3%患者肿瘤直径>2 cm(且有4例患者肿瘤数目超过2个),两组患者肿瘤直径大小差异有统计学意义(P< 0.05)。单纯SPC组12例患者中8例患者接受了前哨淋巴结活检术,术中冰冻病理提示前哨淋巴结未见明显癌转移,故行单纯乳房切除术,另4例患者行乳腺改良根治术。SPC伴有浸润组15例患者中,8例患者行单纯乳房切除术,另7例行乳腺癌改良根治术,其中1例患者肿瘤大小约4.5 cm×2 cm,诊断SPC伴浸润性黏液癌,腋窝淋巴结9/25枚见癌转移。详见表1。
2.2 SPC病理特征 大体上,27例患者肿瘤呈实性,边界较清楚,肿瘤直径0.3~5.5 cm,质中或韧,偶尔质嫩脆,切面灰白、灰黄或灰褐,其中7例伴有导管内乳头状瘤,8例伴有导管扩张,2例伴有囊肿形成,囊内含有暗褐色液体,其余病例无特殊阳性发现。
镜下:肿瘤细胞围绕纤维血管轴心呈实性排列,充满乳腺导管腔内,终末乳腺导管小叶单位呈膨胀性生长。肿瘤细胞形态呈圆形、卵圆形或者短梭形,大小较一致,肿瘤细胞之间界限清楚,胞质丰富,呈嗜酸性细颗粒或淡染透明,细胞核居中或偏位,呈圆形、卵圆形、长梭形或短梭形,核染色质纤细、淡染,核仁小,位置居中,有时核仁不明显,细胞核级别较低,轻-中度异型,核分裂象少见,多< 5/10 高倍视野 (high power field,HPF)。HE染色可见肿瘤细胞黏液分泌,细胞内外可见黏液,可形成黏液湖。27例患者中有15例伴有浸润性癌,其中4例同时出现神经内分泌癌和黏液腺癌,5例仅出现神经内分泌癌,6例为SPC伴有微浸润。详见图1。
免疫组化结果显示,两组间Ki-67表达差异有统计学意义(P<0.05),其余如激素受体ER、PR、HER-2以及神经内分泌指标如Syn、CgA和CD56表达差异无统计学意义(P>0.05)。1例单纯SPC患者HER-2免疫组化表达呈2+,经FISH检测显示无扩增,1例SPC伴有浸润者显示HER-2阳性表达。单纯SPC组75%患者Syn阳性,58.3%患者CgA阳性,SPC伴浸润组66.7%患者Syn阳性,46.7%患者显示CgA阳性。单纯SPC组75%患者Ki-67表达≤14%,而SPC伴浸润组仅4例患者(26.7%)Ki-67呈低表达。详见图2、表2。
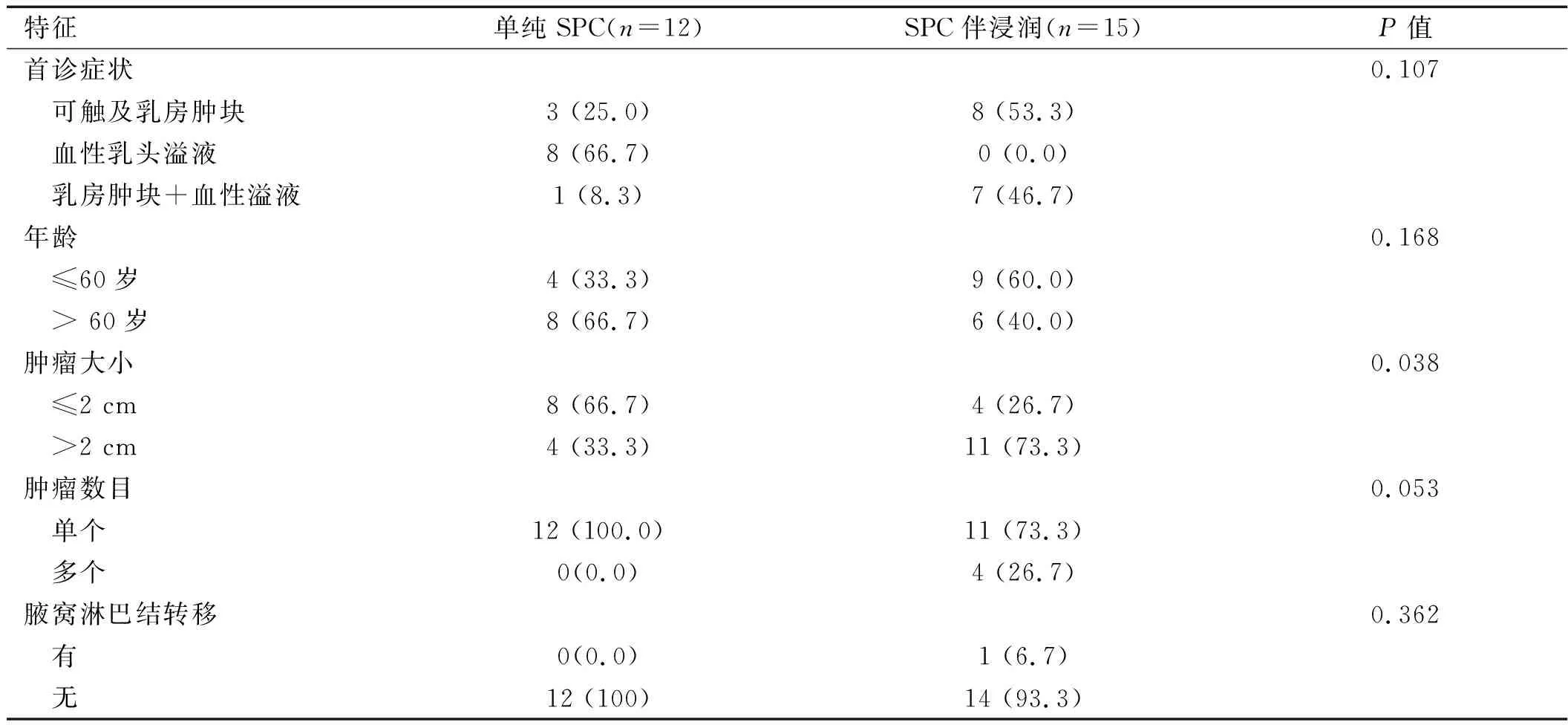
表1 单纯SPC与SPC伴有浸润性癌患者临床资料对比[例(%)]
注:SPC为乳腺实性乳头状癌
2.3 治疗与预后 单纯SPC组12例患者中8例患者接受了前哨淋巴结活检术,术中冰冻病理提示前哨淋巴结未见明显癌转移,故行单纯乳房切除术,另4例患者行乳腺改良根治术。SPC伴有浸润组15例患者中,8例患者行单纯乳房切除术,另7例行乳腺癌改良根治术,其中1例患者腋窝淋巴结9/25枚见癌转移。单纯SPC组12例患者、SPC伴浸润组2例患者术后仅接受了内分泌治疗,口服他莫昔芬或者来曲唑;SPC伴浸润组中1例伴有腋窝淋巴结转移的患者,至随访截止日期,已完成术后辅助化疗及放疗,目前内分泌治疗中;

表2 单纯SPC和SPC伴有浸润性癌患者免疫组织化学染色结果比较[例(%)]
注:SPC为乳腺实性乳头状癌
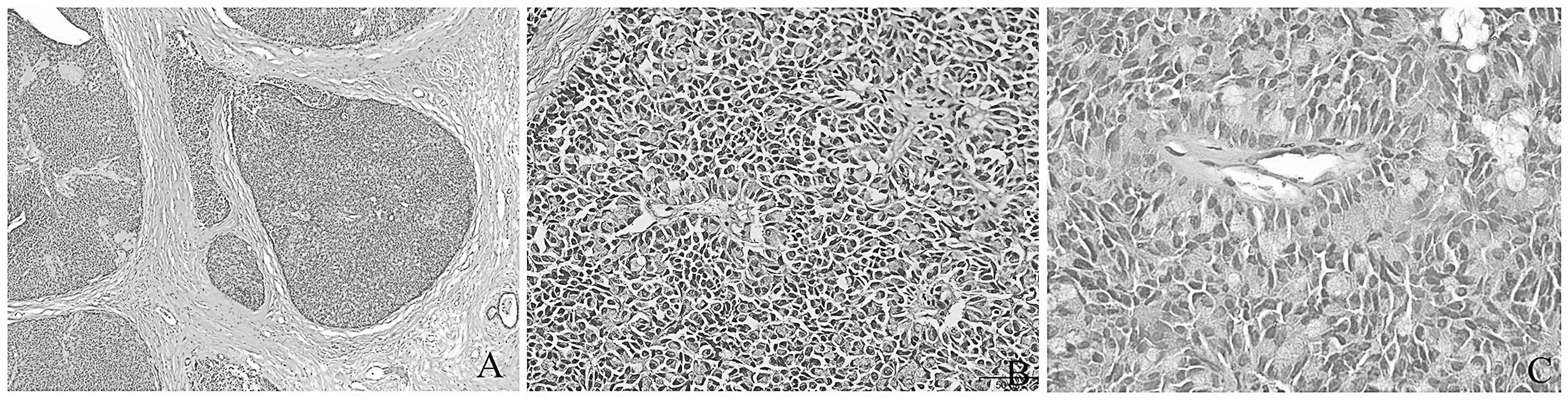
图1 实性乳头状癌HE染色结果
注:A为乳腺终末导管呈膨胀性扩张,形成不规则形或卵圆形界限清楚的结节状团块,结节被纤维组织分隔 (×40);B为肿瘤细胞围绕纤维血管束呈栅栏状排列形成假菊形团样结构 (×200 );C为肿瘤细胞外可见局灶黏液 (×400 )
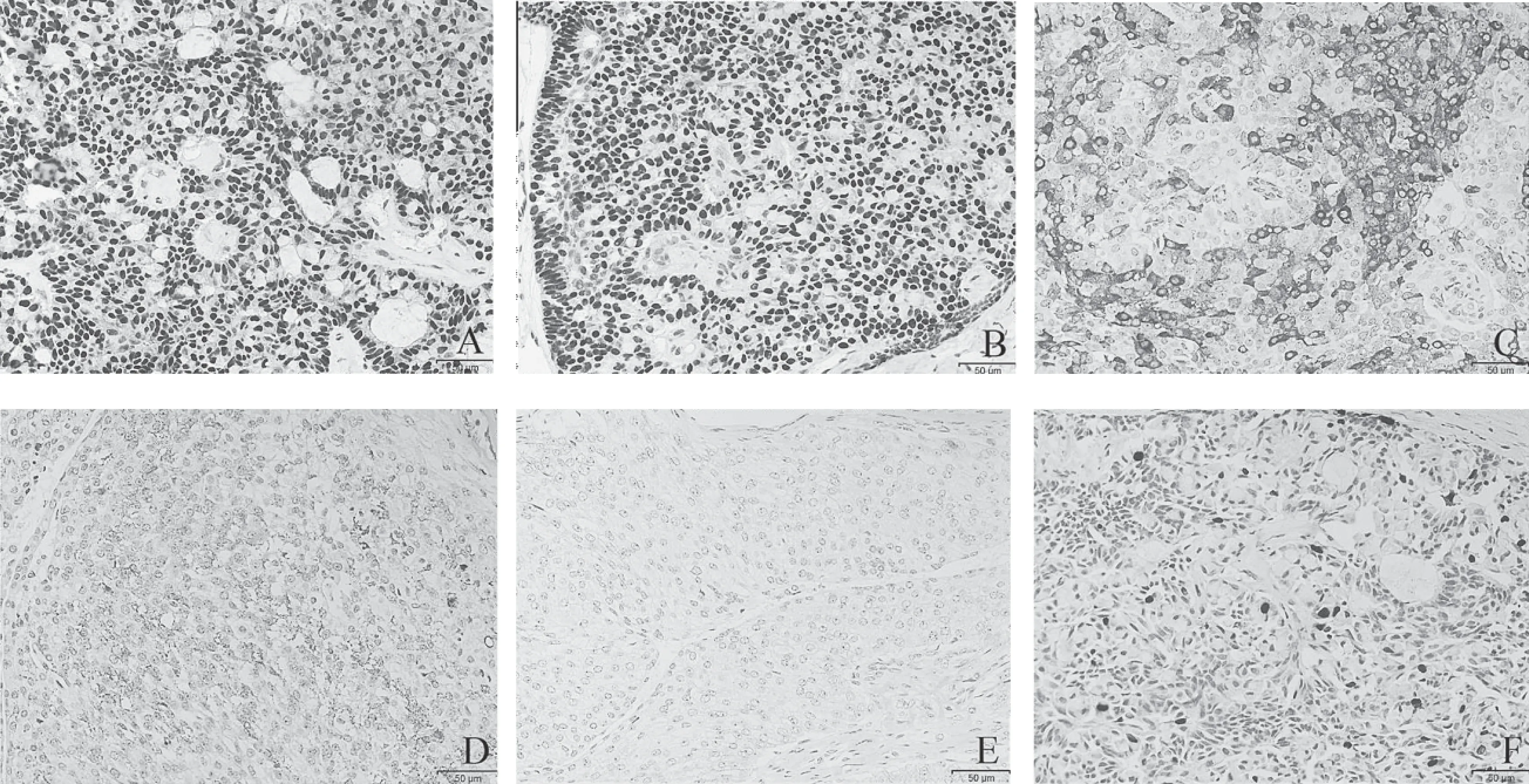
图2 实性乳头状癌免疫组织化学染色结果
注:A为肿瘤细胞ER强表达 (×200),B为肿瘤细胞PR强表达(×200),C为肿瘤细胞显示突触素Syn弥漫阳性表达 (×200),D为肿瘤细胞CD56阳性表达 (×200),E为肿瘤细胞HER-2阴性表达 (×200),F为肿瘤细胞Ki-67低表达(×200)
其余12例患者术后均接受了多西他赛联合环磷酰胺化疗4个疗程,化疗结束后均行内分泌治疗。27例患者总体生存期4.5 ~ 47.5个月,中位生存时间19.5个月,平均OS为23.9个月,至随访截止日期,所有患者均未出现复发或者转移,无肿瘤相关死亡。
3 讨论
SPC是一种罕见的乳腺恶性肿瘤,好发于老年女性的乳腺非典型性乳头状病变,具有特殊的临床和病理学特征。本组27例患者平均发病年龄为59.2岁,仅3例患者年龄小于50岁,SPC好发于老年女性,这与国内外相关报道一致[5-7]。乳头血性溢液是SPC突出的临床表现,尤其是单纯SPC患者,乳头溢液常常是其首发表现,本组病例中16例(59.3%)患者伴有乳头溢液,病变部位主要位于乳头及乳晕周围,部分病例伴有乳腺导管扩张及囊肿形成。因此,对于伴有血性乳头溢液,尤其是无明显乳房肿块的老年女性,应想到本病的可能。本研究发现,单纯SPC和SPC伴有浸润患者肿瘤大小具有显著差异,这说明可能伴有浸润者肿瘤生长速度快于单纯SPC患者。本组中所有患者无远处器官或骨转移,仅1例SPC伴有浸润患者存在腋窝淋巴结微转移,说明SPC肿瘤总体侵袭性不高。
SPC的诊断主要依赖于病理学诊断,细针穿刺细胞学诊断SPC有一定难度,很难与其他乳头状病变鉴别,乳头状病变细胞学涂片病理常有细胞轻度不典型增生,细胞聚集或者细胞分离等特点,因此,细针穿刺细胞学病理不推荐用于SPC的鉴别诊断[8]。而空芯针穿刺活检结合免疫组化分析在SPC诊断中具有重要作用,当空芯针穿刺活检病理结果怀疑SPC时,推荐行手术切除,以明确诊断[9]。目前,国内外多项研究[6-7,10-11]证实,SPC分子分型多表现为Luminal A型,即激素受体ER和PR强阳性,HER-2阴性以及Ki-67低表达,当伴有浸润性癌时,常表现为Luminal B型。本研究结果与文献报道一致,单纯SPC组,Luminal A型患者9例(75%),伴有浸润性癌组Luminal A型患者仅4例(26.7%),连续性变量Ki-67的截断值14%可以用来预测Luminal型乳腺癌患者的预后,即Luminal A型(HR阳性,Ki-67≤14%,HER-2 阴性)较Luminal B型(HR阳性,Ki-67 >14%,HER-2 阴性)患者具有更好的预后[12-14]。这说明,单纯SPC组较SPC伴有浸润癌组患者具有更好的预后,而在本研究中因是回顾性研究,伴有浸润性癌的SPC多为近3年收治,并且所有患者无局部复发或远处转移,从而无法进行生存分析比较,这需要进一步扩大样本量,延长随访时间进行深入研究。
SPC以及SPC伴有浸润患者常常伴有神经内分泌化,文献[1,10]报道,使用突触素Syn、CD56或CgA作为神经内分泌标记时,50%以上的SPC均显示伴有神经内分泌,并且通过电镜可在SPC肿瘤细胞胞质内见到散在分布的密度较高的神经内分泌颗粒。目前,仍缺乏神经内分泌化对于SPC患者预后影响的研究,有研究认为神经内分泌化对于SPC预后无明显意义,而部分研究认为伴有神经内分泌特征可能预示着SPC患者具有更差的预后[3,10,15-16]。在本研究中,SPC组和SPC伴有浸润性癌患者神经内分泌化方面无明显差异,因此,笔者认为SPC并不等同于神经内分泌癌。神经内分泌与临床预后之间关系不甚明确,并且目前缺少针对神经内分泌的靶向治疗,SPC中神经内分泌化对于患者临床预后的影响以及治疗仍需更进一步研究。
对于不伴有浸润的患者,SPC总体预后较好,对于伴有浸润的患者,其预后主要取决于浸润部分的具体情况,浸润性癌可以导致肿瘤侵袭转移,包括局部腋窝淋巴结、远处器官以及骨转移。Maluf等[1]报道的腋窝淋巴结阴性的SPC伴有浸润性癌的患者,临床出现肺转移,表明对于腋窝淋巴结阴性的SPC伴有浸润的患者可以发生远处器官转移,值得临床关注。本研究中,16例患者接受前哨淋巴结活检术,术中病理均提示前哨淋巴结未见明显癌转移,另11例患者行腋窝淋巴结清扫术,术后淋巴结病理结果与目前国内外报道结果较一致,即单纯SPC组患者无腋窝淋巴结转移,并且SPC伴有浸润性癌患者腋窝淋巴结阳性率较低[5-7,10]。所有患者术后无局部复发、远处转移以及肿瘤相关死亡,SPC的总体生存期较好。目前认为SPC患者的预后与其手术方式之间的关系不甚明确,可能无显著影响,因此,对于SPC,足够范围的局部手术可能就足够[17]。目前,对于SPC的治疗,各乳腺诊疗中心乳腺切除率差异较大(7%~88%),可能与SPC发病率较低,对SPC肿瘤生物学特性认识不足以及可参照的临床预后资料有限有关[17-19]。笔者认为,对于较小的、境界清楚、缺乏乳腺浸润证据的以及影像学支持的腋窝淋巴结阴性的患者,病理学诊断排除合并浸润性癌时,适当的局部扩大切除、前哨淋巴结活检或者腋窝淋巴结清扫联合术后内分泌治疗可能对于单纯SPC治疗就足够,而这需要进行大样本量多中心的随机对照前瞻性研究来证实。关于前哨淋巴结活检在SPC手术中的应用是否安全有效目前依然缺乏相关的经验和证据,即使腋窝淋巴结转移率较低[20]。
综上所述,SPC是一种特殊类型的低级别原位癌,好发于老年女性,患者常伴有乳头溢液病史。SPC通常表现为Luminal A型,并且常伴有神经内分泌。大部分SPC患者伴有浸润性癌,且以神经内分泌及黏液腺癌为主。病理鉴别诊断较复杂,包括所有的良性以及恶性乳头状病变。单纯SPC患者预后较好,然而,即使是伴有浸润性癌,肿瘤常表现为惰性,以及较低的复发和转移率。SPC的治疗参考乳腺的手术、化疗、放疗以及内分泌治疗的综合治疗,由于SPC较低侵袭潜能的生物学行为、较低的复发、转移以及肿瘤相关死亡发生率,因此,适当的局部治疗联合术后内分泌治疗可能是足够的,SPC尤其是伴有局灶浸润的SPC需与浸润性非特殊癌相鉴别,以防止过度治疗的可能。

