腐败希瓦氏菌及其与蜂房哈夫尼亚菌共培养对冷藏大菱鲆的致腐能力
李婷婷,马 艳,李学鹏,仪淑敏,励建荣,
(1.大连民族大学生命科学学院,生物技术与资源利用教育部重点实验室,辽宁 大连 116600;2.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
大菱鲆(Scophthalmus maximus)属于鲽形目、鲆科、菱鲆属,俗称欧洲比目鱼,在中国俗称“多宝鱼”,原产于欧洲大西洋海域,是世界公认的优质比目鱼之一[1]。大菱鲆的肉质细嫩、鲜美,营养价值丰富,且其生长速度快、适应能力强。自从1992年被成功引入我国后,使我国鲆鲽类养殖业快速发展,成为了我国海水养殖鱼类的支柱产业。目前,大菱鲆的养殖主要集中在山东、辽宁等北方地区,且其销售半径逐步扩大。但是由于大菱鲆水分和营养物质含量高,易腐败变质,因此大菱鲆在贮运过程中的品质特性和质量安全日益引起人们的关注[2]。
鲜度是评价水产品品质的一个重要指标,水产品的价值大多取决于其鲜度[3]。水产品在贮藏过程中极易在微生物、酶及脂肪氧化等作用下发生腐败变质,其鲜度变化与微生物生长、理化指标变化及蛋白质降解都有着密切关系[4]。尽管引起水产品腐败变质的因素较多,但其最主要的原因是微生物的生长代谢[5]。在水产品腐败变质过程中,不同微生物的致腐能力存在差异,其中只有部分微生物参与了腐败过程,这些微生物被称作特定腐败菌(specific spoilage organisms,SSO)[6-7]。SSO在水产品贮藏过程中的生长速度较其他微生物快,且其致腐能力强[8]。有研究表明,在有氧冷藏过程中,来源于不同水域水产品的SSO多为假单胞菌(Pseudomonas spp.)或者腐败希瓦氏菌(Shewanella putrefaciens),而来自受污染水域水产品的SSO是肠细菌(Enterobactericeae)[9-10]。崔正翠等[11]发现腐败希瓦氏菌和假单胞菌是冷藏大菱鲆的SSO。Nychas等[12]研究发现一些耐冷的肠杆菌,如蜂房哈夫尼亚菌(Hafnia alvei)、成团肠杆菌(Enterobacter agglomerans)、变形斑沙雷菌(Serratia proteamaculans)等,在肉及肉制品中数量不多,却能够引起其腐败变质。因此,研究水产品腐败菌在水产品腐败变质中所起作用具有重要意义。
腐败希瓦氏菌是一种嗜冷革兰氏阴性菌,为运动杆菌,致腐潜力大,能够将氧化三甲胺还原为三甲胺,并产生硫化氢,同时能够降解一些含硫氨基酸产生挥发性硫化物,该菌在低温贮藏鱼类及其他产品腐败过程中起到重要作用[13]。蜂房哈夫尼亚菌是革兰氏阴性、运动性、有鞭毛的兼性厌氧杆菌,是细菌性食品污染菌,能够造成富含蛋白质的乳制品、肉制品及水产品在低温贮藏条件下的腐败变质,同时也是一种条件性致病菌[14]。本实验将从腐败大菱鲆中分离得到的腐败希瓦氏菌SP22及其与蜂房哈夫尼亚菌Ha-01的混合菌接种于大菱鲆无菌鱼块中,通过研究其在冷藏期间新鲜度相关指标(菌落总数、挥发性盐基总氮(total volatile basic nitrogen,TVB-N)值、K值、Ca2+-ATPase活力及肌肉蛋白结构)的变化,来探究腐败希瓦氏菌SP22对大菱鲆的致腐潜力,也为探讨水产品优势腐败菌及共生菌的致腐机制提供理论依据。
1 材料与方法
1.1 材料与试剂
养殖大菱鲆购买于辽宁省锦州市水产市场,每条鱼的质量为(850±50)g。
蜂房哈夫尼亚菌Ha-01、腐败希瓦氏菌SP22均从腐败大菱鲆中分离获得,并由辽宁省食品安全重点实验室保藏。菌株在溶菌(lysogeny broth,LB)肉汤培养基中28 ℃、160 r/min摇床过夜培养,备用。
平板计数琼脂、LB营养琼脂培养基、LB肉汤培养基青岛海博生物技术有限公司;超微量Ca2+-ATPase试剂盒南京建成生物工程研究所。
1.2 仪器与设备
MLS-3020高压蒸汽灭菌锅 日本三洋公司;HZQ-X300C型恒温振荡器、BPS-100CA恒温恒湿培养箱上海一恒科技有限公司;MS105UD电子分析天平 瑞士梅特勒-托利多有限公司;Biofuge Stratos冷冻高速离心机美国Thermo Fisher Scientific公司;BCM-1000A型生物洁净工作台 苏州净化过滤设备有限公司;Bag Mixer 400型拍打均质机 上海精宏实验设备有限公司;全自动凯氏定氮仪 丹麦福斯公司;UV2550紫外-可见分光光度计杭州惠尔仪器设备有限公司;NMI20型核磁共振成像仪上海纽迈电子科技有限公司;S-4800场发射扫描电子显微镜日本日立公司。
1.3 方法
1.3.1 大菱鲆无菌鱼块的制备
参照Herbert[15]和李学英[16]等的方法制备大菱鲆无菌鱼块。将大菱鲆清洗后,无菌操作切取大菱鲆背部鱼肉,去皮,用灭菌剪刀修剪鱼块至大小形状一致(25~35 g/块)后,无菌水清洗,然后用无菌滤纸擦拭鱼块表面水分,再用体积分数75%乙醇溶液擦拭鱼块,最后将制备好的鱼块放在酒精灯火焰周围灼烧1~2 s。上述所有步骤均在无菌操作台中完成。对制备好的大菱鲆无菌鱼块进行菌落总数测定,菌落总数小于102CFU/g即符合实验要求。
1.3.2 腐败希瓦氏菌SP22及其与蜂房哈夫尼亚菌Ha-01混合菌菌悬液制备及接种
分别挑取腐败希瓦氏菌SP22及蜂房哈夫尼亚菌Ha-01,在LB营养琼脂培养基上划线,28 ℃过夜培养。再分别挑取二者的单菌落于灭菌LB肉汤培养基中28 ℃摇床过夜培养,取1 mL培养后的菌液10 000 r/min、1 min离心,弃去上清液,加生理盐水溶解沉淀,利用比浊仪与麦氏比浊管测定并换算,将其数量调节至约108CFU/mL。再用无菌生理盐水稀释至106CFU/mL。二者的混合菌液由制备好的两种菌液按体积比1∶1混合制得。然后将大菱鲆无菌鱼块浸入制备好的菌悬液中,约3~5 s后捞出沥干。使用灭菌生理盐水浸泡作为对照。将接种后的鱼块装入无菌蒸煮袋中,密封包装,置于4 ℃冰箱冷藏,连续7 d每天取样测定其新鲜度指标变化。
1.3.3 冷藏大菱鲆鱼块的新鲜度指标测定
1.3.3.1 菌落总数的测定
菌落总数按照GB 4789.2—2010《食品安全国家标准食品微生物学检验 菌落总数测定》[17]采用平板倾注法进行测定。
1.3.3.2 TVB-N值的测定
TVB-N值参考FOSS应用子报《鲜鱼和冻鱼中挥发性盐基氮(TVBN)的测定》[18]使用全自动凯氏定氮仪进行测定。
1.3.3.3 K值的测定
K值参考Li Tingting等[19]的方法稍作修改进行测定。称取5 g绞碎的鱼肉于烧杯中,加入25 mL 0.6 mol/L的高氯酸,充分匀浆后,3 000×g离心10 min,取上清液,用1 mol/L的NaOH溶液将其pH值调至6.5~6.8,静置30 min后,3 000×g离心10 min,取上清液,置于-80 ℃贮藏备用。使用前用0.45 μm的水相滤膜过滤。K值按公式(1)计算。

式中:c(HXR)、c(HX)、c(ATP)、c(ADP)、c(AMP)、c(IMP)分别为次黄嘌呤核苷(inosine)、次黄嘌呤(hypoxanthine)、三磷酸腺苷(adenosine triphosphate)、二磷酸腺苷(adenosine diphosphate)、腺苷酸(adenine nucleotides)、肌苷酸(inosine monphosphate)含量/(μmol/g)。
1.3.3.4 Ca2+-ATPase活力的测定
Ca2+-ATPase活力参照超微量Ca2+-ATPase试剂盒的操作说明进行测定。
1.3.3.5 扫描电子显微镜观察肌原纤维蛋白结构
取绞碎后的大菱鲆鱼肉,加入5 倍体积的20 mmol/L的Tris-HCl溶液(pH 7.2),均质后5 000 r/min、10 min离心。取沉淀,加入5 倍体积的10 mmol/L Tris-HCl-NaCl溶液(pH 7.2),均质后5 000 r/min、10 min离心。取上清液,采用双缩脲法测定蛋白液浓度。
参考刘焱[20]的方法稍作修改。首先将提取的鱼肉蛋白质冷冻干燥后,放入4 ℃预冷的体积分数2.5%戊二醛溶液中浸泡24 h。使用pH 7.0磷酸盐缓冲液漂洗3 次,10 min/次。取出后先分别放入体积分数50%、60%、70%、80%、90%、100%的乙醇溶液中浸泡2 次,10 min/次,再经醋酸异戊酯置换2 次,15 min/次,取出后放入冷冻干燥仪中干燥后磨成粉末。将样品喷金后使用扫描电子显微镜进行观察。
1.4 数据分析
采用Excel、SPSS 19.0及Origin 8.6软件进行数据统计分析并绘图,应用One-way ANOVA模型进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 菌落总数的变化
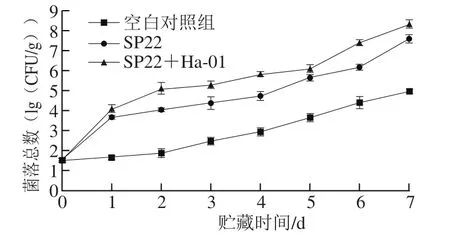
图1 大菱鲆4 ℃贮藏过程中菌落总数的变化Fig. 1 Total viable count changes of turbot during storage at 4 ℃
鱼类所含营养物质丰富,具有高蛋白含量和高水分含量等特点,其中微生物的生长繁殖是导致鱼体死后腐败变质的主要诱因[21]。由图1可知,在冷藏过程中3 组样品的菌落总数均随贮藏时间的延长而增加:其中接种腐败希瓦氏菌SP22的实验组在贮藏第7天时达到7.57(lg(CFU/g));接种腐败希瓦氏菌SP22与蜂房哈夫尼亚菌Ha-01的混合菌组样品菌落总数在第6天时已经达到7.37(lg(CFU/g)),在贮藏第7天时达到8.30(lg(CFU/g));而空白对照组在贮藏第7天时才达到4.95(lg(CFU/g))。根据国际微生物规格委员会食品微生物限量规定,鱼类菌落总数的可接受水平限量为5.70(lg(CFU/g)),最高安全限量为7.00(lg(CFU/g))[22]。所以接种菌株腐败希瓦氏菌SP22的样品组在贮藏第7天时超过最高安全限量,达到腐败,接种腐败希瓦氏菌SP22和蜂房哈夫尼亚菌Ha-01混合菌的鱼块在第6天时已经达到腐败终点,而空白对照组在贮藏第7天时还未超过可接受限量。说明腐败希瓦氏菌SP22能够加快大菱鲆无菌鱼块的腐败变质,且当其与蜂房哈夫尼亚菌Ha-01共培养时致腐潜力更大。张旭东等[23]的研究也表明,蜂房哈夫尼亚菌能够加快冷藏牛肉的腐败,这与本实验的研究结果一致。
2.2 TVB-N值的变化
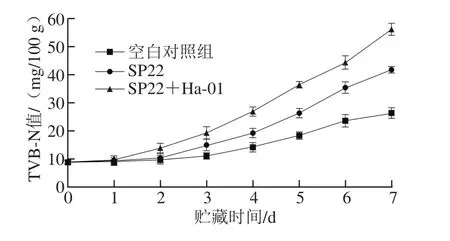
图2 大菱鲆4 ℃贮藏过程中TVB-N值的变化Fig. 2 Change in TVB-N value of turbot fillets during storage at 4 ℃
在水产品贮藏中,TVB-N是蛋白质在细菌和酶的共同作用下分解产生的氨及胺类等碱性含氮物质,能够有效表征水产品的品质变化[24]。由图2可知,接种腐败希瓦氏菌SP22及其与蜂房哈夫尼亚菌Ha-01混合菌的鱼块在冷藏期间TVB-N值增长速度明显快于空白对照组(P<0.05)。其中,接种腐败希瓦氏菌SP22的鱼块在第6天时TVB-N值达到35.33 mg/100 g;接种混合菌株的鱼块在第5天时TVB-N值达到36.31 mg/100 g;而空白对照组的无菌鱼块在第7天时TVB-N值才达到26.31 mg/100 g。根据GB/T 5009.45—2003《水产品卫生标准的分析方法》[25]中规定:海水鱼TVB-N值低于13 mg/100 g时为一级鲜度;超过30 mg/100 g时即不可食用。因此接种腐败希瓦氏菌SP22的鱼块在第6天时已经腐败,而接种混合菌株的鱼块在第5天时已经腐败,这与菌落总数的测定结果基本一致。
2.3 K值的变化
一般认为,鱼体死亡后,其肌肉内的ATP会降解为ADP、AMP、IMP、HXR及HX。K值即HXR与HX占ATP及其相关物质总量的百分比[26],能够较好地反映水产品在贮藏期间的新鲜度变化,K值越小表明其新鲜度越好。一般认为即杀鱼K值≤10%,当K值≤20%时可作为生鱼片的原料,在20%~40%范围内为一级鲜度,在40%~60%范围内为二级鲜度,在60%~80%范围则为初期腐败[27]。
由图3可知,大菱鲆无菌鱼块初始K值为5.54%,品质较高,在4 ℃条件下贮藏时,K值随着贮藏时间的延长呈现上升趋势,且接菌组K值变化明显快于空白对照组(P<0.05)。其中,接种腐败希瓦氏菌SP22的鱼块K值在第6天时为66.73%,已经达到初期腐败,而接种混合菌组的鱼块在第5天时已经达到68.85%,表明鱼块为初期腐败。

图3 大菱鲆4 ℃贮藏过程中K值的变化Fig. 3 Change in K value of turbot fillets during storage at 4 ℃
2.4 Ca2+-ATPase活力的变化
肌原纤维蛋白的主要组成成分是肌球蛋白,ATPase活性源于其球状结构头部,在冷藏过程中肌球蛋白发生变性时,ATPase活性也随之变化,直至失去活性[28]。因此可以用Ca2+-ATPase活性作为评价蛋白质品质的指标,继而反映肌肉的变化情况[29]。
由图4所示可知,各实验组的Ca2+-ATPase活力在整个贮藏期间呈下降趋势,且接菌组下降速度明显快于空白对照组(P<0.05)。其中接种腐败希瓦氏菌SP22以及接种其与蜂房哈夫尼亚菌Ha-01混合菌的鱼块在贮藏前3 d时Ca2+-ATPase活力变化情况基本一致,而从第4天开始,接种混合菌的鱼块下降速度明显快于接种腐败希瓦氏菌SP22单菌组,说明腐败希瓦氏菌可以影响大菱鲆无菌鱼块Ca2+-ATPase活力的变化及其蛋白质的变性,且蜂房哈夫尼亚菌的存在能够加速腐败。
2.5 肌原纤维蛋白显微结构的变化
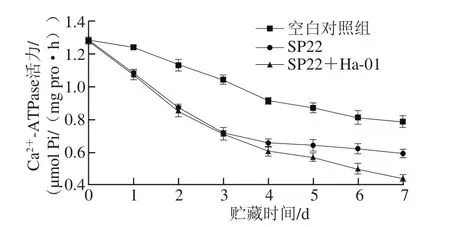
图4 大菱鲆4 ℃贮藏过程中Ca2+-ATPase活力的变化Fig. 4 Change in Ca2+-ATPase activity of turbot fillets during storage at 4 ℃
从图5可以看出,在第0天时各组的肌肉蛋白质颗粒结构完整,表面平滑,随着贮藏时间的延长,蛋白质结构表面逐渐出现孔隙和碎片化。其中,空白对照组在第5天时蛋白质表面才开始出现沟壑,第7天时出现较为明显的断裂。接种腐败希瓦氏菌SP22的鱼块从第4天开始,蛋白质出现较大孔穴,此后蛋白质继续降解、变性。而接种腐败希瓦氏菌SP22与蜂房哈夫尼亚菌Ha-01混合菌的实验组,在冷藏过程中蛋白质破碎速度更快,在贮藏第1天时蛋白质结构已经出现明显扭曲,然后蛋白质逐渐断裂,第3天开始出现较大孔穴,第5天破碎现象已经较为严重。根据王发祥等[30]研究的草鱼肌肉蛋白变化结果可知,在贮藏过程中,蛋白质能够受到组织酶的影响而发生水解,使蛋白质不断地降解变性,最终出现小片化。由此说明,接种大菱鲆SSO能够加快鱼肉蛋白质的降解变性速度。
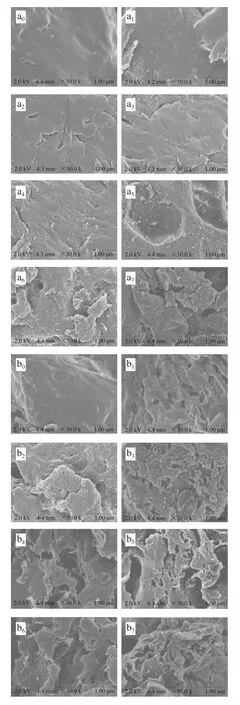

图5 大菱鲆4 ℃贮藏过程中肌肉蛋白质的扫描电子显微镜图Fig. 5 Scanning electron microscope images of turbot muscle proteins during storage at 4 ℃
3 结 论
通过对大菱鲆无菌鱼块菌落总数、TVB-N值、K值、Ca2+-ATPase活力及肌肉蛋白的显微结构等指标进行分析,比较了腐败希瓦氏菌SP22以及其与蜂房哈夫尼亚菌Ha-01混合菌对大菱鲆无菌鱼块的致腐潜力。结果表明:与空白对照组的大菱鲆无菌鱼块相比,接种腐败希瓦氏菌SP22单菌组及混合菌组的鱼块的菌落总数、TVB-N值、K值、Ca2+-ATPase活力及肌肉蛋白的显微结构变化速度均快于空白对照组,且接种混合菌组的鱼块腐败速度更快,这说明接种腐败希瓦氏菌SP22及其与蜂房哈夫尼亚菌Ha-01的混合菌均能够引起大菱鲆的腐败变质,且二者混合时腐败速度更快。因此,腐败希瓦氏菌SP22具有较强的致腐潜力,且在营养物质丰富的情况下其能够与蜂房哈夫尼亚菌Ha-01产生共生作用,从而加速大菱鲆鱼肉的腐败变质。

