青蒿琥酯对人乳腺癌MDA-MB-231细胞的影响及其可能机制
温丽娟, 余韬, 魏凤香
(1.深圳市龙岗区妇幼保健院, 广东 深圳 518172; 2.遵义医学院, 贵州 遵义 563000)
乳腺癌是女性最常见的恶性肿瘤之一,资料显示,近年我国乳腺癌标准人群粗发病率约为42.02/10万,年龄标化发病率约为30.41/10万[1].作为乳腺癌的一种亚型,三阴性乳腺癌即雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体-2 (HER-2)的表达均为阴性的乳腺癌,约占乳腺癌发病总数的15%~20%[2].三阴乳腺癌易出现早期的复发转移,且缺乏有效的靶向治疗药物,病死率高,预后不良,因此针对该病开发新型的化疗药物仍是一个亟待解决的问题.青蒿琥酯(artesunate, ART)是中药青蒿素的衍生物,以往主要用于抗疟疾治疗,近年来,国内外研究发现青篙素类药物具有较为显著的抗肿瘤活性[3-4],其中,ART可在体外细胞试验中对前列腺癌[5]、胃癌[6]及部分类型的白血病细胞[7]等一系列肿瘤细胞系产生明显的抑制作用.DNA损伤反应(DNA damage response, DDR)是保证基因组稳定性的重要机制,同时也是许多抗肿瘤药物的作用靶点.本研究将ART作用于三阴乳腺癌细胞株MDA-MB-231细胞,观察其对该细胞株的增殖、迁移、侵袭能力以及细胞周期的影响,并研究ART对DNA损伤反应通路的作用,以期为ART抗肿瘤作用及其机制的研究及三阴乳腺癌新型抗肿瘤药物的开发提供理论依据.
1 材料与方法
1.1 材料
1.1.1 细胞
乳腺癌细胞株MDA-MB-231购自武汉中国典藏物培养中心.
1.1.2 试剂
青蒿琥酯(sigma公司),以DMSO溶解为质量浓度为200 mg/mL的溶液,-20 ℃分装保存,使用时以培养基稀释;二甲基亚飒即DMSO(sigma公司);四甲基偶氮哇盐即MTT(Gibco公司),以PBS溶液配制成质量浓度为5 mg/mL于-20 ℃分装保存;结晶紫(天津大茂公司),以PBS溶液配制成质量分数为0.5%或1%溶液于4 ℃保存;Matrigel胶(Thermo公司);RNase及碘化丙陡即PI(碧云天公司);兔抗人γH2AX、p-ATM、p-CHK2及山羊抗兔IgG(cell signaling 公司);DMEM高糖基础培养基(Thermo公司);胎牛血清即FBS(杭州四季青公司).
1.2 方法
1.2.1 MTT法检测细胞增殖抑制率
对数期乳腺癌MDA-MB-231细胞以8 000/孔接种于96孔板中,于体积分数为5%CO2、37 ℃培养箱中培养,细胞贴壁后,以不同质量浓度ART(200、100、50、25、12.5、6.25、3.125、0 μg/mL)分别作用24、48、72 h,其中质量浓度0 μg/mL为正常对照组,其余为实验组,同时设置空白对照组(不含细胞及药物),每组设6个复孔,常规培养到达目标时间后,吸出各孔液体,每孔加人质量浓度为0.5 mg/mL MTT溶液100 μL,4 h后弃去,每孔加人DMSO 150 μL,震荡20 min,于酶标仪490 nm波长处检测各孔吸光度并计算细胞增殖抑制率,细胞增殖抑制率=
(A对照组-A实验组)/(A对照组-A空白组)×100%.
1.2.2 结晶紫法观察细胞形态
对数期乳腺癌MDA-MB-231细胞以5×105/孔接种于6孔板中,以不同质量浓度ART(200、100、50、25、12.5、0 μg/mL)作用48 h,吸出各孔液体,PBS轻洗,每孔加入质量分数为4%多聚甲醛溶液固定30 min后,PBS轻洗,加入质量分数为0.5%结晶紫溶液染色10 min,PBS轻洗,观察拍照.
1.2.3 划痕实验检测细胞迁移能力
对数期乳腺癌MDA-MB-231细胞以5×105/孔接种于6孔板中,待细胞平铺长满,用无菌10 μL移液器吸头于各孔内垂直划线,预热PBS溶液洗去飘浮细胞后,观察拍照;以无血清DMEM培养基配制ART(质量浓度50 μg/mL),作用24、48 h观察拍照.
1.2.4 Transwell实验检测细胞侵袭能力
Matrigel胶以1∶6的体积比与培养基混合,取40 μL加入孔径为8.0 μm的Transwell上室中,37 ℃培养箱中放置2 h.待Matrigel凝固后,将600 μL含不同质量浓度ART(100、50、25、0 μg/mL)及质量分数为20%FBS的培养基加入下室,将100 μL含不同质量浓度ART(100、50、25、0 μg/mL)的无血清培养基分别重悬1×105细胞,并加入上室, 37 ℃培养箱中培养24 h.取出上室,于质量分数为4%多聚甲醛溶液固定30 min,擦除上室基质胶,并用质量分数为1%结晶紫溶液染色,显微镜下观察拍照,并计数各孔中的5个视野细胞数,计算平均值.
1.2.5 流式细胞仪检测细胞周期
对数期乳腺癌MDA-MB-231细胞以5×105/孔接种于6孔板中,以不同质量浓度ART(100、50、25、0 μg/mL)作用48 h,收集各组细胞,离心弃上清,以PBS重悬细胞,离心弃上清,加入体积分数为70%的乙醇于-20 ℃过夜固定,次日进行PI染色,流式细胞仪测定细胞周期.
1.2.6 Western blotting检测DNA损伤反应相关蛋白表达
对数期乳腺癌MDA-MB-231细胞以5×105/孔接种于6孔板中,以不同质量浓度ART(100、50、25、0 μg/mL)作用48 h,提取总蛋白,BCA法定量,而后进行变性及上样,SDS-PAGE电泳分离后,湿转至NC膜.用质量分数为5%脱脂牛奶室温封闭1 h,加入一抗,4 ℃孵育过夜.次日,TEST洗涤3×5 min,以HRP标记的二抗室温孵育2 h,TEST洗涤3×5 min,ECL化学发光法进行显影.用Imagine J软件进行灰度分析.以β-actin为内参,目的蛋白相对表达量为目的蛋白灰度值与内参灰度值之比.
1.3 统计学处理
2 结果
2.1 MTT法检测细胞增殖抑制率
不同质量浓度ART分别作用24、48、72 h所得细胞增殖抑制率如表1、图1所示.将同一时间点实验组与对照组细胞增殖抑制率进行单因素方差分析发现,随着药物质量浓度的升高,细胞增殖抑制率逐渐升高;药物处理24 h时,在所设药物质量浓度分组中,药物质量浓度≥50 μg/mL时,有统计学差异(P<0.05);药物处理48 h时,在所设药物质量浓度分组中,药物质量浓度≥6.25 μg/mL时,有统计学差异(P<0.05);药物处理72 h时,与对照组相比,所设药物质量浓度分组均具有统计学差异(P<0.05).
表1不同质量浓度ART对MDA-MB-231细胞增殖的影响
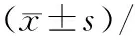
Table 1 Effects of different concentrations of ART on proliferation of MDA-MB-231 cells%
1)与对照组比较P<0.05.P<0.05vsControl group.
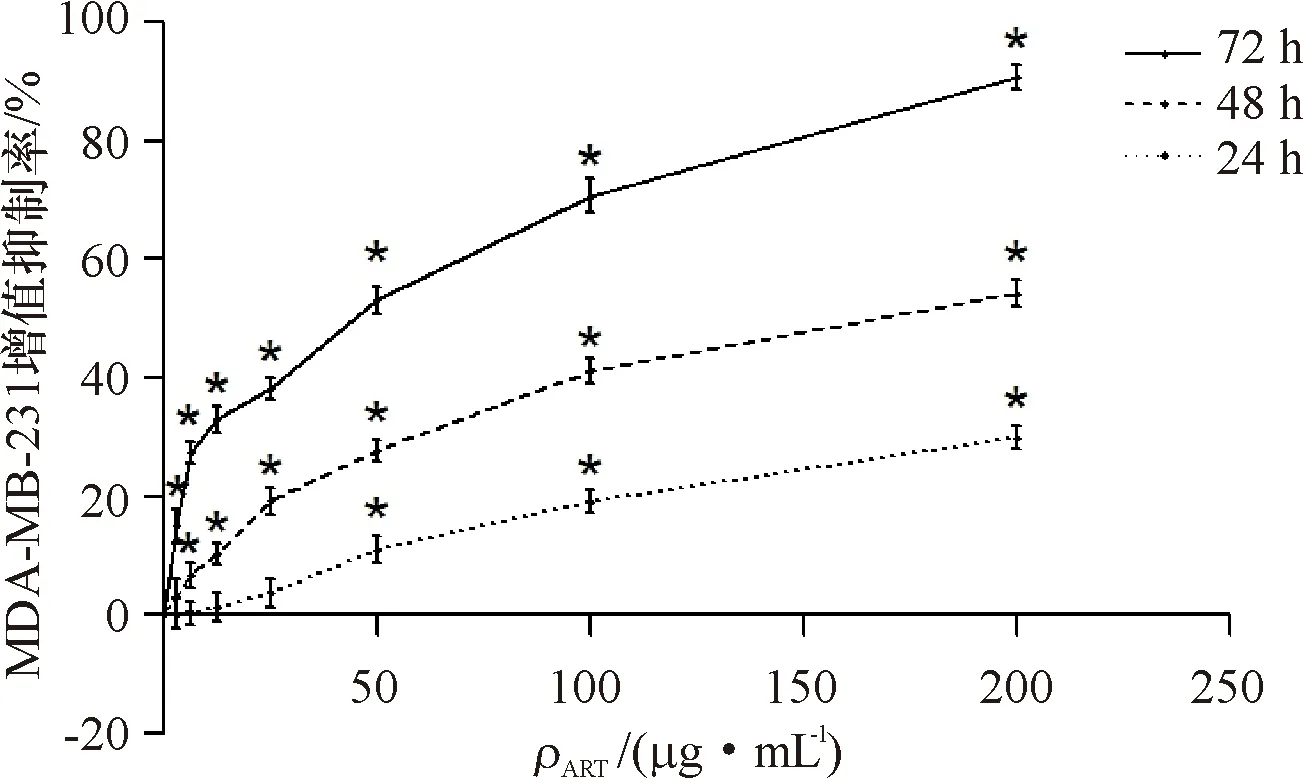
图1 不同质量浓度ART对 MDA-MB-231细胞增殖的影响
Fig.1 Effects of different concentrations of ART on proliferation of MDA-MB-231 cells
2.2 结晶紫法检测细胞存活情况
不同质量浓度ART作用48 h所得细胞结晶紫染色结果如图2所示.4×10光学显微镜下观察发现,经结晶紫染色后,细胞核呈深紫色,胞浆呈淡紫色.与对照组相比,实验组细胞正常结构改变,排列疏松,部分分离变圆,可见不规则形状的深染细胞碎片.随着实验组用药质量浓度的升高,细胞数量逐渐减少,细胞形态不规则程度逐渐加深,形态不规则细胞所占比例逐渐增高.

1)A、B、C、D、E、F分别代表ART质量浓度为0、12.5、25、50、100、200 μg/mL细胞结晶紫染色结果.
1) A, B, C, D, E, and F represent the results of crystal violet staining when the concentrations of ART were 0, 50, 75, 100, 150, and 200 μg/mL respectively.
图2 不同质量浓度ART对 MDA-MB-231细胞增殖的作用结晶紫染色结果(4×10)
Fig.2 Effects of different concentrations of ART on MDA-MB-231 cell proliferation by crystal violet staining (4×10)
2.3 划痕实验检测细胞迁移能力
ART质量浓度为0、50 μg/mL,作用0、24、48 h所得划痕实验结果如图3所示.经ART (50 μg/mL)处理0、24、48 h后,与对照组相比,实验组乳腺癌MDA-MB-231细胞发生迁移的细胞数量显著减少(P<0.05),平均体外迁移距离显著降低(P<0.05).
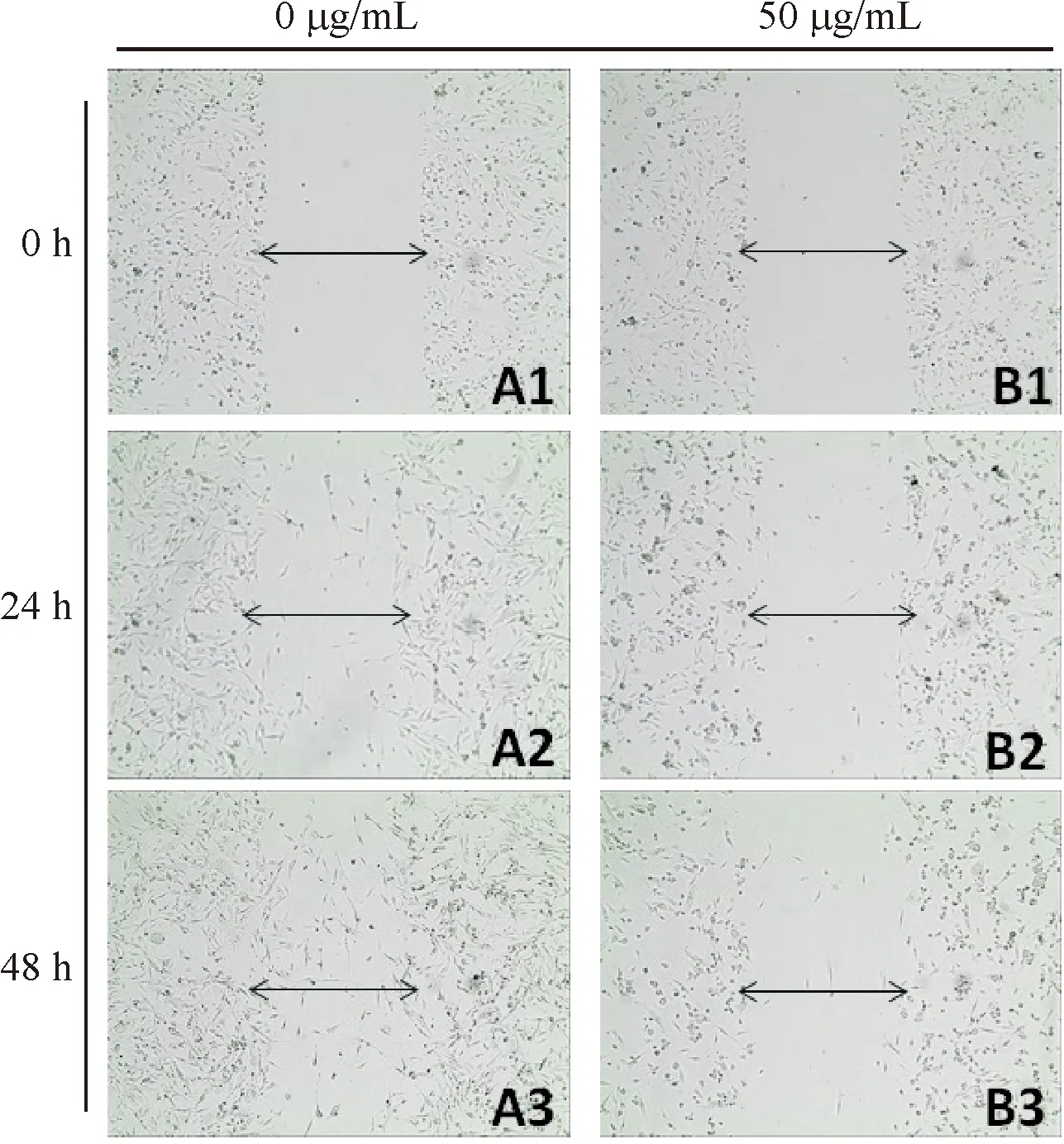
2.4 Transwell实验检测细胞侵袭能力
不同质量浓度ART作用24 h对MDA-MB-231细胞体外侵袭能力的影响如图4所示.10×10光学显微镜下观察发现,与对照组相比,实验组侵袭细胞数量明显减少,且随着药物质量浓度的升高,侵袭细胞数量进一步减少,经单因素方差分析,具有统计学差异(P<0.05).细胞形态上,实验组侵袭细胞较对照组排列疏松,部分细胞失去伪足而呈现不规则形,且药物质量浓度越高越明显.
2.5 流式细胞仪检测细胞周期
不同质量浓度ART作用48 h对MDA-MB-231细胞周期的影响如图5、表2所示.与对照组相比,随着药物质量浓度的升高,实验组G2/M期细胞所占比例逐渐升高.实验结果经单因素方差分析显示,与对照组相比,各实验组G2/M期细胞所占比例均显著升高(P<0.05);与药物质量浓度为25 μg/mL组相比,药物质量浓度为50 μg/mL组及100 μg/mL组中G2/M期细胞所占比例也显著升高(P<0.05);但质量浓度为50 μg/mL组及100 μg/mL组G2/M期细胞所占比例未见明显差异.
1)A1、A2、A3分别代表ART质量浓度为0 μg/mL时,作用0、24、48 h的结果;B1、B2、B3分别代表ART质量浓度为50 μg/mL时,作用0、24、48 h的结果.
1) A1, A2, and A3 represent the results of 0, 24, and 48 h when the mass concentration of ART was 0 μg/mL;B1, B2, and B3 represent the results of 0, 24, and 48 h when the mass concentration of ART was 50 μg/mL.
图3 划痕试验检测ART对 MDA-MB-231细胞迁移能力的影响实验结果(4×10)
Fig.3 Effects of ART on the migration of MDA-MB-231 cells by cell scratch test (4×10)
1)A、B、C、D的ART质量浓度分别为0、25、50、100 μg/mL.
1) The ART concentrations of A, B, C, and D were 0, 25, 50, and 100 μg/mL, respectively.
图4 不同质量浓度ART作用24h对MDA-MB-231细胞体外侵袭能力的影响(10×10)
Fig.4 Effects of different concentrations of ART on the in vitro invasion of MDA-MB-231 cells for 24 h (10×10)
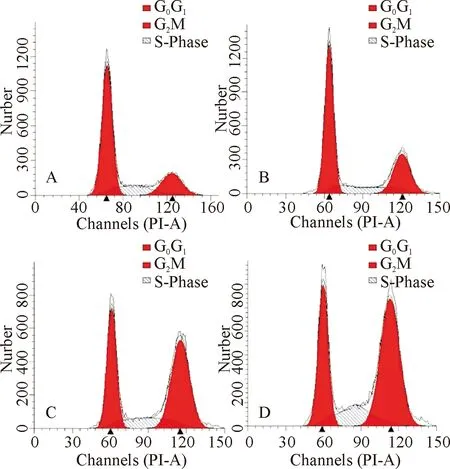
1)A、B、C、D的ART质量浓度分别为0、25、50、100 μg/mL.
1) The ART concentrations of A, B, C, and D were 0, 25, 50, and 100 μg/mL, respectively.
图5 不同质量浓度ART作用48 h对MDA-MB-231细胞周期的影响
Fig.5 Effects of different concentrations of ART on the cell cycle of MDA-MB-231 for 48 h
表2不同质量浓度ART作用48h对MDA-MB-231细胞周期的影响
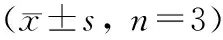
ρART/(μg·mL-1)细胞周期分布/%G0/G1SG2/M063.86±2.0815.61±0.8620.52±1.482555.58±1.7216.16±1.0728.26±0.71)5035.35±1.3216.53±0.7348.11±1.891),2)10031.66±1.7216.31±1.1852.02±1.371),2)
1)与对照组比较P<0.05;2)与质量浓度25 μg/mL组比较P<0.05.
1)P<0.05vsControl group; 2)P<0.05vsthe group ofρART=25 μg/mL.
2.6 Western blotting检测DNA损伤反应相关蛋白表达
不同质量浓度ART作用48 h对MDA-MB-231细胞DNA损伤反应通路相关蛋白的影响如图6所示.结果显示对照组γH2AX(S139),phospho-ATM(S1981),phospho-CHK2(T68)几乎不表达,与之相比,实验组上述蛋白相对表达量均升高(P<0.05),且随着药物质量浓度的升高,蛋白相对表达量进一步升高,与药物质量浓度为25 μg/mL组相比,50及100 μg/mL组γH2AX(S139),phospho-ATM(S1981),phospho-CHK2(T68)蛋白相对表达量显著升高(P<0.05),与药物质量浓度为50 μg/mL组相比,100 μg/mL组具有统计学差异(P<0.05).
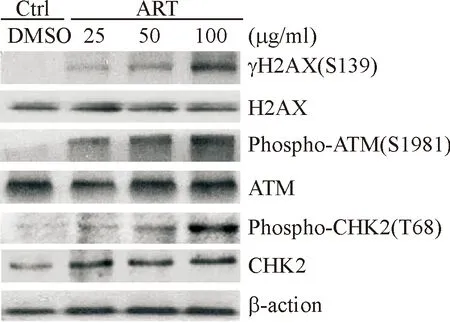
图6 ART对 MDA-MB-231细胞DNA损伤反应通路相关蛋白的影响
Fig.6 Effects of ART on DNA damage response pathway related proteins in MDA-MB-231 cells
3 讨论
三阴乳腺癌具有发病年轻化、肿瘤生长快、恶性程度高、易转移、易复发、预后差等特点,其雌孕激素受体及HER-2受体均呈现阴性,目前常用的内分泌治疗和分子靶向治疗对三阴乳腺癌均未能达到较为满意的疗效,化疗仍是该病目前的主要治疗手段之一[8].近年发现部分中药提取成分抗肿瘤效果显著[9],青蒿素类药物便是其中之一,其抗肿瘤作用机制可能与肿瘤细胞内自由基及活性氧簇的产生、细胞周期阻滞、诱导细胞凋亡和抗肿瘤血管生成等相关[10].
相关研究表明,ART对乳腺癌细胞具有一定增殖抑制作用,Tran等[11]的研究发现ART对乳腺癌MCF7及MDA-MB-231细胞的增殖具有抑制作用,并且当纳米结构脂质载体包裹ART后,MCF7及MDA-MB-231细胞的凋亡率显著增高;在对肿瘤细胞迁移能力、侵袭能力的影响方面,相关研究也证实了ART的抑制作用,Shi等[12]应用与本研究类似的细胞划痕实验和Transwell小室实验,发现ART可抑制食管鳞状细胞癌KYSE-150细胞的体外迁移和侵袭能力,并猜测该作用可能与细胞机械性能的改变有关.在ART对肿瘤细胞周期的影响方面,Greenshields等[13]研究表明ART能够在体外及裸鼠体内抑制卵巢癌细胞的生长,并将其阻滞于G2/M期,研究认为该阻滞很可能与活性氧系统的激活有关.本研究与上述研究结果相一致,ART能够显著抑制乳腺癌MDA-MB-231细胞的体外增殖能力,在药物质量浓度0~200 μg/mL时,随药物浓度的增加、作用时间的延长,增殖抑制作用逐渐增强,同时,该药物能够在50 μg/ml时抑制MDA-MB-231细胞的体外迁移能力,并在质量浓度25、50、100 μg/mL时,呈浓度依赖性地抑制MDA-MB-231细胞的体外侵袭细胞数量.此外,本研究显示MDA-MB-231细胞在ART处理后,G2/M期细胞所占比例显著增高,细胞周期发生了G2/M期阻滞.
为了探讨ART引起以上抑制作用的可能机制,本研究进行了Western blot实验以检测DNA损伤反应通路中相关蛋白水平.DNA损伤反应是当DNA受到损伤时细胞所产生的细胞周期阻滞并进行DNA修复的过程,DNA双链断裂是最严重的DNA损伤形式[14],当双链断裂发生时,首先引起ATM蛋白的磷酸化产生phospho-ATM(S1981),而后形成磷酸化的组蛋白γH2AX(S139),后经一系列下游激活达到DNA修复的目的,与此同时,phospho-ATM(S1981)也使其下游分子CHK2激活为phospho-CHK2(T68),最终引起细胞周期阻滞,为DNA修复提供充足的时间,经上述过程以保证基因组的完整和稳定,但当DNA损伤过于严重以至不能修复时,细胞则不能继续存活[15],许多抗肿瘤药物都通过造成不同形式的DNA损伤来实现抗肿瘤的作用.本研究所检测的γH2AX(S139)蛋白,形成常作为DNA损伤早期的标志性事件,目前被认为是DNA损伤发生的生物标志[16];而phospho-ATM(S1981)的激活常与DNA双链断裂的发生密切相关[17];phospho-CHK2(T68)作为phospho-ATM(S1981)的下游分子,以及参与细胞周期阻滞的重要分子[17],其激活在一定程度上说明了DNA损伤反应通路的激活.本研究结果显示ART处理组中γH2AX(S139)、phospho-ATM(S1981)、phospho-CHK2(T68)的蛋白水平均较对照组发生了具有统计学意义的增高,说明MDA-MB-231细胞极有可能在ART的作用下发生了DNA损伤反应,推测ART对MDA-MB-231细胞的抑制作用可能与DNA损伤反应的发生有关.
综上,本研究发现ART能够抑制三阴乳腺癌MDA-MB-231细胞的增殖、迁移和侵袭能力,并使MDA-MB-231细胞发生G2/M期阻滞,上述结果可能是由γH2AX(S139)、phospho-ATM(S1981)、phospho-CHK2(T68)等蛋白的激活所引起的DNA损伤反应通路的激活导致的.

