新基因FAM172A对人脐静脉内皮细胞增殖和凋亡的影响
赵贝, 常祺, 钱凯, 刘文俊, 林春明, 刘灏
(南方医科大学南方医院血管外科, 广东 广州 510000)
动脉粥样硬化是世界范围内死亡和致残的主要原因,是伴有内皮细胞凋亡的慢性炎症性疾病,而且内皮功能障碍在动脉粥样硬化的发生、进展和临床进程中具有早期和允许作用[1].内皮位于血管的最内层,能够“感知”血液动力和血液信号的变化,并通过释放一些生物活性因子“回应”变化.内皮细胞的增殖、凋亡、功能变化破坏了这些活性因子之间的平衡,从而使血管壁易受血管炎,白细胞黏附,血小板活化,促氧化,血栓形成和凝血功能受损的影响,导致动脉粥样硬化[2-3].内皮细胞的增殖抑制及凋亡的增加促进动脉粥样硬化、血管形成术后再狭窄、斑块的形成、血管栓塞的发生发展,从而导致大血管并发症的发生.基因FAM172A,即序列相似性家族172,也称为C5orf21,由李连喜等[4]在2009年发现,并首次从人动脉组织中克隆出来.随后李连喜团队又在人主动脉内皮细胞、人主动脉平滑肌细胞和THP-1巨噬细胞中发现了FAM172A蛋白的表达,并且证明了高葡萄糖、油酸及LDL均能上调巨噬细胞中FAM172A的表达,其中高糖能以浓度、时间依赖的方式增加人主动脉平滑肌细胞中FAM172A的表达[4-5].但是,FAM172A对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的功能还没有具体的研究.此外,从其他多个领域的研究结果中,可知FAM172A能够调控细胞生长[6-11].本研究采用构建真核基因表达载体以及合成靶向干扰RNA的方法,增加或者干扰FAM172A的表达,初步探索了新基因FAM172A对HUVEC增殖和凋亡的影响.在探索FAM172A对HUVEC影响机制时,发现转录因子NF-κBp65的表达与FAM172A的表达呈正相关,因此推测新基因FAM172A调控HUVEC的增殖和凋亡是通过NF-κB通路实现的.
1 材料和方法
1.1 实验细胞和试剂
HUVEC来自于第四军医大学西京医院心内科实验室;DMEM高糖培养基、胎牛血清购自HyClone公司;质量分数为0.25% Trypsin-EDTA的胰酶购自Gibco公司;青链霉素混合液、感受态细菌E.coli DH5α、质粒小提试剂盒、氨苄青霉素、蛋白胨、琼脂粉、Western及IP细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒购自Solarbio公司;真核表达空白质粒pcDNA3.1/myc-His(-)及重组质粒pcDNA3.1/myc-His(-)-FAM172A为本课题组前期构建;酵母提取物购自OXOID公司;转染试剂Lipofectamine3000、Trizol试剂 购自Invitrogen公司;逆转录试剂盒购自日本东洋纺公司;SYBR实时荧光定量PCR试剂盒购自DBI公司;PCR引物合成来自上海生物工程有限公司;FAM172A-siRNA、阴性对照siRNA(NC)以及绿色荧光(FAM)标记的NC序列由苏州吉玛有限公司合成;硝酸纤维素膜购自美国Pall公司;小鼠源多克隆FAM172A抗体为本课题组前期合成;小鼠源NF-κBp65单克隆抗体购自CST公司;小鼠抗人GAPDH单克隆抗体购自proteintech公司;辣根过氧化酶标记的山羊抗鼠二抗购自中杉金桥;CCK-8细胞增殖试剂盒购自日本同仁;细胞凋亡检测试剂盒购自BD公司.
1.2 质粒构建、扩增及鉴定
真核表达空白质粒pcDNA3.1/myc-His(-)及重组质粒pcDNA3.1/myc-His(-)-FAM172A为本课题组前期构建.将构建的pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A分别转化至E.coli DH5α,挑选阳性单克隆,使用质粒小提试剂盒提取质粒,送至北京华大基因公司进行测序分析.
1.3 siRNA序列的设计与合成
根据提供的FAM172A基因编号 transcript variant 1(NM_032042.5)由苏州吉玛有限公司设计合成.提供针对FAM172基因设计4条siRNA序列(FAM172A-siRNA777、919、1017、1162),1条与已知的人类基因无同源性的阴性对照序列siRNA-NC,1条绿色荧光(FAM)标记的NC序列.
FAM172A-siRNA777上下游引物分别为5′-GAUAUGGAGUAAUAGUACUTT-3′、5′-AGUACU-AUUACUCCAUAUCTT-3′;
FAM172A-siRNA919上下游引物分别为5′-GAAGCGACGUGAUUUCUAUTT-3′、5′-AUAGAA-AUCACGUCGCUUCTT-3′;
FAM172A-siRNA1017上下游引物分别为5′-CAAUCUAUGUUUGGGAUCATT-3′、5′-UGAUCC-CAAACAUAGAUUGTT-3′;
FAM172A-siRNA1162上下游引物分别为5′-GACAGACUCUGUUCACAAUTT-3′、5′-AUUGUGA-ACAGAGUCUGUCTT-3′;
siRNA-NC上下游引物分别为5′-UUCUCCG-AACGUGUCACGUTT-3′、5′-ACGUGACACGUUCG-GAGAATT-3′;
FAM标记的NC上下游引物分别为5′-UUCUCCGAACGUGUCACGUTT-3′、5′-ACGUGAC-ACGUUCGGAGAATT-3′.
1.4 细胞培养、分组及转染
将HUVEC接种于DMEM高糖培养基中(含质量分数10%的灭活胎牛血清,1%的青链霉素混合液),置于37℃,体积分数5%CO2饱和湿度的培养箱内连续培养.质粒转染实验分为转染试剂组(只加了脂质体3000组)、空白质粒组(pcDNA3.1/myc-His(-))、重组质粒组(pcDNA3.1/myc-His(-)-FAM172A),转染之前1 d,将2~4×105/孔HUVEC接种至已加入1.5 mL不含抗生素的培养基的6孔板中,每组3个复孔,置于37 ℃,体积分数5% CO2培养箱中培养,第2天,细胞融合达70%~90%左右转染质粒,4 μg/孔.干扰RNA转染实验分为转染试剂组(只加了脂质体3000组)、阴性对照组(siRNA-NC)、FAM172A-siRNA777组(si777组)、FAM172A-siRNA919组(si919组)、FAM172A-siRNA1017组(si1017组)、FAM172A-siRNA1162组(si1162组),转染之前1 d,将1.5~2×105/孔HUVEC接种至已加入1.5 mL不含抗生素的培养基的6孔板中,置于37 ℃,体积分数5% CO2培养箱中培养,第2天,细胞融合达30%~50%左右转染siRNA,浓度至100 nmol/L.
1.5 质粒转染及siRNA转染效果检测
1.5.1 各组细胞FAM172A mRNA的表达
采用实时荧光定量的方法.pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A转染HUVEC后,于24 h收集细胞,siRNA-NC、FAM172A-siRNA777、FAM172A-siRNA919、FAM172A-siRNA1017、FAM172A-siRNA1162转染HUVEC后,于48 h收集细胞,利用Trizol试剂盒提取RNA,并于核酸分析仪上检测所得RNA浓度,并利用随机引物和逆转录试剂盒逆转录合成cDNA第1条链.逆转录反应体系为10 μL,在37 ℃条件下进行15 min的逆转录反应,在98 ℃条件下进行5 min的酶失活反应,然后迅速置于冰上.利用SYBR Green I染料法检测细胞FAM172A基因的相对表达量.以β-action作为内参照,对每个样本分别进行FAM172A、NF-κBp65、β-action基因检测.FAM172A上游引物5′-CAACGAGAAGCCGATGTA-3′,下游引物5′-CAACGAGAAGCCGATGTA-3′;NF-κBp65上游引物5′-AGCACGACAACATCTCATT-3′,下游引物5′-GGCACAACTCCTTCATCC-3′;β-action上游引物5′-GGAGATTACTGCCCTGGCTCCTA-3′,下游引物5′-GACTCATCGTACTCCTGCTTGCTG-3′.总反应体系体积为20 μL.反应条件:95 ℃ 2 min 变性后,进行40个循环扩增,每个循环参数为95 ℃ 10 s,60 ℃ 34 s和72 ℃ 30 s.随后,95 ℃ 1 min,55 ℃ 1 min, 55~98 ℃ (10 s/cycle, 0.5 ℃/cycle) 86 cycles获得溶解曲线.各基因的表达公式为:
F=2-ΔΔCT,ΔΔCT=(待测组目的基因CT-待测组内参基因CT)-(对照组组目的基因CT值-对照组内参基因CT值),计算FAM172A、NF-κBp65的相对表达.
1.5.2 各组细胞FAM172A蛋白的表达
采用Western Blot的方法检测干预后的HUVEC中FAM172A的表达.pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A转染HUVEC后,于48 h收集细胞,siRNA-NC、FAM172A-siRNA777、FAM172A-siRNA919、FAM172A-siRNA1017、FAM172A-siRNA1162转染HUVEC后,于72 h收集细胞并提取总蛋白,以只加转染试剂组为对照组.配置质量分数为10%的SDS-PAGE凝胶,取等量蛋白的裂解液上样,常规电泳,转膜,封闭;加入鼠源多克隆FAM172A抗体(1∶500稀释)、鼠源NF-κBp65抗体(1∶600)或鼠源GAPDH抗体(1∶6 000稀释),4 ℃过夜.加入山羊抗鼠二抗(1∶6 000稀释),37 ℃孵育2 h;ECL化学发光显色,ImageJ软件分析目的条带相对吸光度值,各组数据均使用相应的甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)进行标准化处理,最终结果为实验组与对照组相对吸光度的比值.
1.6 细胞增殖率检测
(1)采用CCK-8法 将HUVEC细胞以8 000/孔接种至96孔板,按上述方法将质粒DNA pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A转染HUVEC,质粒DNA 0.2 μg/孔(或者将HUVEC细胞以5 000/孔接种至96孔板,按上述方法转染siRNA-NC、siRNA-FAM172A-1162转染至96孔板中,浓度至100 nmol/L),分别于转染0、24、48、72 h,每孔加10 μL的CCK8,继续培养2 h,在多功能酶标仪(Thermo MULTISKAN MK3)450 nm波长处测A450值,以A450间接反映细胞存活数量.每组3个复孔,以只加脂质体组为对照组,无细胞组为空白组,结果按照以下公式计算:细胞增殖=A450实验组(对照组)-A450空白组.
(2)EdU细胞增殖检测法 将HUVEC细胞以60 000/孔接种于24孔板,按上述方法将质粒DNA pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A转染HUVEC,质粒DNA 0.2 μg/孔(或者将HUVEC细胞以40 000/孔接种至24孔板,按上述方法转染siRNA-NC、siRNA-FAM172A-1162转染至24孔板中,siRNA浓度为100 nmol/L),转染48 h后使用EdU 细胞增殖试剂盒对细胞进行DNA及细胞核染色,然后于荧光显微镜下观察并拍照:
细胞增殖率=红色核染数/蓝色核染数×100%.
1.7 细胞凋亡检测
流式细胞技术检测细胞凋亡.按照以上方式将HUVEC接种至6孔板,在质粒转染24 h,siRNA转染48 h后,流式管收集细胞,PBS洗两遍,加入300 μL 1×BindingBuffer重悬细胞,每管加入5 μL的Annexin V-FITC,染色15 min,上机前每管加入5 μL的PI染液,上机检测后,使用FACSDiva Version 6.1.3软件分析实验结果.
1.8 各组细胞中NF-κBp65的表达
收集上述转染各组细胞,提取总RNA,RT-qPCR检测各转染组NF-κBp65的mRNA的表达;收集细胞,提取总蛋白,Western Blot 检测NF-κBp65的蛋白的表达.
1.9 统计学方法

2 结果
2.1 转染效果检测
2.1.1 各组细胞FAM172AmRNA表达的比较
HUVEC转染pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A24 h后,转染试剂组FAM172A的表达为1.001±0.063,空白质粒的表达为1.021±0.034,重组质粒的表达为36.966±2.866(表1、图1).HUVEC转染siRNA-NC、FAM172A-siRNA777、FAM172A-siRNA919、FAM172A-siRNA1017、FAM172A-siRNA1162 48 h后,转染试剂组的表达为1.002±0.090,siRNA-NC组的表达为1.047±0.069,siRNA777组的表达为0.489±0.022,siRNA919组的表达为0.398±0.024,siRNA1017组的表达为0.353±0.017,siRNA1162组的表达为0.317±0.024(表2、图2).由此可知FAM172A-siRNA1162干扰效率最高,可降低68.3%.
表1转染质粒DNA后,各组FAM172AmRNA的表达


组别2-ΔΔCTVehicle1.001±0.063pcDNA3.1/myc-His(-)1.047±0.694pcDNA3.1/myc-His(-)-FAM172A33.966±2.860

图1 转染质粒后实时荧光定量PCR检测FAM172A基因的表达
Fig.1 The gene expression ofFAM172Awere tested by Quantitative Real-time PCR after transfection with the plasmid
表2转染siRNA后,各组FAM172AmRNA的表达


组别2-ΔΔCTMock1.003±0.090siRNA-NC1.047±0.069siRNA-777 0.489±0.022siRNA-9190.398±0.024siRNA-1017 0.353±0.017siRNA-11620.317±0.024

图2 转染siRNA后实时荧光定量PCR检测FAM172A基因的表达
Fig.2 The gene expression ofFAM172Awere tested by Quantitative Real-time PCR after transfection with the siRNA
2.1.2 各组细胞FAM172A蛋白的表达
HUVEC转染pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A48 h后,转染试剂组的表达为1.012±0.028,空白质粒组的表达为1.038±0.033,重组质粒的表达为 2.772±0.010 (表3、图3).HUVEC转染siRNA-NC、siRNA1162 72 h后,转染试剂组的表达为1.000±0.014,siRNA-NC组的表达为0.095±0.023,siRNA1162组的表达为 0.262±0.025(图4、表4).
表3转染质粒DNA后,各组FAM172A蛋白的表达


组别相对光密度vehicle1.012±0.028pcDNA3.1/myc-His(-)1.038±0.033pcDNA3.1/myc-His(-)-FAM172A2.772±0.010
2.2 各组HUVEC细胞增值率比较
2.2.1 CCK-8实验
pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A转染HUVEC 后,连续3d检测细胞在波长450 nm处的吸光度(图5).0 h后,转染试剂组细胞吸光度为0.811±0.083,空白质粒组细胞吸光度为0.749±0.034,重组质粒细胞吸光度为0.743±0.034 5,3组无统计学差异;转染24 h后,转染试剂组细胞吸光度为1.229±0.032,空白质粒组细胞吸光度为1.226±0.039,重组质粒组细胞吸光度为0.995±0.035,3组有统计学差异;HUVEC转染48 h后转染试剂组细胞吸光度为1.446±0.056,空白质粒组细胞吸光度为1.412±0.052,重组质粒组细胞吸光度为1.242±0.160,3组有统计学差异;HUVEC转染72 h后转染试剂组细胞吸光度为1.864±0.019,空白质粒组细胞吸光度为1.897±0.033,重组质粒细胞增值率为1.646±0.024,3组有统计学差异(表5);siRNA-NC、FAM172A-siRNA1162转染HUVEC后,连续3 d检测细胞在波长450 nm处的吸光度(图6). 0 h后,转染试剂组细胞吸光度为0.758±0.016,siRNA-NC组细胞吸光度为0.780±0.072,siRNA1162组细胞吸光度为0.757±0.31,3组无统计学差异;转染24 h后转染试剂组细胞吸光度为1.082±0.007,siRNA-NC细胞吸光度为1.070±0.007,siRNA1162组细胞吸光度为1.137±0.015,3组有统计学差异;转染HUVEC 48 h后转染试剂组细胞吸光度为1.601±0.036,siRNA-NC细胞吸光度为1.578±0.034,siRNA1162组细胞吸光度为1.874±0.153,3组有统计学差异;转染HUVEC 72 h后转染试剂组细胞吸光度为1.894±0.023,siRNA-NC组细胞吸光度为1.838±0.010,siRNA1162组细胞吸光度为2.127±0.070,3组有统计学差异(表6).综上可知,基因FAM172A能够抑制HUVEC的增殖.

图3 转染重组质粒后蛋白免疫印迹检测FAM172A基因的表达
Fig.3 The gene expression ofFAM172Awere tested by western blotting after transfection with the plasmid

图4 转染靶向干扰FAM172A的siRNA后蛋白免疫印迹检测FAM172A蛋白水平
Fig.4 The gene expression of FAM172A were tested by western blotting after transfection with the siRNA targeting FAM172A
表4转染siRNA后,各组FAM172A蛋白的表达


组别相对光密度mock 1.000±0.014siRNA-NC 0.995±0.023siRNA-1162 0.262±0.025

图5 转染质粒后CCK-8细胞增殖实验检测HUVEC的增殖
Fig.5 The proliferation of HUVEC was detected after transfection with the plasmid by CCK-8 assay

图6 转染siRNA后CCK-8细胞增殖实验检测HUVEC的增殖
Fig.6 The proliferation of HUVEC was detected after transfection with the siRNA by CCK-8 assay


组别A(0 h)A(24 h)A(48 h)A(72 h)Vehicle0.811±0.0831.229±0.0321.446±0.0561.864±0.019pcDNA3.1/myc-His(-)0.749±0.0341.226±0.0401.412±0.0521.897±0.033pcDNA3.1/myc-His(-)-FAM1720.733±0.0360.995±0.035 1.242±0.0161.646±0.024

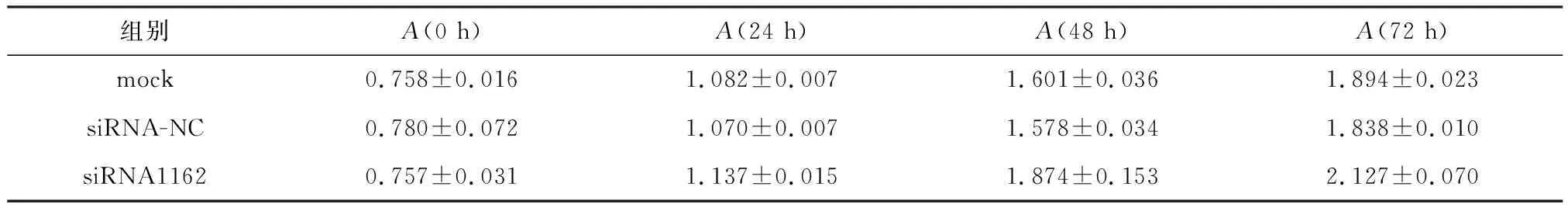
组别A(0 h)A(24 h)A(48 h)A(72 h)mock0.758±0.0161.082±0.0071.601±0.0361.894±0.023siRNA-NC0.780±0.0721.070±0.0071.578±0.0341.838±0.010siRNA11620.757±0.0311.137±0.0151.874±0.1532.127±0.070
2.2.2 EdU实验
pcDNA3.1/myc-His(-)-FAM172A、pcDNA3.1/myc-His(-)siRNA-NC、FAM172A-siRNA1162转染细胞48 h后,EdU细胞增殖实验重组质粒组细胞增值率为(19.5±0.8)%,空白质粒组细胞增值率为(23.4±1.1)%,两组有统计学差异;干扰对照组增值率为(25.3±1.0)%,干扰组细胞增值率为(30.6±0.96)%,两组有统计学差异 (表7、图7).
表7转染质粒DNA及siRNAEdU细胞增殖实验检测HUVEC增殖
Table7TheproliferationofHUVECwasmeasuredaftertransfectionwiththeplasmidandsiRNAbyEdUassay

组别细胞增值率/%pcDNA3.1/myc-His(-)23.4±1.1pcDNA3.1/myc-His(-)-FAM172A19.5±0.8siRNA-NC25.3±1.0SiRNA116230.6±1.0

图7 转染质粒NDA及干扰RNA后EdU细胞增殖实验检测HUVEC增殖
2.3 各组HUVEC细胞凋亡比较
pcDNA3.1/myc-His(-)、pcDNA3.1/myc-His(-)-FAM172A转染HUVEC 24 h后,检测两组细胞凋亡率,即Annexin V阳性率,Q2+Q4的总和.空白质粒组细胞凋亡率为(4.0±0.7)%,重组质粒组细胞凋亡率为(5.8±0.7)%;siRNA-NC、FAM172A-siRNA1162转染HUVEC 48 h后,检测两组细胞凋亡率.siRNA-NC细胞凋亡率为(4.3±0.2)%;siRNA1162细胞凋亡率为(2.4±0.1)%(表8).综上可知基因FAM172A促进HUVEC的凋亡(图8、图9).
表8转染质粒DNA及siRNA细胞后,流式细胞技术检测细胞凋亡

Table 8 The apoptosis of HUVEC was measured after transfection with the plasmid and siRNA by flow cytometry %
Fig.8 The apoptosis of HUVEC was detected by flow cytometry
2.4 各组细胞中NF-κBp65的基因表达
收集上述转染各组细胞,RT-qPCR、Western Blot 检测各转染组NF-κBp65的mRNA及蛋白的表达.RT-qPCR检测结果重组质粒组NF-κBp65mRNA表达比空白质粒组高(1.327±0.037、0.978±0.020,P<0.05,表9、图10),干扰FAM172A组NF-κBp65mRNA表达比阴性对照组低(0.166±0.008、0.980±0.020,P<0.05,表10、图11);Western blot 结果显示重组质粒组NF-κBp65蛋白表达比空白质粒组高(2.034±0.018、1.050±0.044,P<0.05,表11、图12),干扰FAM172A组NF-κBp65蛋白表达比阴性对照组低(0.366±0.006、0.996±0.006,P<0.05,表12、图13).

图9 转染质粒及siRNA后流式细胞技术检测HUVEC凋亡


组别2-ΔΔCTVehicle1.001±0.063pcDNA3.1/myc-His(-)0.978±0.020pcDNA3.1/myc-His(-)-FAM172A1.327±0.037
表10转染FAM172A靶向siRNA后,各组NF-κBp65mRNA的基因表达


组别2-ΔΔCTMock1.000±0.026siRNA-NC 0.980±0.020siRNA-11620.166±0.008

图10 转染质粒后荧光定量PCR检测NF-κBp65mRNA的基因表达
Fig.10 The gene expression ofNF-κBp65mRNAwere detected by Quantitative Real-time PCR after transfection with the plasmid

图11 转染siRNA后实时荧光定量PCR检测NF-κBp65mRNA基因的表达
Fig.11 The gene expression ofNF-κBp65mRNAwere detected by Quantitative Real-time PCR after transfection with the siRNA
表11转染质粒DNA后,各组NF-κBp65蛋白的表达


组别相对光密度vehicle1.000±0.034pcDNA3.1/myc-His(-)1.050±0.044pcDNA3.1/myc-His(-)-FAM172A2.034±0.018
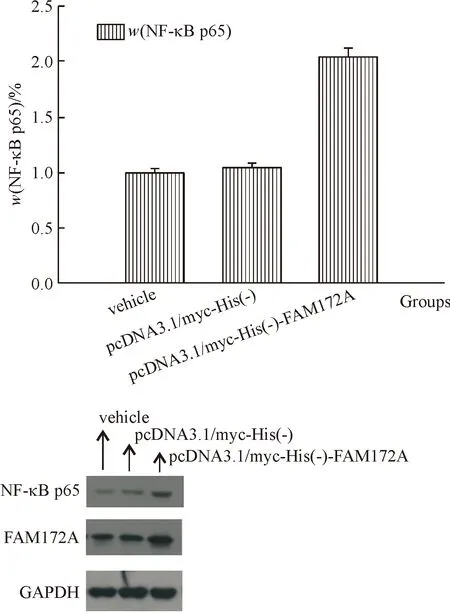
图12 转染质粒后蛋白免疫印迹检测NF-κBp65蛋白的表达
Fig.12 The gene expression of NF-κBp65 protein was detected by western blotting after transfection with the plasmid
表12转染FAM172A靶向siRNA后,各组NF-κBp65蛋白的表达


组别相对光密度mock1.000±0.018siRNA-NC0.996±0.006siRNA-11620.366±0.006

图13 转染FAM172A靶向siRNA后蛋白免疫印迹检测NF-κBp65基因的表达
Fig.13 The gene expression of NF-κBp65 protein was detected by western blotting after transfection with the siRNA targetingFAM172A
3 讨论
本研究采用构建真核基因表达载体以及合成靶向干扰RNA的方法,增加或者干扰FAM172A的表达,初步检测了FAM172A对人脐静脉内皮细胞增殖和凋亡的影响.从实验结果可知FAM172A能够抑制HUVEC的增殖,促进HUVEC的凋亡.内皮位于血液和组织的分界面,正常的内皮细胞除起机械屏障作用和信息传递外,还可通过合成、分泌血管活性物质而调节血管内环境稳态,如保持血管收缩及舒张平衡、抑制SMC增生和迁移、保持血栓形成和纤溶蛋白溶解平衡以及信息传递等.血管内皮细胞的增殖在许多心血管疾病病理生理过程都起着十分重要的作用[12-13].高脂血症、高血压、糖尿病及感染等均可直接或间接作用于血管内皮细胞,引起内皮细胞分泌功能失调,发生一系列反应,如脂质浸润、单核细胞黏附等,此过程中内皮细胞损伤是关键因素.受损内皮由邻近的成熟内皮细胞通过分裂增生来填补.研究表明,内皮细胞的增殖在动脉粥样硬化血管损伤后修复、破裂斑块的稳定中起重要作用.因此,从某种程度上说,FAM172A可能抑制了血管内皮的修复,影响了血管损伤修复.
在探索FAM172A调控HUVEC细胞增殖和凋亡机制时,发现NF-κBp65与FAM172A表达呈正相关.NF-κp65是细胞内重要的核转录因子之一,在不同的组织细胞中的不同刺激条件下,NF-κp65激活可通过调节多种不同靶基因的转录,参与炎症、免疫以及细胞生长凋亡等多种病理生理过程[14-16].大量文献报道NF-κB在调节多种细胞增殖、凋亡过程中具有重要作用.但不同的研究者在NF-κB信号通路的研究中发现对不同细胞、不同刺激条件下NF-κB的激活对细胞增殖凋亡的影响并不一致.而FAM172A调控HUVEC细胞增殖和凋亡的方式可能涉及NF-κB信号通路.李梅芳等[11]研究发现FAM172A可以通过p38蛋白信号传导途径的活化促进甲状腺乳头状瘤细胞增殖,也有研究发现FAM172至少部分通过Notch 3信号传导抑制肝癌细胞周期和细胞增殖[8],表明FAM172A可能通过多个信号通路调控细胞生长.动脉粥样硬化是全球死亡的主要原因,是一种慢性炎症性疾病,通常在动脉粥样硬化形成的起始阶段,炎症发生在血管的最内层血管内皮.发炎的内皮细胞释放促炎介质,如促炎症细胞因子,趋化因子和黏附分子[17-18].而这些促炎症趋化因子的产生由转录因子NF-κB介导,NF-κB是内皮炎症过程中激活的炎性相关信号通路[19-20].因此,FAM172A可能参与NF-κB介导的炎症反应影响HUVEC的增殖与凋亡.当然,为了验证是否正确,必须进行进一步实验.

