荷多糖的提取工艺及其体外抑菌活性研究
黄仁术,汪莹,陈坤,项学伟,徐兴苗


摘要:在单因素实验的基础上,进行3因素3水平的Box-Behnken中心组合实验设计,利用响应面分析优化■荷多糖的最佳提取工艺;对此工艺下的提取液进行浓缩,通过牛津杯法和二倍稀释法探讨其抑菌活性。结果表明:在优化工艺条件处理温度91.67℃、液料比25.0mL/g、处理时间1.5h时,■荷多糖得率为10.15%,与预测值9.94%的相对误差仅2.07%;■荷多糖对大肠杆菌、黑曲霉和酿酒酵母没有体外抑制作用,但对枯草芽孢杆菌和金黄色葡萄球菌有体外抑制作用,其MIC分别为0.4930mg/mL、1.9722mg/mL,MBC分别为1.9722mg/mL、7.8886mg/mL。■荷多糖可作为一种新型抗菌药物开发,其提取工艺可用响应面法进行回归分析和参数优化。
关键词:多糖;■荷;响应面;提取工艺;体外抑菌
项目基金:安徽省高校自然科学研究重点项目(KJ2018A0413);安徽省林业科技攻关团队(2017062);安徽省林业科技攻关计划项目(2018061);安徽省2018年度重点研究与开发计划项目(编号:1804g07020182)
中图分类号: R931.71 文献标识码: A DOI编号: 10.14025/j.cnki.jlny.2018.14.029
■荷(Zingiber mioga (Thunb.) Rosc. ),又名陽荷、茗荷、观音花、莲花姜、野姜等,属药食两用的姜科多年生草本植物,广泛分布我国南方地区。而植物多糖具有抗氧化、抗肿瘤、抗病毒、增强免疫、调节造血功能等多种功效。但目前有关■荷多糖的研究仍比较少见,仅谭志伟等研究了传统的热浸提工艺和提取物的抗氧化性[1,2],陈仕学等研究了微波辅助提取工艺[3],邱岚等研究了超声辅助提取工艺[4],朱培蕾等研究了■荷水溶性多糖的理化性质及其体外抗氧化活性[5]。本文在响应面法优化■荷多糖提取工艺的基础上,对其抗菌活性进行研究,以期为■荷资源的有效开发和新型抗菌药物的获得提供前期基础。
1 材料与方法
1.1 仪器与材料
HH恒温水浴锅(金坛市金城国胜实验仪器厂),SHZ-D循环水真空泵(郑州予华仪器有限公司),H2050R台式高速大容量冷冻离心机(湖南湘仪实验室仪器开发有限公司),ZD-85气浴恒温振荡器(金坛市杰瑞尔有限公司),DHP-9272数显电热培养箱(上海浦东荣丰科学仪器有限公司),YX-450电热蒸汽压力消毒器(上海三申医疗器械有限公司),SW-CJ-1C洁净工作台(苏州安泰空气技术有限公司)等。硫酸、苯酚等均为分析纯(西陇化工股份有限公司)。■荷从大别山区采集。实验菌株包括以枯草芽孢杆菌(Bacillus subtilis)和金黄色葡萄球菌(Staphyloccocus aureus)为代表的革兰阳性细菌,以大肠杆菌(Escherichia coli)为代表的革兰阴性细菌,以黑曲霉(Aspergillus niger)和酿酒酵母(Saccharomyces cerevisiae)为代表的真菌。
1.2 实验方法
1.2.1 ■荷多糖的测定 根据苯酚-硫酸法,设置葡萄糖标准液的浓度梯度,建立其吸光度与葡萄糖质量M(μg)的线性关系,从而计算■荷多糖质量[6]。
1.2.2 确定单因素范围
(1) 处理温度(X1):分别称取3.0g过80目筛的■荷粉末,计5组3个重复共15份;每份用45mL蒸馏水溶于三角瓶后,各组分别置于20℃、40℃、60℃、80℃、100℃的水浴中浸提2h;提取液4000转速离心10min,Sevag法脱蛋白后滤液50mL容量瓶定容;取100uL提取液稀释100倍,稀释提取液,取其1mL按苯酚-硫酸法测定多糖浓度,以确定处理温度。
(2)液料比(X2):同上,按10mL/g的液料比梯度,确定15~45mL/g范围内的液料比。
(3)处理时间(X3):同上,按0.5h的时间梯度,确定1~3h范围内的处理时间。
1.2.3 响应面优化 响应面采用Design-Expert.8.0.6软件设计,处理温度(X1)、液料比(X2)和处理时间(X3)为自变量,■荷多糖提取得率(Y)为响应值。
1.2.4 体外抑菌 纯化供试菌种制成菌悬液备用。■荷多糖浓缩物体外抑菌效果以牛津杯法测定;■荷多糖最低抑菌浓度(MIC)以二倍稀释法测定,对有抑菌效果的二倍稀释液移种到培养基上,根据培养皿中菌落生长情况测定■荷多糖最小杀菌浓度(MBC)[7]。
2 结果与分析
2.1 ■荷多糖的测定
经测定,吸光度A与多糖质量M的线性关系为A=0.007M+0.0038,R=0.9998,相关系数符合国家标准高于0.99的要求,可作为测定依据[8]。
2.2 确定单因素范围
表1 不同处理温度对提取效果的影响
注:dfA=4,dfe=10;SSA=10.5976,SSe=0.9003;Sx=0.1732;**表示组间差异极显著。
2.2.1 处理温度 由表1的SSR法检验可见,在80℃~100℃时,■荷多糖的得率最高,与其他各组差异极显著(P<0.01);但在80℃~100℃之间差异不显著(P>0.01),响应面法可进一步优化筛选此温度范围。考虑能源消耗,确定其他单因素范围时可暂定80℃。
2.2.2 液料比 由表2的SSR法检验可见,随着液料比的进一步提高,■荷多糖的得率极显著降低(P<0.01);但在15~25mL/g时差异不显著(P>0.01),响应面法可进一步于5~25mL/g区间筛选液料比范围,确定其他单因素范围时可暂定液料比为15mL/g。
表2 不同液料比对提取效果的影响
注:dfA=3,dfe=8;SSA=2.2840,SSe=0.8691;Sx=0.1903;**表示组间差异极显著。
2.2.3 处理时间筛选试验 由表3的SSR法检验可见,随着处理时间的增加或减少,■荷多糖得率都会极显著性降低(P<0.01),■荷多糖得率最高时的处理时间为2h,响应面法筛选范围可选择1.5~2.5h区间。
表3 不同处理时间对提取效果的影响
注:dfA=4,dfe=10;SSA=16.2721,SSe=0.6024;Sx=0.1417;**表示组间差异极显著,*表示显著。
2.3 响应面优化
2.3.1 回归方程与统计检验
响应面试验结果见表4,经二次回归分析得模型方程:Y=-44.16144+1.41778X1-0.050725X2-13.3595X3+0.00115X1X2
-0.0485X1X3-0.011X2X3-0.0074925X12+0.0046325X22+4.423X32。
表4 ■荷多糖提取响应面设计试验方案及结果
根据数字模型方差分析结果看(表5):模型的F=33.28、(Prob>F)<0.0001,表明该模型显著而具有统计学意义;模型失拟项(Prob>F)=0.0564>0.05,表明失拟项不显著,实验和模型拟合程度好;模型的相关系数R2=0.9772>0.95,说明模型拟合度好而具有高可信度;变异系数(CV)=4.73%,信噪比22.552>4,表明模型方程能客观反映实验值。可见■荷多糖提取工艺可以凭该模型来预测。在模型方程中,X2偏回归系数显著(P<0.05),说明液料比对■荷多糖提取的效应影响显著。
表5 ■荷多糖提取工艺优化数学模型方差分析
2.3.2 ■荷多糖提取的响应面分析
综合图1、图2、图3可见:随着料液比的增加■荷多糖提取得率提高;随着处理温度的上升■荷多糖提取得率先提高后降低;随着处理时间的延长■荷多糖提取得率先降低后提高。三者之间未见交互效应。
2.3.3 试验验证
经软件优化计算,在处理温度91.67℃、液料比25.0mL/g、处理时间1.5h时,■荷多糖的提取得率最大,达到9.94%。此工艺条件下验证结果证实,■荷多糖实际提取得率10.15%,与预测值相对误差仅2.07%。
2.4 体外抑菌试验
2.4.1 牛津杯法测定■荷多糖抑菌效果
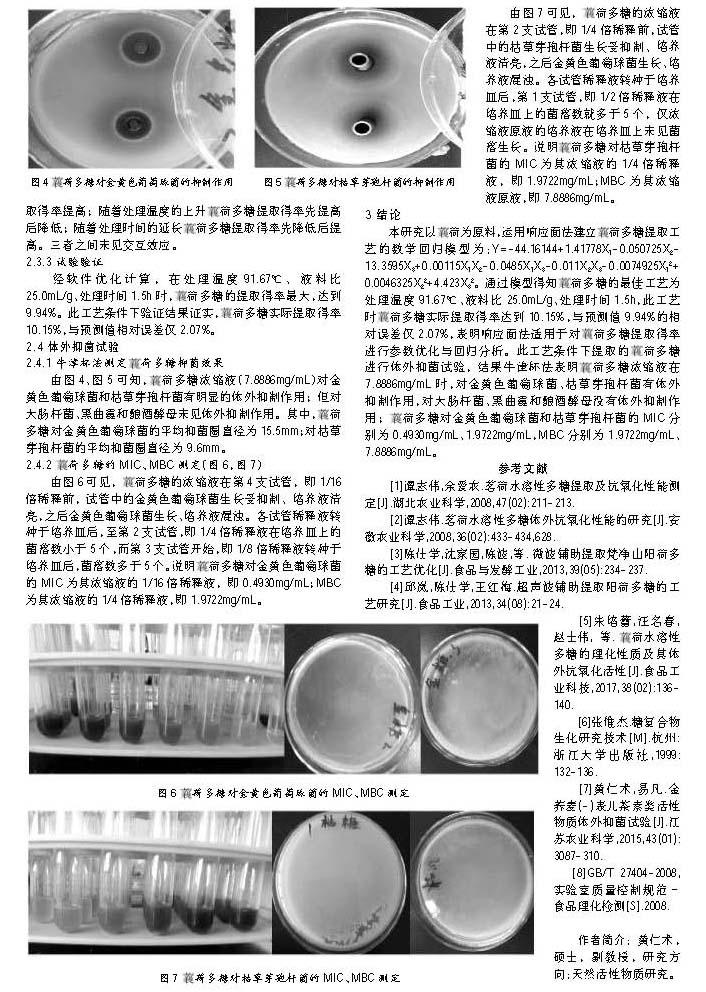
由图4、图5可知,■荷多糖浓缩液(7.8886mg/mL)对金黄色葡萄球菌和枯草芽孢杆菌有明显的体外抑制作用;但对大肠杆菌、黑曲霉和酿酒酵母未见体外抑制作用。其中,■荷多糖对金黄色葡萄球菌的平均抑菌圈直径为15.5mm;对枯草芽孢杆菌的平均抑菌圈直径为9.6mm。
2.4.2 ■荷多糖的MIC、MBC测定(图6,图7)
由图6可见,■荷多糖的浓缩液在第4支试管,即1/16倍稀释前,试管中的金黄色葡萄球菌生长受抑制、培养液清亮,之后金黄色葡萄球菌生长、培养液混浊。各试管稀释液转种于培养皿后,至第2支试管,即1/4倍稀释液在培养皿上的菌落数小于5个,而第3支试管开始,即1/8倍稀释液转种于培养皿后,菌落数多于5个。说明■荷多糖对金黄色葡萄球菌的MIC为其浓缩液的1/16倍稀释液,即0.4930mg/mL;MBC为其浓缩液的1/4倍稀释液,即1.9722mg/mL。
由图7可见,■荷多糖的浓缩液在第2支试管,即1/4倍稀释前,试管中的枯草芽孢杆菌生长受抑制、培养液清亮,之后金黄色葡萄球菌生长、培养液混浊。各试管稀释液转种于培养皿后,第1支试管,即1/2倍稀释液在培养皿上的菌落數就多于5个,仅浓缩液原液的培养液在培养皿上未见菌落生长。说明■荷多糖对枯草芽孢杆菌的MIC为其浓缩液的1/4倍稀释液,即1.9722mg/mL;MBC为其浓缩液原液,即7.8886mg/mL。
3 结论
本研究以■荷为原料,运用响应面法建立■荷多糖提取工艺的数学回归模型为:Y=-44.16144+1.41778X1-0.050725X2-
13.3595X3+0.00115X1X2-0.0485X1X3-0.011X2X3-0.0074925X12+
0.0046325X22+4.423X32。通过模型得知■荷多糖的最佳工艺为处理温度91.67℃、液料比25.0mL/g、处理时间1.5h,此工艺时■荷多糖实际提取得率达到10.15%,与预测值9.94%的相对误差仅2.07%,表明响应面法适用于对■荷多糖提取得率进行参数优化与回归分析。此工艺条件下提取的■荷多糖进行体外抑菌试验,结果牛津杯法表明■荷多糖浓缩液在7.8886mg/mL时,对金黄色葡萄球菌、枯草芽孢杆菌有体外抑制作用,对大肠杆菌、黑曲霉和酿酒酵母没有体外抑制作用;■荷多糖对金黄色葡萄球菌和枯草芽孢杆菌的MIC分别为0.4930mg/mL、1.9722mg/mL,MBC分别为1.9722mg/mL、7.8886mg/mL。
参考文献
[1]谭志伟,余爱农.茗荷水溶性多糖提取及抗氧化性能测定[J].湖北农业科学,2008,47(02):211-213.
[2]谭志伟.茗荷水溶性多糖体外抗氧化性能的研究[J].安徽农业科学,2008,36(02):433-434,628.
[3]陈仕学,沈家国,陈波,等. 微波辅助提取梵净山阳荷多糖的工艺优化[J].食品与发酵工业,2013,39(05):234-237.
[4]邱岚,陈仕学,王红梅.超声波辅助提取阳荷多糖的工艺研究[J].食品工业,2013,34(08):21-24.
[5]朱培蕾,汪名春,赵士伟,等. ■荷水溶性多糖的理化性质及其体外抗氧化活性[J].食品工业科技,2017,38(02):136-140.
[6]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:132-136.
[7]黄仁术,易凡.金荞麦(-)表儿茶素类活性物质体外抑菌试验[J].江苏农业科学,2015,43(01):3087-310.
[8]GB/T 27404-2008,实验室质量控制规范-食品理化检测[S].2008.
作者简介:黄仁术,硕士,副教授,研究方向:天然活性物质研究。

