超声引导穿刺活检诊断腹膜后纤维化
陈胜江 ,尚智伟,刘一靖,谢瑜娟,朱建平,张 强,赵小利,王运昌
(1.河南科技大学临床医学院 河南科技大学第一附属医院,河南 洛阳 471000;2.长治医学院附属和平医院影像科,山西 长治 046000;3.首都医科大学附属天坛医院超声科,北京 100050)
腹膜后纤维化(Retroperitoneal fibrosis,RPF)作为一种临床少见病其病因复杂,Ormond将其归纳为7种常见原因:即外伤、炎症、尿外渗、恶性肿瘤、药物、放疗和原发性[1]。因患者症状体征和实验室检查均缺乏特异性,以往多依赖超声、CT等影像学检查,但尚不能提供病理依据,故该病术前确诊困难[2-3]。近年来有学者提出穿刺活检是术前确诊RPF的可靠手段[4]。本研究对影像学检查初诊为RPF的患者行超声引导下经皮腹膜后穿刺活检,目的在于探讨利用超声引导穿刺活检术在该病诊断的应用价值。
1 资料与方法
1.1 研究对象
选择2003年1月—2014年9月期间在我院风湿免疫科、普外科及肿瘤中心住院,经CT、MRI或超声等影像学检查发现不明原因的腹膜后异常包块而初步诊断为RPF的患者共47例作为研究对象,其中男 26例,女 21例,年龄 31~70岁,平均(56.5±10.7)岁。患者首诊主诉分别为体检发现腹部包块38例,腰背部不适35例,消瘦乏力34例,肾积水28例,下肢浮肿11例,腰腹部疼痛6例。47例患者中红细胞沉降率(ESR)增快35例,C反应蛋白(CRP)升高45例。首诊主诉或症状发现时间0.5~65.3月,平均(8±3.2)月。所有患者术前血常规、凝血功能无异常,无严重病理性心电图改变。
1.2 研究方法
对初诊RPF的47例患者行腹膜后彩超检查并引导穿刺活检,要求患者空腹12小时以上,仰卧位,必要时侧卧位。采用GE vivid I(通用医疗以色列有限公司,提拉卡梅尔,以色列)彩超系统及穿刺架引导,Bard全自动活检枪(巴德外周血管公司,亚利桑那州坦佩,美国)及18G活检针(Argon医疗设备公司,盖恩斯维尔,美国)。
穿刺前核查患者心电图、血小板、凝血功能,超声探查腹膜后病灶并确定理想穿刺针路。探查范围自胰腺向下至双侧髂窝,观察病灶形态、回声、分布位置及Adler血流分级[5]。以肾动脉起始部以上的腹膜后间隙定义为A水平,肾动脉起始部以下的腹膜后间隙为B水平。Adler血流分级标准:0级指病灶内未发现血流信号;Ⅰ级为少量血流,可见1~2个点状或细棒状肿瘤血管;Ⅱ级为中量血流,可见3~4个点状血管或一个较长的血管穿入病灶,其长度可接近或超过肿块半径;Ⅲ级为多量血流,可见≥5个点状血管或2个较长血管。
选择厚度超过25mm且实性部分病灶为穿刺目标,选择前方无肠管和血管的理想穿刺路径设置引导线角度,体表定位,碘伏消毒皮肤,铺无菌洞巾,进针点2%盐酸利多卡因5mL局部皮下浸润麻醉,设置Bard活检枪切割长度为15~22mm,用穿刺架引导从前腹壁或侧腰部进针。进针时实时观察穿刺针,避免损伤腹主动脉、下腔静脉等大血管和肾脏、输尿管及胰腺等重要脏器。当穿刺针尖进入病灶2~5mm时,扣动自动活检枪扳机,激发切割针,按原针路方向拔针,每次拔针后应观察穿刺针完整性。依不同角度穿刺2~3针,至获得满意标本。穿刺结束离开前超声观察进针路径有无出血,周边血管、重要脏器是否损伤,穿刺后次日再次复查。穿刺获得组织条用无水酒精固定后送病理学检查。对超声未获得理想穿刺针路、不宜穿刺活检的患者,行外科直视手术探查,大体标本福尔马林固定后送病理检查。标本固定、切片,HE染色镜下观察。
1.3 分析方法
分析穿刺可行性和成功率,对穿刺术中超声特征行回顾性分析,应用SPSS 18.0软件包进行统计分析,以病理结果为最终确诊依据并分组,组间计数资料比较采用卡方检验,检验水准α=0.05。
2 结果
2.1 成功率与检出率
全部47例患者术前对超声引导穿刺活检主观接受率为100%,最终行腹部超声并穿刺活检者共42例,占89.4%。5例因肥胖、消化道气体干扰、进针路径难以避开血管或重要脏器等因素而不宜超声引导穿刺,最终行外科手术探查。所有患者最终经病理证实32例为RPF,其中经超声引导穿刺活检确诊30例,占93.7%。应用该方法排除12例,分别为淋巴瘤8例、脂肪肉瘤2例,巨大淋巴结增生症2例。探查确诊RPF 2例,腹膜后血肿2例,腹主动脉夹层动脉瘤1例。
2.2 穿刺不良反应
本组超声引导下腹膜后穿刺42例中,无1例严重并发症。仅5例术中诉轻微一过性疼痛,2例术前短暂性心律失常,休息后消失。1例穿刺术后次日腹膜后穿刺部位旁探及范围约3.7 cm×2.6 cm×2.1 cm的积血区,彩色多普勒显示无动态血流束,连续观察2日无增多,未行特殊处理,1周后消失。
2.3 术中超声所见
超声引导穿刺活检确诊的30例RPF患者中27例声像图表现为腹膜后范围不等、包绕血管和输尿管的不规则片状或条带状回声的包块(图1,2),局部可见钙化及声影。包块自上而下有较完整连续性,自腹主动脉向两侧延伸,纵切面前后径小于上下径,横切面前后径小于左右径。以肾动脉起始部分界,RPF与非RPF患者病灶分布范围差异有显著统计学意义,P<0.01。腹膜后病灶内部血流Adler分级比较,RPF与非RPF患者病灶分布范围差异有统计学意义,P<0.05。见表 1。

表1 RPF与非RPF病灶分布范围、Adler血流分级比较
2.4 病理表现
穿刺组织条大体观为连续灰白色组织。镜下表现为慢性炎症反应,可见大量的纤维组织,部分伴有钙化,伴有淋巴细胞、浆细胞、巨噬细胞、嗜酸性粒细胞等炎症细胞的浸润。8例伴纤维性玻璃样改变,胶原样物质增厚。见图3。
3 讨论
RPF临床上可有腹膜后脏器、血管、淋巴组织、神经组织等受压引起的多样继发性不典型症状,如腹部、腰部或背部疼痛,下肢水肿等,或伴低热、纳差、消瘦、乏力、尿少、便秘等全身症状[6]。实验室检查常见ESR加快、CRP、铁蛋白、免疫球蛋白水平增高等炎症反应相关表现,但和临床症状一样都缺乏特异性[7],因此该病术前临床确诊困难。虽然国内外学者利用CT、MRI、PET-CT等影像学技术研究RPF患者腹部影像学表现,提高了该病的术前诊断率,但由于设备昂贵、检查费用高、放射线危害等诸多原因,不宜作为该病的首选检查方法[8-9]。且因单纯影像学检查不能获得病理标本,其误诊率仍较高。本组47例患者经影像学检查均初步诊断为RPF,最终确诊32例,误诊率达31.9%。

图1 男,59岁,腹主动脉(AO)被周围中等回声纤维化组织(RPF)包绕。 图2 与图1同一患者,髂血管(A、V)被纤维化组织(RPF)包绕。Figure 1.A male patient aged 59,whose abdominal aorta(AO)is surrounded by moderately hypoechoic fibrous tissues(RPF).Figure 2.The same patient with Figure 1,the iliac vessels(A,V)are surrounded by fibrous tissues(RPF).
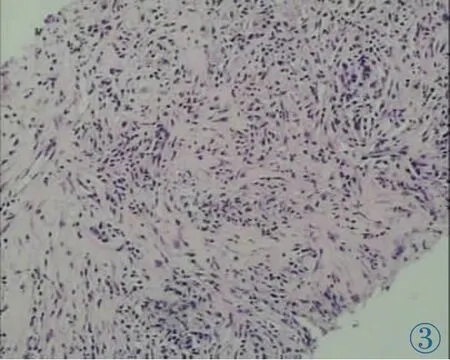
图3 与图1、图2同一患者腹膜后包块穿刺组织条镜下观(HE染色),显示成纤维细胞弥漫分布,轻度胶原化,小血管增生显著,周边大量炎细胞浸润,包括淋巴细胞、浆细胞、吞噬细胞等。Figure 3.The same patient with Figure 1 and 2,the biopsy tissue of retroperitoneal mass under microscope(HE stained)shows fibroblast diffuse distribution,mild collagen,small peripheral vascular hyperplasia,with infiltration of a large number of inflammatory cells in the surrounding area,including lymphocytes,plasma cells,phagocytic cells etc.
超声检查作为一种各级医院普遍开展的常规检查技术,无辐射、廉价便捷、图像质量好、可重复性好、能动态显示血流等优点,近年来在该病的诊断及后期随访中的应用越来越受到临床医师的重视[10]。而超声引导下的腹膜后穿刺活检术能获得病理标本,在腹部各种实质性病变的术前诊断有着较高的应用价值[11]。本组47例患者中42例超声引导下均一次穿刺活检成功,未出现严重并发症。1例术后穿刺部位少量出血,1周后自行吸收。2例短暂性心律失常和5例术中轻微疼痛,给予心理安抚并休息片刻后缓解,均未需特殊处理。仅5例较肥胖、气体干扰严重、无理想进针路径的患者未能行超声引导穿刺活检术。最终术前经腹部超声结合超声引导下腹膜后穿刺活检确诊的30例,占全部32例RPF患者的93.7%。本组研究显示超声引导下对RPF病灶穿刺活检能实时监测进针位置及深度,具有操作简便、定位精准、安全性好、成功率高等特点,与单纯影像学检查相比有着明显的优势对术前诊断该病具有重要帮助[12]。
本组患者超声引导穿刺术中观察RPF病灶的特征性超声表现为:腹膜后包绕腹主动脉、下腔静脉及输尿管等的以实性为主的不规则等回声团,与被包裹结构分界较清晰。病灶呈片状或条索状贴附于腹膜后,上下连续性较完整,以腹主动脉为中心向两侧延伸[10]。RPF病灶压迫腹膜后管状结构时可致其出现节段性对称性轻度狭窄,不引起移位和偏心性狭窄。另本研究结果显示RPF和其它腹膜后病变在病灶分布范围及内部血流丰富程度方面差异性有统计学意义,P<0.05,显示与非腹膜后纤维化相比,RPF病灶出现位置较低,以肾动脉起始水平以下为主,且血流信号不丰富,以Adler分级(0+Ⅰ)级为主,即大多患者腹膜后病灶无血流信号显示或仅显示散在点状血流信号[5]。
本研究显示,超声引导下腹膜后穿刺活检不仅能根据病灶形态、部位、血流信号等声像图特征进行形态学和血流动力学的判断,更能方便、安全地对病灶进行穿刺活检,将RPF的术前诊断从影像学提升到病理学的高度。同时需注意以下几点:①RPF的声像图表现要根据病灶位置、回声及Adler血流分级与腹膜后肿瘤、转移性淋巴结及淋巴瘤等鉴别,前者多呈片状或条索状,结节状较少见,较少引起腹膜后管道结构的移位,内部血流信号不丰富;根据病灶是否包绕以小肠为主的腹腔脏器与腹茧症相鉴别[13];观察腹膜后大血管、输尿管管壁结构及走行排除动脉瘤、动脉炎[14-15],RPF则多为血管浆膜层外周对称分布,不引起管腔扩张及血流状态的改变。②穿刺前常规行血常规、凝血功能等实验室检查,术前半小时内检查心电图,发现严重器质性异常者及时纠正后方可行穿刺活检术,同时要注意安抚患者紧张情绪。③术前应扩大超声扫查范围以选择最佳穿刺部位,穿刺进针时须实时观察屏幕中进针深度和角度,开启彩色多普勒血流显像模式以避免损伤血管。穿刺拔针后应观察针尖、针槽有无断损,手术结束后观察穿刺路径及周边有无出血。④随着进针深度的加大,穿刺针可能会出现一定角度的偏差,故穿刺时应嘱患者闭气后快速进针。确保针尖前方病灶深度大于设置的切割长度后,方可扣动自动活检枪扳机完成切割活检。⑤太过肥胖、肠气干扰严重或穿刺针路无法避开消化道、大血管及腹膜后其它重要脏器的疑似RPF患者,不宜行超声引导穿刺活检。⑥对伴较丰富小血管增生的纤维化病灶穿刺时,可能引起少量出血,多能自行吸收,术后应注意随访观察。
综上,超声引导下穿刺活检对RPF的术前诊断具有其它影像学方法不可替代的优势,值得临床推广。

