睾酮对慢性肾功能衰竭大鼠肾性贫血的影响及其作用机制
谢万祥,黄金平
(湖北医药学院附属随州医院肾内科,湖北 随州 441300)
肾性贫血是慢性肾脏病(chronic kidney disease,CKD)最常见的并发症之一,几乎所有CKD 5期的患者均伴有不同程度的贫血。肾性贫血不仅严重影响尿毒症患者生存质量,而且增加心脑血管事件的发病率,进而影响CKD患者预后[1]。肾性贫血的主要原因是肾脏促红细胞生成素(EPO)不足和造血原料缺乏[2]。随着重组人促红细胞生成素(rh EPO)的问世,大大改善了肾性贫血的纠正效果,几乎终结了肾性贫血患者需要依赖异体输血维持正常生理机能需求的治疗方案。
但随着rhEPO的普及,相关研究表明:约25%的透析患者使用常规剂量的EPO难以纠正贫血或需加大EPO的使用剂量(>200 IU·kg-1·week-1)才能维持目标血红蛋白值,这一类患者称为EPO抵抗[3]。发生EPO抵抗的原因复杂且至今未明,自身体内EPO抗体的形成、骨髓红系祖细胞表面的 EPO 受体(EPO receptor)功能紊乱,以及体内微炎症状态、铁剂的缺乏均参与其中。而睾酮作为雄激素的主要成分,其受体广泛分布于生殖系统、肌肉、皮肤、骨骼、心血管系统等。就造血而言,睾酮可通过刺激特定的核受体单元提高红细胞增殖和集落形成单位刺激红细胞的生成[4],对再障性贫血,顽固性贫血具有一定疗效,但国内外尚未见睾酮对肾性贫血影响及其作用机制的研究。基于此,本研究自2015年10月至2016年10月观察睾酮干预慢性肾功能衰竭大鼠后贫血纠正的疗效,旨在发现治疗肾性贫血的新途径。
1 材料与方法
1.1材料
1.1.1仪器 Olympus公司双量程电子天平(北京赛多利斯有限公司),电子恒温水浴锅(金坛市恒磊实验仪器厂),低温超速离心机(美国Beckman公司),垂直电泳槽(北京六一仪器厂),移液器(德国Eppendorf Easypet公司),全自动血液分析仪(美国Beckman公司)。
1.1.2药品与试剂 丙酸睾酮注射液(上海通用药业股份有限公司),蛋白裂解液(美国BD, Biosciences),聚丙烯酰胺(SDS-PAGE)预制胶(Novex,san diego,CA),EPO抗体(美国R&D Systems公司),Marker(美国Fermentas公司),anti-hepcidin(美国Bioss公司),Hepcidin-Elisa(瑞士Bachen公司)。
1.1.3细胞与动物 24只SPF级Wistar雄性大鼠,质量200~220 g,购于武汉大学实验动物中心,动物许可证:HBDW 201504-3。
1.2方法
1.2.1模型制备及分组 24只雄性大鼠经适应性饲养1周后,随机单位组设计组法分为对照组(NC)、正常大鼠睾酮干预组(NT)、慢性肾功能衰竭大鼠组(CD)、慢性肾功能衰竭大鼠睾酮治疗组(CT)。每组6只。CD组、CT组大鼠给予腺嘌呤饲料(腺嘌呤含量0.75%),NC组、NT组给予标准颗粒饲料。4周后CD组,CT组大鼠尾静脉采血检测血肌酐、血尿素氮判断是否造模成功。造模成功后,NT组、CT组大鼠给予皮下注射丙酸睾酮(1 mg/100 μL芝麻油,每周2次),NC组、CK组给予皮下注射芝麻油100 μL,每周2次,治疗4周。
1.2.2标本收集及研究方法 干预4周后麻醉处死大鼠,心脏采血,留取血标本,留取肾脏、肝脏及十二指肠保存于-80 ℃冰箱用于下一步检测。

2 结果
2.1大鼠一般情况及贫血相关指标比较四组大鼠体质量的基线水平差异无统计学意义,使用嘌呤饲料造模后,CD组、CT组大鼠生长较NC组NT组迟缓,出现体质量减轻,活动减少,精神萎靡,动作迟缓,毛发粗糙进食饮水及尿量明显增多等症状,所有大鼠均未见死亡。处死大鼠血液检测显示:与正常组大鼠相比, CD组大鼠血红蛋白(Hb)红细胞计数(RBC),血清铁(SI),总铁蛋白结合力(TIBC)明显下降,呈现小细胞低色素贫血,缺铁性贫血,使用睾酮治疗后,上述指标均显著提升,大鼠贫血状态纠正。见表1。
2.2大鼠肾脏病理NC组、NT组肾脏病理未见明显异常,CD组可见轻到中度肾脏损害,表现为较正常组相比可见肾小管上皮细胞肥大、炎性细胞浸润、肾小管管腔扩张且不规则等表现,而CT组病变表现轻于CD组,仅见炎症细胞浸润。见图1。
2.3大鼠肾脏组织中EPO表达NC组、 NT组、 CD组、CT组大鼠肾脏中EPO的水平分别为(184.321±27.679)、(188.582±15.374)、(142.701±12.249)、(166.322±21.580) μg·g-1,CD组大鼠肾脏EPO表达显著低于正常大鼠,经丙酸睾酮治疗后EPO表达明显增加(P=0.013),差异有统计学意义。免疫蛋白印迹显示:与对照组大鼠相比,CD组大鼠肾脏组织中EPO表达显著减少,使用睾酮干预后,NT组较NC组相比EPO表达变化不显著,但CT组较CD组大鼠肾脏内EPO表达水平明显增多。见图2。

组别鼠数Hb/g·L-1RBC/106·mm-2HTC/%SI/mg·L-1TIBC/mg·L-1NC组6131.2±15.56.23±1.2241.33±5.724.82±1.038.27±2.33NT组6142.5±21.76.98±1.3747.23±5.895.36±1.228.50±3.21CD组6106.1±23.44.95±2.1426.31±6.283.57±1.145.87±3.04CT组6121.9±19.6a5.33±2.26a32.30±7.64a4.13±1.60a6.62±3.36aF值678.20266.53178.62156.23231.54P值0.000.000.000.000.00
注:与CD组比较,aP<0.05
2.4大鼠肝脏组织中铁调素的表达免疫蛋白印迹显示:与对照组大鼠相比,CD组大鼠肝脏组织中铁调素表达显著显著增多,使用睾酮干预后,NT组较NC组,CT组较CD组大鼠肝脏内铁调素表达水平明显下调。见图3。
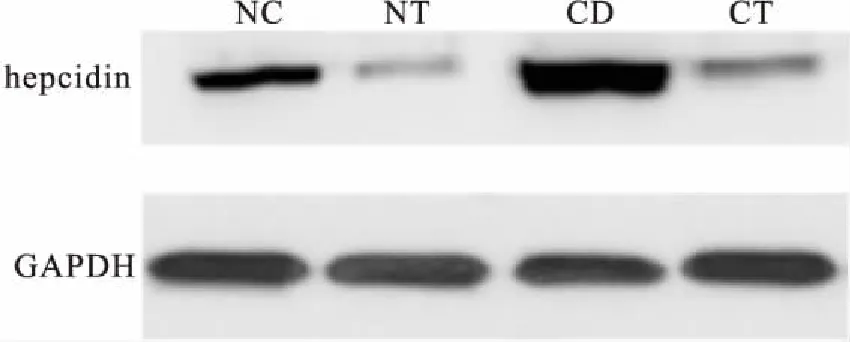
图3 免疫蛋白印迹显示4组大鼠肝脏组织中铁调素表达情况
3 讨论
肾性贫血是慢性肾衰竭患者最常见的并发症,随着慢性肾衰竭的进展,贫血发生率,严重程度逐步上升。一项纳入12 077例成年慢性肾脏病患者的研究[5]表明,在美国CKD1期患者肾性贫血的发病率为8.4%,而同人群CKD5期患者肾性贫血的发病率达53.4%。肾性贫血不仅严重影响患者生活质量,而且增加心血管疾病的发生率和死亡率。
肾性贫血的主要原因是EPO不足和造血原料(铁)缺乏[5]。EPO是哺乳动物调节红细胞生成的主要因子,90%由肾脏合成,促进骨髓红系祖细胞生长、增殖、分化和成熟[6]。随着慢性肾衰竭的进展,肾单位逐渐减少导致EPO合成减少。于此同时肾衰竭患者体内铁代谢发生紊乱,相关研究表明,透析患者每年经慢性出血、透析丢失等途径损失的铁达1~3 g[7]。维持全身铁平衡最主要的激素是铁调素(hepcidin),铁调素由肝脏合成入血,通过结合铁输出细胞上膜铁转运蛋白,进而导致铁既不能从小肠上皮细胞转运入血,也不能从网状内皮系统中释放而被再利用,最终抑制铁剂的吸收[8]。
正常人体内睾酮主要由男性睾丸或女性卵巢分泌,全身多器官组织均存在雄激素受体。Jill等[9]研究表明,在老年贫血患者中,血红蛋白水平下降与睾酮下降水平相一致。而对于肾性贫血的患者,即使调整EPO达相同水平,低睾酮水平状态下肾性贫血仍不能纠正。近年来雄激素及其相关衍生物如司坦唑醇、十一酸睾酮已经开始用于治疗慢性再生障碍性贫血等一些血液系统疾病,并取得了较好的疗效。那么不由假设,提升慢性肾衰竭患者体内睾酮水平是否可以纠正肾性贫血?由此我们课题组设计了该实验。
本次实验结果证实:睾酮可提升慢性肾脏病肾性贫血大鼠体内血清铁含量,升高血红蛋白值,纠正贫血。同时可降低大鼠肝脏内铁调素水平,升高肾脏内EPO水平。睾酮纠正贫血的机制可能与降低铁调素进而增加肠道铁的吸收与利用,同时升高EPO增加红细胞合成相关。
迄今为止国内外尚未见睾酮对肾性贫血影响及其作用机制的研究,因此本研究使用腺嘌呤诱导CRF大鼠模型,研究睾酮对肾性贫血的影响,并对肝肾组织中铁调素,EPO表达水平进行测定,旨在阐明睾酮治疗肾性贫血的可能机制,具备一定创新性,为肾性贫血的治疗打开新的思路。但本研究尚未研究不同性别大鼠对睾酮干预的影响,及使用睾酮治疗后相关副作用等一些重要的问题,拟在今后的实验中进一步研究。
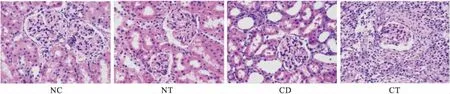
注:NC为对照组;NT为正常大鼠睾酮干预组;CD为慢性肾功能衰竭大鼠组;CT为慢性肾功能衰竭大鼠睾酮治疗组
图1四组大鼠肾脏病理典型图片(HE×400)

