硼替佐米对伯基特淋巴瘤Raji细胞凋亡的影响
李靖,闫明明
(1.洛阳职业技术学院药检系,河南 洛阳 471002;2. 河南科技大学第一附属医院肿瘤科,河南 洛阳 471002)
伯基特淋巴瘤(Burkitt lymphoma, BL),属于B淋巴细胞性的非霍奇金淋巴瘤(NHL),常发于儿童和青少年,很少在中年人群中发现[1]。70%~80%高速增殖的伯基特淋巴瘤发生染色体易位[2],染色体易位导致致癌基因和c-Myc基因过表达以及组成性激活,导致细胞形状转化,细胞增殖失控[3]。目前,伯基特淋巴瘤化疗包括环磷酰胺、阿霉素、长春新碱、阿糖胞苷和利妥昔单抗针对性治疗,虽然在儿童患者中取得了一定的治疗效果,然而对青少年患者来说依然存在预后较差现象[4-5]。因此需要有更有效的化疗药物提高伯基特淋巴瘤的治疗效果。
异常NF-κB激活以及促增殖以及抗凋亡基因的高表达,是多种恶性淋巴瘤主要特征之一,如霍奇金淋巴瘤[6]、弥漫性大B细胞淋巴瘤[7]和伯基特淋巴瘤[8]。有研究证实,NF-κB参与调控B、T淋巴瘤细胞增殖基因cyclin D1、c-Myc和抗凋亡基因(Bcl-2, Bcl-xL)激活,且与淋巴细胞发生、发展和增殖相关[9]。而c-Myc可以通过NF-κB信号途径抑制免疫系统导致伯基特淋巴瘤免疫缺陷[10]。这些研究暗示以NF-κB为靶标的药物可能用于治疗伯基特淋巴瘤。
硼替佐米(bortezomib,BZ)是FDA第一个批准的蛋白酶体抑制剂,可以通过抑制IκBα降解,进而抑制转录因子NF-κB的激活和转位,可以用于套细胞淋巴瘤和多发性骨髓瘤的治疗[11-12]。然而硼替佐米治疗伯基特淋巴瘤的作用和机制尚未完全明了。因此,笔者从2016年6—12月研究硼替佐米对人伯基特淋巴瘤细胞株Raji细胞凋亡的影响及其可能的机制。
1 材料与方法
1.1主要试剂人伯基特淋巴瘤细胞株Raji细胞购自美国标准菌库(American Type Culture Collection,ATCC);RPMI-1640培养基购自美国Sigma公司;胎牛血清(FBS)购自美国Invitrogen公司;硼替佐米购自美国Milennium公司,用无菌生理盐水配置成1 mmol·L-1母液备用;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基公司;NF-κB p65、p-NF-κB p65、caspase 3、cleaved-caspase 3和GAPDH抗体均购自美国Santa Cruze公司,抗兔和抗鼠二抗购自江苏碧云天生物研究所。
1.2细胞培养人伯基特淋巴瘤细胞株Raji细胞培养于37 ℃、含有5%二氧化碳(CO2)饱和湿度培养箱中,其培养基是含有10% FBS的RPMI-1640培养基,并且向培养基加入青霉素-链霉素双抗,每3天换液一次。
1.3MTT实验将对数期Raji细胞以每毫升1×104个的密度接种于96孔板中,设置空白对照孔,细胞分为两组。一组以终浓度(5、10、20和50 nmol·L-1)硼替佐米于37 ℃、含有5% CO2饱和湿度培养箱中共同孵育24 h,每个浓度设4个复孔;另外一组是用终浓度10 nmol·L-1硼替佐米与Raji细胞于37 ℃、含有5% CO2饱和湿度培养箱中分别孵育24、48和72 h,每个时间点设4个复孔。在预定检测时间点后,每孔加入20 μL MTT工作液,在培养箱内继续培养4 h,吸出培养基,加入200 μL DMSO,摇床震荡10 min充分溶解结晶物,酶标仪(ELX800,Bio-TEK,USA)检测其波长570 nm处检测OD值,实验重复3次,计算细胞活力=(对照组OD值-实验组OD值)/(对照组OD值-空白对照组OD值)×100%。
1.4AnnexinV-FITC/PI双染实验取对数期Raji细胞,按照每毫升1×106个的密度接种于6孔板中,细胞分为两组。一组以终浓度(5、10、20和50 nmol·L-1)硼替佐米于37 ℃、含有5% CO2饱和湿度培养箱中共同孵育24 h;另外一组是用终浓度10 nmol·L-1硼替佐米与Raji细胞于37 ℃、含有5% CO2饱和湿度培养箱中分别孵育24、48和72 h。在预定检测时间点后,离心收集细胞(600×g·min-1离心5 min,并用冰PBS重悬2次)。用500 μL binding buffer重悬细胞,并加入5 μL Annexin V-FITC试剂避光孵育10 min,然后加入PI试剂避光孵育5 min。流式细胞仪(CytoFLEX,Beckman,USA)收集细胞,在激发光波长488 nm、发射光波长530 nm条件下分析细胞凋亡比例。
1.5Westernblotting实验对数期Raji细胞以每毫升1×106个的密度接种于6孔板中,细胞分为两组。一组以终浓度(5、10、20和50 nmol·L-1)硼替佐米于37 ℃、含有5% CO2饱和湿度培养箱中共同孵育24 h;另外一组是用终浓度10 nmol·L-1硼替佐米与Raji细胞于37 ℃、含有5% CO2饱和湿度培养箱中分别孵育24、48和72 h。在预定检测时间点后,离心收集细胞(3 000×g·min-1离心5 min,并用冰PBS重悬2次),加入细胞裂解液RIPA(其中含有蛋白酶抑制剂1 ∶1 000),冰上裂解30 min,收集蛋白。离心(4 ℃,12 000×g·min-1)15 min。BCA蛋白定量试剂盒定量后调整各组蛋白上样总量至30 μg。SDS-聚丙烯酰胺凝胶电泳分离蛋白,电转到PVDF上。室温5%牛奶封闭1 h,加入一抗NF-κB p65抗体(1 ∶2 000稀释)、p-NF-κB p65抗体(1 ∶2 000稀释)、caspase-3(1 ∶4 000稀释)、cleaved-caspase-3(1 ∶1 000稀释)和GAPDH抗体(1 ∶5 000稀释),室温育2 h,TBST洗PVDF膜3次,每次洗膜5 min,室温孵育相应比例的二抗1 h,TBST洗PVDF膜3次,每次洗膜10 min。暗室采用ECL化学发光法显影。以GAPDH为内参,ImageJ软件分析目的条带灰度值。

2 结果
2.1硼替佐米抑制Raji细胞活力本实验选择MTT法检测硼替佐米对Raji细胞活力的影响。如图1A所示,分别给予5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,细胞活力分别为:80.6%±9.5%、65.4%±7.5%、51.3%±7.2%、40.8%±3.2%,与对照组(100.0%±0.0%)相比,硼替佐米浓度依赖性抑制Raji细胞活力(P<0.05);如图1B所示,10 nmol·L-1硼替佐米分别处理Raji细胞24、48和72 h后,细胞活力分别为:65.4%±7.5%、50.1%±3.2%、36.4%±1.8%,与对照组(100.0%±0.0%)相比,硼替佐米可时间依赖性抑制Raji细胞活力(P<0.05)。
2.2硼替佐米诱导Raji细胞凋亡本研究进一步采用选择Annexin V-FITC /PI双染流式细胞检测硼替佐米对Raji细胞凋亡的影响。如图2A所示,分别给予5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,细胞早期凋亡分别为:6.2%±0.7%、9.2%±1.0%、13.1%±1.5%、19.4%±2.2%,细胞晚期凋亡分别为:7.8%±0.8%、14.8%±1.6%、16.5%±2.1%、28.2%±3.1%,与对照组早期凋亡(1.6%±0.2%)与晚期凋亡(2.2%±0.2%)相比,硼替佐米浓度依赖性促进Raji细胞凋亡(P<0.05);如图2B所示,10 nmol·L-1硼替佐米分别处理Raji细胞24、48和72 h后,细胞早期凋亡分别为:9.2%±1.0%、21.2%±2.8%、28.9%±3.4%,细胞晚期凋亡分别为:14.8%±1.6%、15.7%±1.8%、18.4%±2.1%,与对照组早期凋亡(1.6%±0.2%)与晚期凋亡(2.2%±0.2%)相比,硼替佐米可时间依赖性促进Raji细胞凋亡(P<0.05)。

注:A为终浓度5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,MTT实验检测细胞活力(与0 nmol·L-1组比较,aP<0.05)。B为10 nmol·L-1硼替佐米处理Raji细胞24、48和72 h后,MTT实验检测细胞活力(与0 h组比较,bP<0.05)
图1MTT实验检测硼替佐米对Raji细胞活性的影响
2.3硼替佐米促进Raji细胞cleavedcaspase-3蛋白表达本研究进一步采用选择Western blotting法检测硼替佐米对Raji细胞cleaved caspase-3蛋白表达的影响。如图3A所示,分别给予5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,cleaved caspase-3蛋白相对表达量分别为:0.32±0.06、0.48±0.05、0.59±0.07、1.22±0.18,与对照组(0.18±0.04)相比,硼替佐米浓度依赖性促进Raji细胞cleaved caspase-3蛋白表达(P<0.05),而caspase-3表达差异无统计学意义;如图3B所示,10 nmol·L-1硼替佐米分别处理Raji细胞24、48和72 h后,cleaved caspase-3蛋白相对表达量分别为:0.48±0.05、0.67±0.09、1.02±0.15,与对照组(0.18±0.04)相比,硼替佐米可时间依赖性促进Raji细胞cleaved caspase-3蛋白表达(P<0.05),而caspase-3表达差异无统计学意义。
2.4硼替佐米抑制Raji细胞p-NF-κBp65蛋白表达NF-κB信号通路在细胞凋亡发挥重要作用。因此,本实验采用Western blotting检测硼替佐米对Raji细胞p-NF-κB p65蛋白表达的影响。如图4A所示,分别给予5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,p-NF-κB p65蛋白相对表达量分别为:0.18±0.06、0.08±0.02、0.04±0.01、0.02±0.01,与对照组(0.42±0.04)相比,硼替佐米浓度依赖性抑制Raji细胞p-NF-κB p65蛋白表达(P<0.05),而NF-κB p65表达差异无统计学意义;如图4B所示,10 nmol·L-1硼替佐米分别处理Raji细胞24、48和72 h后,p-NF-κB p65蛋白相对表达量分别为:0.08±0.02、0.03±0.01、0.02±0.00,与对照组(0.42±0.04)相比,硼替佐米可时间依赖性抑制Raji细胞p-NF-κB p65蛋白表达(P<0.05),而NF-κB p65表达差异无统计学意义。
3 讨论
伯基特淋巴瘤是一种高度侵袭性的淋巴瘤,多发生于儿童和青年人[1]。而伯基特淋巴瘤的治疗方式多为传统化疗方式为主[4-5]。而传统化疗易出现毒副作用和耐药性,导致临床上治疗效果不佳以及预后不良,因此,急需新的和毒副作用低的化疗药物。近来有报道论述,蛋白酶体活性异常会增加内质网氧化应激,最终引起肿瘤细胞凋亡[13]。因此,抑制蛋白酶体活性已经成为研究肿瘤治疗新的方向[14]。硼替佐米作为二肽硼酸蛋白酶体抑制剂,具有干扰DNA修复、诱导细胞凋亡的作用,已用于套细胞淋巴瘤和多发性骨髓瘤的治疗[12]。而硼替佐米治疗伯基特淋巴瘤的作用和机制尚未完善,因此,本研究基于伯基特淋巴瘤Raji细胞观察硼替佐米作用,有助于对临床应用硼替佐米治疗伯基特淋巴瘤提供新的理论依据。本研究发现硼替佐米浓度和时间依赖性抑制Raji细胞活力,并促进其凋亡。因此,我们推测硼替佐米治疗伯基特淋巴瘤可能通过诱导其凋亡实现的。

注:A为浓度5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,Western blotting检测细胞cleaved caspase-3蛋白表达(与0 nmol·L-1组比较,aP<0.05)。B为10 nmol·L-1硼替佐米处理Raji细胞24、48和72 h后,Western blotting检测细胞cleaved caspase-3蛋白表达(与0 h组比较,bP<0.05)
图3Western blotting检测硼替佐米对Raji细胞cleaved caspase-3蛋白表达的影响
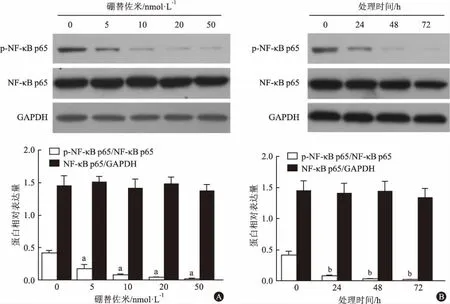
注:A为终浓度5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,Western blotting检测细胞p-NF-κB p65蛋白表达(与0 nmol·L-1组比较,aP<0.05)。B为10 nmol·L-1硼替佐米处理Raji细胞24、48和72 h后,Western blotting检测细胞p-NF-κB p65蛋白表达(与0 h组比较,bP<0.05)
图4Western blotting检测硼替佐米对Raji细胞p-NF-κB p65蛋白表达的影响
细胞凋亡是细胞机体一种复杂的程序化死亡进展,与众多调控因子相关。NF-κB是转录因子蛋白家族,参与调控机体免疫应答、炎症反应和肿瘤发生进展等多种生命进程。众多研究发现,在肿瘤细胞凋亡时,NF-κB信号受到抑制[8-9]。比较直接的证据是硼替佐米可通过抑制IκBα降解和NF-κB转位,阻滞套细胞淋巴瘤周期运行与促使其凋亡[15]。因此,本研究观察硼替佐米对伯基特淋巴瘤Raji细胞p-NF-κB p65表达的影响,发现硼替佐米能浓度和时间依赖性下调Raji细胞中p-NF-κB p65表达,上调cleaved-caspase-3蛋白表达,最终诱导其凋亡。
综上,可推测硼替佐米可能通过抑制NF-κB信号最终促进Raji细胞凋亡,从而起到抗伯基特淋巴瘤作用。

注:A为终浓度5、10、20和50 nmol·L-1硼替佐米处理Raji细胞24 h后,Annexin V-FITC /PI 双染检测细胞凋亡(与0 nmol·L-1组比较,aP<0.05)。B为10 nmol·L-1硼替佐米处理Raji细胞24、48和72 h后,Annexin V-FITC /PI 双染检测细胞凋亡(与0 h组比较,bP<0.05)
图2Annexin V-FITC /PI 双染检测硼替佐米对Raji细胞凋亡的影响

