3D培养人工皮肤组织黑色素瘤模型建立及评价
谢敏,李明英,张帆,刘庆平,秦建中,迟彦,3
(1大连大学附属中山医院,辽宁大连 116001;2大连大学生命科学与技术学院·糖脂代谢重点实验室;3辽宁师范大学生命科学学院)
恶性黑色素瘤是由黑色素细胞恶性转化形成的恶性肿瘤,具有高侵袭和高转移特性,我国恶性黑色素瘤发病率呈逐年上升趋势[1,2]。肿瘤细胞侵袭转移是导致黑色素瘤患者死亡的主要原因。皮肤恶性黑色素肿瘤细胞从表皮组织侵袭生长,穿越基底膜进入真皮层是他们向远端其他组织和器官转移的关键,干预黑色素肿瘤细胞侵袭生长,已成为国内外预防和治疗该肿瘤的研究热点[3,4]。目前,研究者主要利用肿瘤细胞移植建立的动物模型研究黑色素肿瘤转移特性或筛选抗肿瘤化合物,但这些模型均是将肿瘤细胞直接注射于动物皮下组织或血管内,转移速度取决于肿瘤细胞的生长速度和进入血管的难易程度,不能考察肿瘤细胞侵袭和穿透基底膜的能力,此为研究黑色素瘤细胞侵袭生长的分子机制及抑制侵袭生长的药物筛选带来了困难[5,6]。2015年8月~2018年3月,我们采用体外人工皮肤组织3D培养技术,将黑色素瘤细胞掺入到人工皮肤的表皮层,模拟生理条件下黑色素肿瘤细胞在局部扩散和侵袭过程,为研究黑色素瘤的侵袭生长特性提供研究模型。
1 材料与方法
1.1 材料 人黑色素瘤A375和C8161细胞购自南京凯基生物有限公司,胎牛血清购自Gemini Bio-Products公司。DMEM培养基购自Hyclone公司。Ⅰ型胶原、胰岛素、表皮生长因子购自Sigma公司,Ⅳ型胶原、层黏连蛋白抗体、E-钙黏素抗体购自Santa Cruz。
1.2 原代细胞分离与培养 原代皮肤成纤维细胞和表皮细胞均来源于包皮环切术后被切除的包皮组织。将皮肤置于含抗生素的PBS漂洗后,剪弃脂肪和结缔组织,将皮肤剪成约0.5 cm2的小块,加入dispase消化过夜。次日,用眼科镊子仔细将表皮剥离用于分离表皮角质形成细胞,将剩余真皮和皮下组织块置于含10%胎牛血清的DMEM培养基中,连续培养2~3周,至成纤维细胞在组织块周边扩散生长,收集细胞,传代扩增。将剥离的表皮组织进一步切碎,加入0.25%胰蛋白酶消化15 min,反复吹打制备细胞悬液,接种于60 mm培养皿,培养于含5%胎牛血清,表皮生长因子,抗生素的DMEM/F-12(3∶1)培养基中,待角质形成细胞长出克隆后,消化收集细胞,并传代扩增,将扩增至第3代的角质形成细胞用于人工皮肤3D培养。
1.3 黑色素瘤A375细胞和C8161细胞的培养 人黑色素瘤A375细胞或C8161培养于普通DMEM培养基中,培养基含3.7 g/L的碳酸氢钠,不同浓度(0.5%或5%)的胎牛血清,100 μg/mL青霉素和100 μg/mL硫酸链霉素。隔天换液1次,待细胞达到80%~90%融合时,用PBS冲洗,0.25%的胰蛋白酶消化传代,取对数生长期的细胞接板,进行后续实验。
1.4 人工表皮组织制备 制备人工皮肤组织使用BD公司生产的细胞培养小室(polycarbonate),置于12孔细胞培养板中。首先用适量酸溶解的I型胶原蛋白与成纤维细胞悬液混合,加入培养小室(1 mL/个),在室温静置40 min,待胶原蛋白凝固后,将培养小室放入细胞培养板中,加满含10%血清的DMEM培养基,培养24 h,此为人工真皮层。次日将角质形成细胞(0.5×106)与黑色素肿瘤细胞按比例1∶5混合,接种于在人工真皮层表面,置于细胞培养板孔中,加满含不同浓度血清(无血清、0.5%、5%)和表皮生长因子的细胞增生培养液(DMEM/F-12),在浸泡状态下培养2 d(浸泡培养)。然后吸除小室内培养液,并将小室移置于含有高起的金属网架上,使滤膜的细胞侧暴露于空气,并将表皮细胞分化培养液加到小室的外部空间,使液面与小室底部平齐(气/液界面培养),每2 d更换新鲜培养液1次,直至表皮组织出现细胞终末分化的特征。
1.5 人工皮肤组织中不同黑色素瘤细胞的侵袭能力观察 人工皮肤组织,经10%甲醛固定,石蜡包埋,制备组织切片。HE染色时,组织切片经二甲苯脱蜡,梯度乙醇和PBS水化,用Hematoxylin和Eosin染色,脱水,封片,镜下观察并照相。比较黑色素瘤细胞C8161和A375侵袭能力。
1.6 基底膜蛋白表达检测 人工皮肤组织经OCT包埋,干冰乙醇速冻后,制作冰冻切片。切片经甲醇固定后,在室温用5%BSA封闭,然后加适当稀释的抗Ⅳ型胶原蛋白抗体,抗层黏连蛋白(laminin)抗体,在室温孵育1 h。洗片后,再加入荧光素标记的二抗孵育1 h。再次洗片,加入DAPI染色5 min,显示细胞核,在荧光显微镜下观察细胞分布和基底膜蛋白表达。
1.7 细胞E-钙黏素分泌情况检测 将黑色素瘤A375细胞和C8161细胞、皮肤角质形成细胞爬片,加入抗E-钙黏蛋白抗体,激光共聚焦检测检测三种细胞E-钙黏素分泌情况。
1.8 不同黑色素瘤细胞生长速度检测 向6孔细胞培养板接种黑色素瘤细胞C8161和A375(50 000/孔),置于人工皮肤3D培养基中,于2、4、7、10 d用血球计数板计数,检测细胞生长速度。
1.9 细胞侵袭能力检测 采用Transwell侵袭实验。首先制备Matrigel包被小室膜,形成人工基底膜,4 ℃保存备用。将A375和C8161肿瘤细胞于无血清培养液中饥饿12 h,用含2%血清的培养液收集悬浮细胞,接种于Transwell小室内(100 000细胞/室),下室24孔板中加入含10%FBS的培养基,培养22 h,每组3个复孔。取出Transwell小室,用棉签擦去基质胶和上室内细胞,将小室倒置风干,结晶紫染色小室膜外侧面细胞,显微镜下(200×)计数细胞,计算10个不同视野内细胞总数。

2 结果
2.1 不同血清浓度对人工皮肤组织中肿瘤细胞生长的影响 HE染色表明,血清浓度在5%和0.5%时,C8161肿瘤细胞生长状态良好,呈现向真皮侵袭的特征,而无血清培养时肿瘤无明显生长和侵袭。此外,表皮细胞在0.5%血清浓度时,表皮结构清晰完整,角质形成细胞生长分化良好。后续实验采用0.5%作为3D培养人工表皮组织的血清浓度。
2.2 人工皮肤组织中不同黑色素瘤细胞侵袭能力比较 C8161细胞具备侵袭能力,培养1周,可见C8161细胞刚刚突破基底膜,而随着培养时间的延长,至培养第2周后,侵袭更为深入,而相同条件下培养的A375细胞的侵袭能力明显弱于c8161细胞,基底膜下层仅有少量肿瘤细胞分布。见图1。
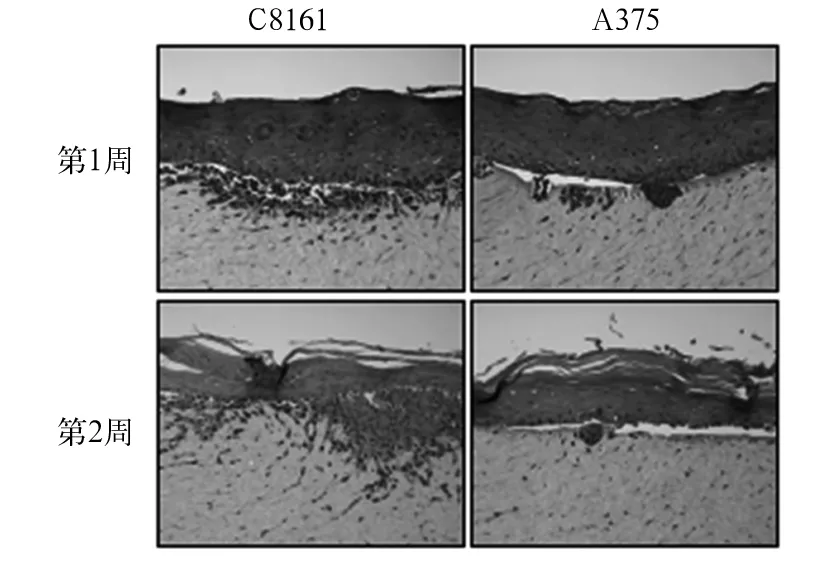
图1 HE染色检测不同黑色素瘤细胞侵袭能力
2.3 人工皮肤组织中基底膜形成与黑色素瘤细胞的侵袭能力 无肿瘤细胞的人工皮肤组织可见清晰的红色线状结构(基底膜蛋白阳性染色),基底膜形成良好。在含有黑色素肿瘤细胞的人工皮肤组织中,亦可见膜蛋白阳性染色。但在含C8161细胞的组织中虽可见基底膜标记蛋白的阳性反应,未呈现连续,整齐的线状结构,而表现为弯曲和弥散的分布特征,大量肿瘤细胞位于人工真皮组织中,提示基底膜不完整。与此相反,含A375细胞的人工皮肤组织,未呈现显著的肿瘤侵袭,多数肿瘤细胞位于基底膜上层,基底膜结构完整,与HE染色结果相似。见图2。
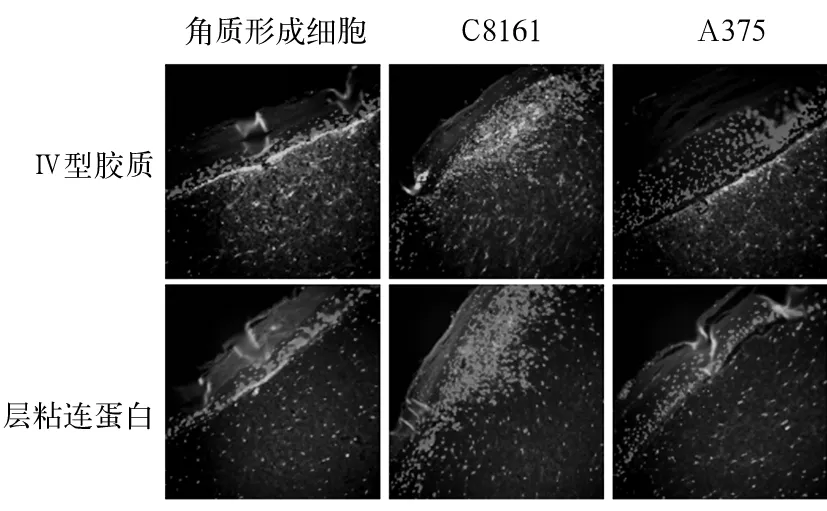
图2 免疫荧光检测不同黑色素瘤细胞侵袭能力
2.4 细胞E-钙黏连素分泌情况比较 表皮角质形成细胞分泌E-钙黏连素,而黑色素瘤细胞C8161、A375则不产生E-钙黏连素。
2.5 不同黑色素瘤细胞生长速度比较 A375、C8161两种肿瘤细胞在3D培养液中培养10 d,均持续保持增殖状态。相较于C8161细胞,A375细胞在单层细胞培养条件下细胞生长速度更快。见图3。

图3 不同时点黑色素瘤细胞生长速度比较
2.6 不同黑色素瘤细胞侵袭能力比较 C8161细胞穿过Transwell滤膜的细胞数为32 000±258(10个200×视野),而穿过滤膜的A375细胞数仅为250±16(10个200×视野),二者比较有统计学差异(P<0.01)。
3 讨论
黑色素肿瘤恶性程度高,主要因此类肿瘤细胞极易从表皮组织浸润,穿破基底膜,进入真皮和皮下组织的血管发生转移[7]。现有研究技术和手段很少有模拟生理条件下黑色素瘤侵袭过程。目前,肿瘤侵袭和转移模型,主要是Transwell实验或肿瘤细胞移植动物模型。Matrigel包被的Transwell滤膜虽具有人工基底膜的屏障作用[8],但并非生理条件下细胞所分泌的基底膜蛋白成分,该方法不能用于考察肿瘤微环境中多种细胞间的相互作用。在肿瘤移植动物模型中,肿瘤细胞被直接注射于皮下组织或血管内,不能考察肿瘤细胞在局部侵袭和迁移的能力。本研究建立的体外人工皮肤组织肿瘤模型,不仅含有角质形成细胞、成纤维细胞和胶原蛋白组成的立体构架,还能模拟生理条件生成表皮基底膜。肿瘤细胞在人工皮肤组织中的生长和侵袭行为接近于体内生理条件下肿瘤生长和转移特性[9,10],因此用此模型研究黑色素肿瘤侵袭和转移的机制及干预过程,有更多优势。
由于A375和C8161肿瘤细胞常规生长在含10%胎牛血清的培养基中,而在人工皮肤3D培养中,血清浓度过高,血清中的钙离子会促进表皮角质形成细胞的分化,所以我们首先探讨3D细胞培养液中最佳血清浓度。本研究通过对培养液血清浓度优化,成功建立了即适合于表皮组织分化又能维持肿瘤细胞长时间生长的3D培养条件。即0.5%作为3D培养人工表皮组织的血清浓度。免疫荧光技术观察结果显示,表皮基底膜在空气/液相培养1周即可形成,侵袭力弱的A375细胞主要局限于基底膜表皮侧,而侵袭力强的C8161细胞则弥散分布于不完整的基底膜两侧。随着培养时间延长(2~3周)肿瘤细胞向人工真皮层的扩散逐渐增强,提示通过3D培养建立的人工表皮组织,能较好模拟病理条件下的黑色素瘤细胞侵袭过程,为药物筛选和机理分析提供了研究模型。
目前黑色素肿瘤细胞穿过基底膜,侵袭生长的机理尚不清楚。我们观察到黑色素瘤细胞的迁移和侵袭与生长速度并无直接关系。在单层细胞培养中A375细胞的增殖速度虽高于C8161细胞,但C8161在3D人工皮肤模型中的侵袭和迁移能力却显著大于前者,提示侵袭力是不同肿瘤细胞的固有特征,这一点在广泛使用的Transwell实验中亦得到证实。有文献报道,E-钙黏蛋白对于抑制肿瘤细胞侵袭和迁移有重要作用,诸多肿瘤细胞失去分泌E-钙黏素的能力,转而产生N-钙黏素[11]。正常角质形成细胞表达丰富的E-钙黏素,位于细胞与细胞连接处[3]。两种肿瘤细胞均不表达E-钙黏素,但细胞侵袭生长却显著不同,提示在本实验条件下,失去E-钙黏素表达能力并不是导致肿瘤细胞侵袭迁移的必要条件。利用本研究所建立的模型,可进一步研究肿瘤细胞可能分泌的基质蛋白酶和其他因子对肿瘤侵袭转移的影响。
目前,多数抗肿瘤化合物筛选是在培养的单层细胞条件下进行。越来越多的证据表明,单层细胞培养所得到的结果与体内实验差异较大。由于立体培养可以更真实地模拟肿瘤细胞在体内生长特性,因此用3D培养的肿瘤细胞筛选抗肿瘤药物是药物研发的重要手段[12]。本研究所建立的模型不仅可观察肿瘤细胞侵袭生长,对于体外筛选有效的抗肿瘤药物亦有重要价值。

