TiO2/聚砜超滤膜成膜热力学及成孔剂溶出动力学研究
王坤
(新沂市星辰新材料科技有限公司, 江苏 新沂 221400)
工业上最廉价的超滤膜材料是聚砜,它具有以下优点:价格低廉且易获得,相对于其他材料它的机械强度、抗压密性以及耐热性、化学稳定性都非常好,它使用的pH范围也很宽(pH值为2~12);但也存在缺点,憎水性使疏水溶质易在膜表面产生吸附和沉积,阻塞膜孔造成膜污染,使膜的性能降低,寿命缩短,利用率下降,因此聚砜膜的改性非常重要,受到广大科研人员的重视。目前,二氧化钛(TiO2)是研究最为广泛的一种无机材料,因为TiO2具有很多优点,包括无毒、无光腐蚀;抗菌、光催化性;防紫外线、超亲水性[1];能够降解大多数有机污染物;在苛刻件下的稳定性;商业实用性,易于制备等优势。在水处理和膜技术中TiO2被越来越多的人应用,其中有人研究并报道了纳米TiO2作为催化剂光催化降解水中顽固的污染物[2~3]。通过研究表明,膜的亲水性因为TiO2与高分子超滤膜的复合得到了显著的改善[4],同时在铸膜液中添加适当的高分子添加剂有助于改良PSF超滤膜的截留率与渗透性,聚乙烯吡咯烷酮(PVP)和聚乙二醇(PEG)[5~8]是常用的高分子添加剂[9]。引入高分子添加剂后铸膜液的性质发生了改变,对成膜动力学过程也有一定的影响,从而决定了超滤膜的微观结构与性能。除此之外,超滤膜的制备条件特别是温度,显著影响着铸膜液的性质与超滤膜的微观结构。因此为了明确改性剂TiO2的作用机制在研究成膜机制方面的意义,需要深入研究TiO2的浓度和凝胶浴温度对铸膜液动力学和热力学性质的影响。
本文主要以PVP高分子聚合物为成孔剂,采用浊点滴定法绘制三元相图,通过控制改性剂TiO2的浓度以及温度研究L-S相转化法成膜过程热力学机理;以PEG高分子聚合物为成孔剂,通过控制改性剂TiO2的浓度、凝胶浴温度和挥发时间来研究L-S相转化法成膜过程中PEG的溶出动力学,以实现通过添加改性剂调整铸膜液的组成及控制成膜外部条件改变超滤膜的结构,增强超滤膜性能,延长超滤膜寿命,提高超滤膜利用率,以及通过研究高分子聚合物的溶出动力学来确定聚合物固化成膜的相分离过程,为将来探究高分子聚合物溶出速率对膜结构和性能的影响做好充分的准备。
1 实验材料与方法
1.1 实验仪器与试剂
1.1.1 实验仪器
实验主要仪器见表1。
1.1.2 实验材料
实验主要试剂见表2。

表1 主要仪器

表2 主要试剂
1.2 实验方法
1.2.1 铸膜液的制备过程
根据一定的配比配置不同TiO2浓度的铸膜液,总质量为40 g,配比分别为PSF16%,即6.4 g,PVP(PEG)为10%,即4 g,DMAc分别为73.9%、73.8%、73.7%、73.6%,即质量分别为 29.56 g、29.52 g、29.48 g、29.44 g,TiO2质量比分别为0.1%、0.2%、0.3%、0.4%,即质量为0.04 g、0.08 g、0.12 g、0.16 g。实验步骤如下:先将PSF放在电热鼓风干燥箱内烘干,温度设置为80℃,时间为6 h;待PSF烘干后放入干燥器内冷却,称取 DMAc质量分别为 29.56 g、29.52 g、29.48 g、29.44 g放在80 mL小烧杯中,放入转子,用塑料薄膜将其封住,放在磁力搅拌器上,称取PVP(PEG)4 g,边搅拌边加入PSF,为使其充分溶解需加热搅拌,待PVP(PEG)溶解后,称取TiO2质量分别为0.04 g、0.08 g、0.12 g、0.16 g分别加入到对应的DMAc溶液中,待TiO2溶解,溶液由透明变为混浊的乳白色时称取PSF6.4 g加入小饶杯中将其封住,搅拌,直至完全溶解,制成均一的铸膜液,此过程大约需要12 h,停止搅拌后需静置脱泡24 h,以便除去气泡,为后续刮膜做好准备。
1.2.2 PSF超滤膜的制备过程
PSF超滤膜的制备大致可分为三个步骤,第一步,确定好超滤膜的厚度后制备刮膜器,刮膜器可以用玻璃棒制备,在玻璃棒两端缠绕一定圈数的透明胶带,此实验缠绕的圈数为6圈,制备好刮膜器后,需要制备玻璃板,玻璃板可以用10 cm×10 cm玻璃板进行打磨,打磨成4 cm×5 cm长方形的玻璃板以便放入1 000 mL的烧杯中;第二步,清洗玻璃板和玻璃棒并将其擦干,将静置脱泡后的铸膜液均匀倒在玻璃板前端,用玻璃棒将铸膜液刮下,开始时把玻璃棒在铸膜液上均匀的旋转半圈以除去气泡,刮膜过程要注意用力均匀,防止刮好的膜厚度不均,影响实验结果;第三步,室温下预蒸发一定时间,大约10 s左右,将涂有铸膜液的玻璃板放入凝胶浴中,凝胶成膜,直至超滤膜自动从玻璃板上脱落,将制得的超滤膜放入蒸馏水中浸泡。
1.3 浊点滴定
在制备超滤膜的过程中,为了改良PSF超滤膜的截留率与渗透性,需要在铸膜液中添加适当的高分子改性剂,本实验添加TiO2。为真实地反映制备超滤膜过程中的热力学过程,实验将研究PSF-PVP-TiO2-S-NS的五元体系的三元相图。为得到PSF-PVPTiO2-S-NS的五元体系的三元相图,便于阐述体系的热力学过程,本实验把TiO2看作溶剂,将它的质量算到所用溶剂的质量中去。
(1)控制铸膜液的温度分别为15、20、25及30℃,得到不同温度时PSF-PVP-TiO2-S-NS体系浊点相图。
(2)在20℃下,保持PSF含量不变,改变PVP质量分数,使PVP含量分别为6%、8%、10%及12%(质量分数)配制铸膜液,得到不同PVP含量时PSF-PVP-TiO2-S-NS的浊点相图。
(3)在20℃下,保持PVP浓度不变,改变PSF质量分数,使PSF含量分别为15%、16%、17%及18%(质量分数)配制铸膜液,得到不同PSF含量时PSF-PVP-TiO2-S-NS的体系浊点相图。
目前关于成膜热力学过程的研究主要是借助浊点曲线三元相图来描述,聚合物的复杂体系在非溶剂和溶剂中的相转变、聚合物分子链重排以及固化的成膜过程可以用三相图来具体的描述。
实验步骤大体如下:将装有铸膜液的烧杯用铁架台固定在大功率电动搅拌器上,将烧杯用塑料薄膜封住口以防DMAc蒸发,依据需要调整搅拌器的速度,边搅拌边用注射器向铸膜液中添加去离子水,铸膜液遇到去离子水后迅速凝固,一段时间后溶解,如果最后一滴去离子水一段时间后没有溶解,则滴定达到终点,记录下所用去离子水的质量。
本实验按照总质量为40 g,配比为PSF16%,即6.4 g,PVP为 10%, 即 4 g,DMAc分 别 为 73.9%、73.8%、73.7%、73.6%,即质量分别为29.56 g、29.52 g、29.48 g、29.44 g,TiO2质量比分别为0.1%、0.2%、0.3%、0.4%,即质量分别为0.04 g、0.08 g、0.12 g、0.16 g,配置四个梯度的TiO2的铸膜液。控制温度分别为15℃、20℃、25℃、30℃,在不同温度下进行滴定,记录下数据。重复以上步骤进行测试。
1.4 平板超滤膜中PEG溶出量的监测
1.4.1 显色剂的配置
据材料显示,聚乙烯二醇(PEG)可以碘化铋钾试剂(Dragendoff试剂)发生反应生成桔红色的络合物[21],因此利用此理论来测量PSF超滤膜中PEG的溶出量。然而,在此过程中存在诸多问题,影响实验的准确度,如以下情况。
(1)此络合物见光易分解;
(2)在室温下配置碘化铋钾试剂时,次硝酸铋在冰乙酸中的溶解度不高且溶解的速度较慢;
(3)当酸性条件达不到要求时碘化铋钾与聚乙二醇(PEG)发生反应的过程中易产生沉淀等。
本次实验改良了传统的聚乙二醇配制方法,具体的操作步骤如下所示:
(1)A液的配置:准确称取3.2 g次硝酸铋放于小烧杯中,准确量取20 mL浓硝酸将其溶解。准确称取NaOH颗粒8 g置于另一烧杯中,加适量蒸馏水使其溶解,最后将两者混匀置于200 mL棕色容量瓶中,准确量取40 mL冰乙酸加入容量瓶中,再加蒸馏水,稀释至刻度线。
(2)B液的配置:因为碘化钾见光易分解,配置时在遮光的条件下准确称取80.0 g置于烧杯中加适量蒸馏水溶解,然后置于200 mL棕色容量瓶中,再加蒸馏水,稀释至刻度线。
(3)Dragendoff试剂的配置:准确量取A液B液各50 mL置于1 000 mL棕色容量瓶中,再加蒸馏水稀释至刻度线,其有效期为半年。
1.4.2 标准曲线的制作
(1)取适量聚乙二醇(PEG)放入电热鼓风干燥箱内,烘干以便去除水分,时间为4 h,温度为60ºC,后放在干燥器内冷却。
(2)待聚乙二醇(PEG)冷却后,准确称取0.5 g溶解于500 mL的容量瓶中,配置成1 000 mg/L的聚乙二醇溶液,然后分别吸取聚乙二醇溶液 0、1、2、3、4、5 mL稀释于100 mL 容量瓶中,配制成浓度为0、10、20、30、40、50 mg/L的聚乙二醇标准溶液。
(3)标准曲线的制作
将配置好的浓度为0、10、20、30、40、50 mg/L的聚乙二醇标准溶液。用25 mL移液管依次准确量取25 mL加入到50 mL的棕色容量瓶中。其次量取6 mL冰乙酸加入到容量瓶中,摇动容量瓶使溶液与冰乙酸混匀,然后量取6 mL Dragendoff试剂加入到容量瓶中摇匀,最后加蒸馏水稀释至刻度线,摇匀,静置15 min,最后用紫外分光光度计和玻璃比色皿测吸光度,波长为510 nm,在这之前要用蒸馏水作空白。记录下数据,绘制图表。PEG-4000的标准曲线如图1所示。
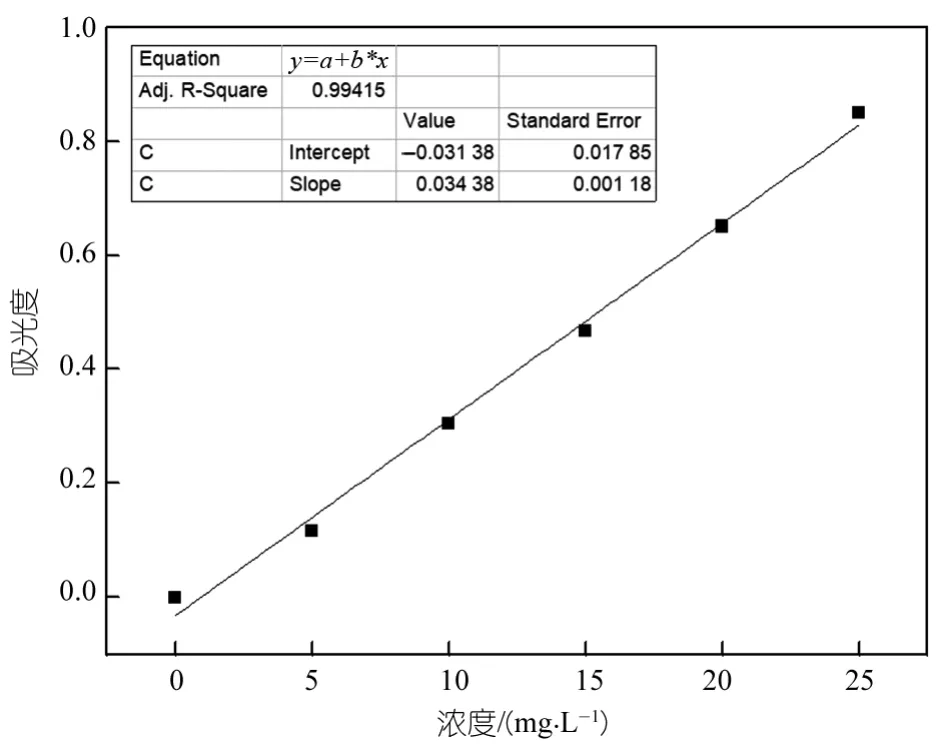
图1 PEG-10000溶液标准曲线
1.4.3 样品的测试
本实验中用到的取样装置如图2所示:
(1)取1 000 mL的大烧杯,洗净,用蒸馏水冲洗,用于盛放蒸馏水,使用水银温度计调节温度,将水放在冰箱和水浴锅内调节温度,用作凝胶浴。
(2)将配置好的铸膜液均匀倒在玻璃板上进行刮膜,开时前称取玻璃板的质量,刮好膜后,再称取铸膜液和玻璃板的质量记下数据,此过程需在预蒸发时间内完成,作差即可得到铸膜液的质量。
(3)将刮好的膜,经预蒸发时间后放入一定温度的凝胶浴中,开启磁力搅拌器,取不同时间的溶液各25 mL,时间分别为1、2、3、4、5 min,分别加入到50 mL容量瓶中。
(4)准确量取冰乙酸与Dragendoff试剂各6 mL,加入到容量瓶中,在这个过程中要注意先加冰乙酸调节酸度摇匀,再加Dragendoff试剂摇匀显色,最后用蒸馏水稀释至刻度线摇匀,静置15 min,使用3 cm厚的玻璃比色皿在510 nm波长下使用紫外分光光度计测定吸光度,蒸馏水为参比液。
(5)根据吸光度,利用标线求出浓度,求出对应质量下PEG的溶出量,最后统一换算成0.5 g下的PEG的溶出量以便比较。

图2 取样装置图
2 结果与分析
2.1 TiO2在不同温度下对PSF-PVP-S-NS四元体系浊点的影响
浊点滴定时,控制铸膜液中TiO2浓度分别为0.1%、0.2%、0.3%、0.4%,用去离子水作为滴定液。图3为15、20、25、30 ℃下不同TiO2浓度的浊点图。从图中可以看出以下规律:
(1)对任意的一条浊点曲线而言,随铸膜液中TiO2浓度的升高,浊点曲线逐渐靠近溶剂轴(DMAc+PVP+TiO2轴),这说明随着铸膜液中TiO2浓度的升高,铸膜液对非溶剂的容纳能力减小,这主要是因为TiO2的比表面比较大,且储存了大量的表面能,其表面富含的羟基与 PSF分子链产生了吸附作用,因此TiO2的浓度越大,与大分子之间的这种相互作用越强,体系的黏度也就越大故PSF分子相互接触的几率变大,铸膜液中溶剂的分子浓度减小,当溶液中含有少量的非溶剂时,PSF分子即可发生聚集,产生液-液相分离,从而减小了铸膜液对非溶剂的容纳能力[9~12]。
(2)从图中可以看出不同温度下的四条曲线都保持一致即随着滴定温度的升高,浊点曲线渐渐远离溶剂轴,这说明随着滴定温度的升高铸膜液对非溶剂的容纳能力渐渐增大,这主要是因为铸膜液中溶剂化作用的强度随着滴定温度的升高而加强,从而使得PSF分子链在溶液中更加容易伸展,与此同时PSF分子的热运动也更加的剧烈,这使得PSF分子间聚集的可能性减小,因此也就增加了铸膜液对非溶剂的容纳能力[13~16]。
2.2 时间对PEG溶出动力学的影响
2.2.1 时间对PEG溶出量的影响
配置TiO2浓度分别为0.1%、0.2%、0.3%、0.4%的铸膜液,制备PSF超滤膜,控制温度分别为15、20、25、30℃,进行溶出量的测定。图4分别为15、20、25、30℃下PEG的溶出量。由图可以看出,溶出量随时间的增加逐渐增加,并且在第一分钟第二份时溶出迅速,几乎全部溶出,第3、4、5 min后溶出量趋于稳定。同时可以看出当溶出量趋于稳定时15℃时溶出量最高,30℃最低,即随着温度的升高,超滤膜中PEG的溶出量逐渐降低。这主要是因为随着凝胶浴温度的升高,PEG与溶剂的扩散速度增大,于是铸膜液的表层便能迅速的生成,而且比较致密,从而成为内部PEG溶出的阻碍,所以温度高时PEG溶出量低于温度低时PEG的溶出量[17~19]。
2.2.2 时间对PEG溶出速率的影响
如上所述制备TiO2浓度为0.1%的PSF超滤膜,分别在不同温度下测量,将溶出量进行拟合可得到溶出量拟合方程,对溶出量拟合方程求导即可得到PEG溶出速率方程,如表3所示,根据溶出速率方程即可求得到溶出速度,图5为对应TiO2浓度下的PEG溶出量拟合曲线图和溶出速率图,由图可以看出随着时间的增加溶出总量逐渐增加后趋于稳定,溶出速率逐渐减小,主要是因为随着时间的增加,铸膜液中PEG的量逐渐减小,溶出速率逐渐减小[20]。同时也可以看出30℃时溶出速率最大。
表4为TiO20.2%时的溶出量拟合方程和溶出速率方程,图6为溶出量拟合图和溶出速率图,由图可以看出随着时间的增加溶出总量逐渐增加后趋于稳定,溶出速率逐渐减小最终趋于零。
如表5为TiO20.3%时的溶出量拟合方程和溶出速率方程,图7为溶出量拟合图和溶出速率图,由图可以看出随着时间的增加溶出总量逐渐增加后趋于稳定,溶出速率逐渐减小最终趋于零。
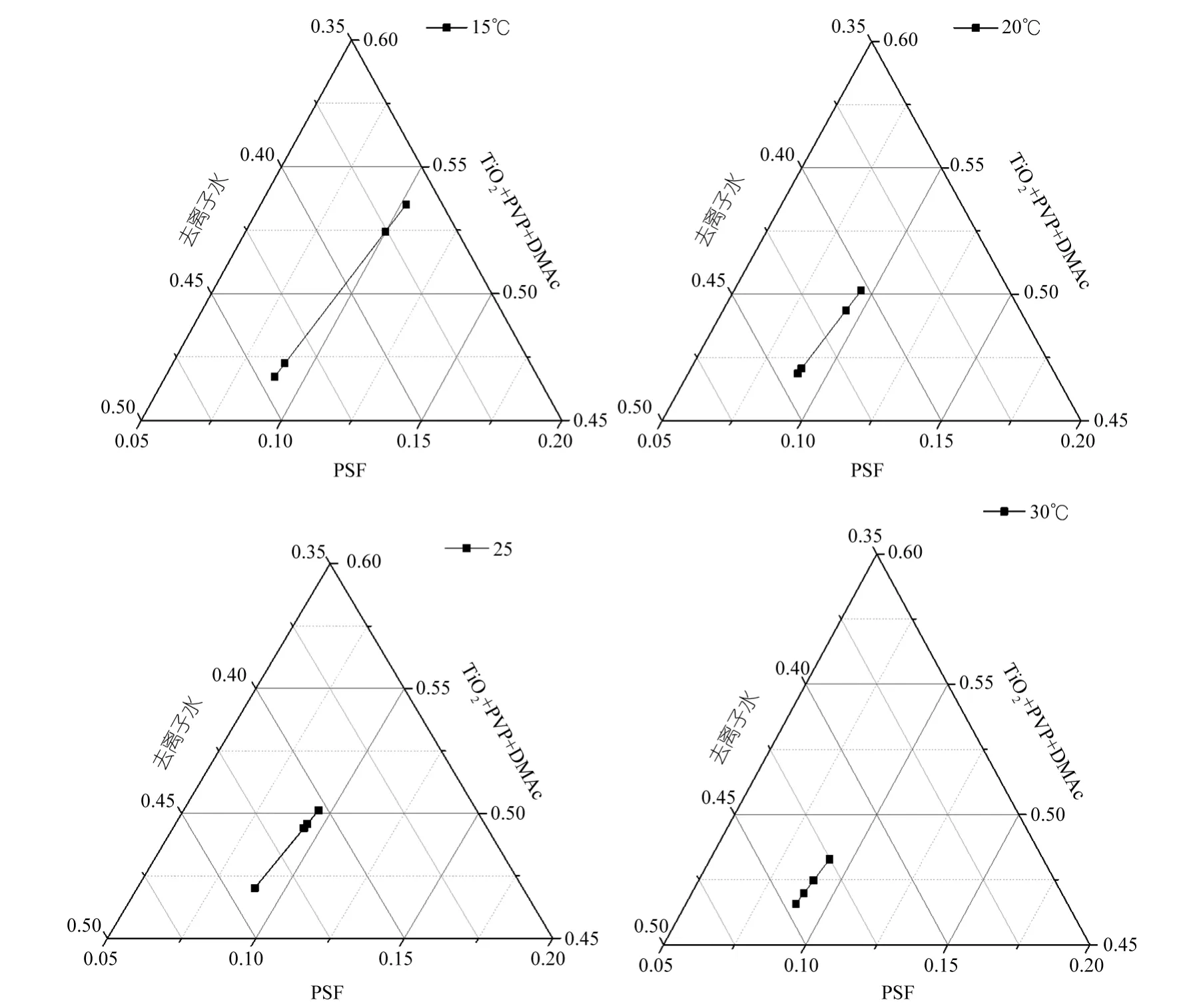
图3 不同温度下不同TiO2浓度铸膜液的沉淀值

表3 TiO2为0.1%时PEG随时间溶出量、溶出速率方程

表4 TiO2为0.2%时PEG随时间溶出量、溶出速率方程
表6为TiO20.4%时的溶出量拟合方程和溶出速率方程,图8为溶出量拟合图和溶出速率图,由图可以看出随着时间的增加溶出总量逐渐增加后趋于稳定,溶出速率逐渐减小最终趋于零。
2.3 温度对PEG溶出动力学的影响
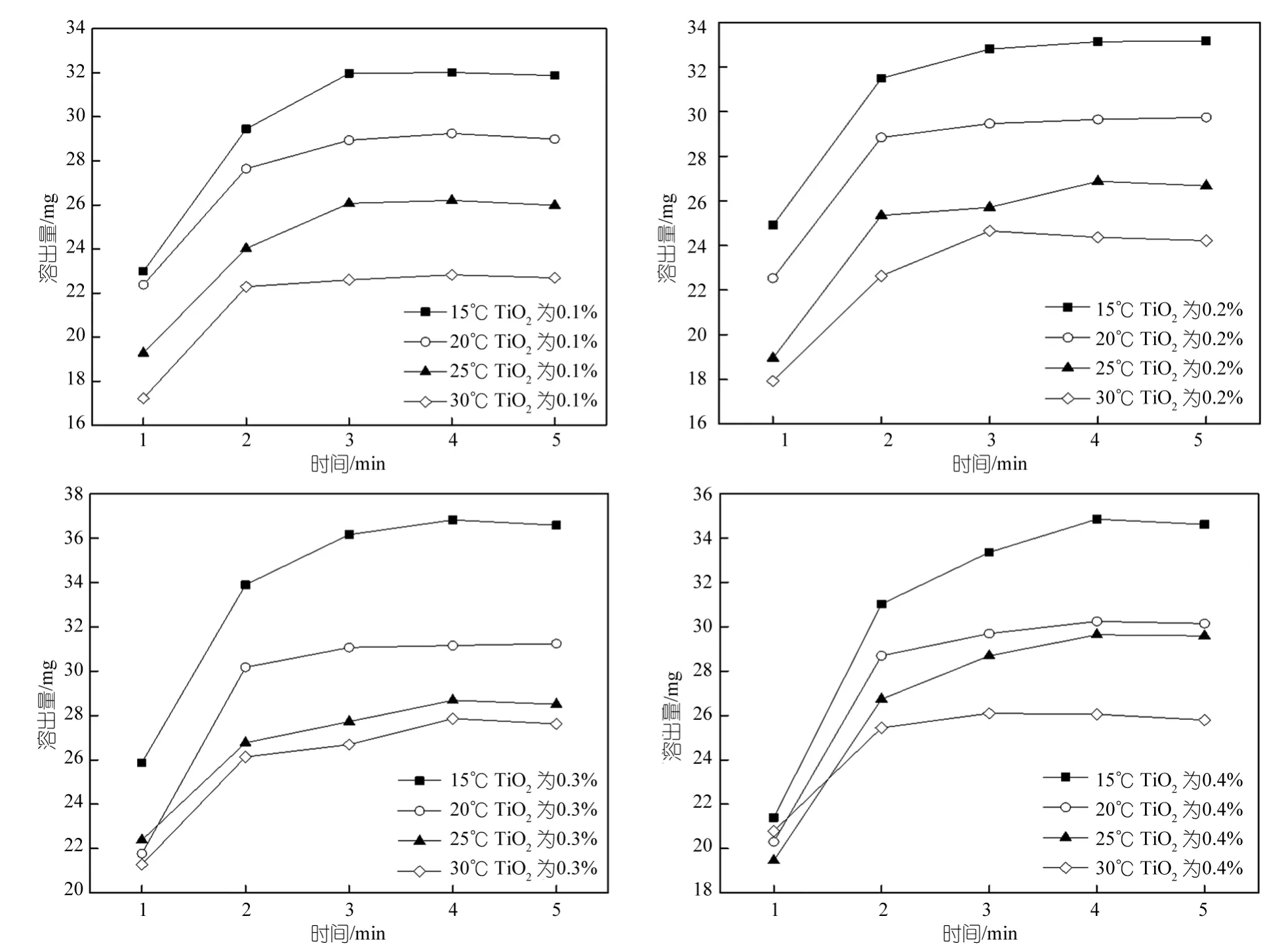
图4 不同TiO2浓度下时间对PEG溶出量的影响

图5 TiO2为0.1%时PEG随时间溶出量拟合图和溶出速率图

表5 TiO2为0.3%时PEG随时间溶出量、溶出速率方程

图6 TiO2为0.2%时PEG随时间溶出量拟合图和溶出速率图

图7 TiO2为0.3%时PEG随时间溶出量拟合图和溶出速率图

表6 TiO2为0.4%时PEG随时间溶出量、溶出速率方程
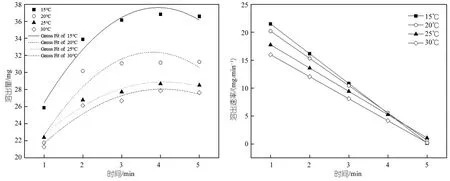
图8 TiO2为0.4%时PEG随时间溶出量拟合图和溶出速率图
成膜过程中PEG的溶出与凝胶浴的温度有密切的关系,同时凝胶浴的温度对铸膜液体系的黏度也有一定的影响,因为这些原因溶剂和非溶剂的扩散速度也受到影响,然而溶剂与非溶剂的扩散速度对铸膜液的凝胶速度有极其重要的影响。由图9可以看出随着凝胶浴温度的升高铸膜液中PEG的溶出量逐渐降低,这主要是因为随着凝胶浴温度的升高,PEG与溶剂的扩散速度增大,于是铸膜液的表层便能迅速的生成,而且比较致密,从而成为内部PEG溶出的阻碍,然而温度低时,PEG与溶剂的扩散速度降低,膜表层形成速度慢,PEG溶出量多且形成比较大的膜孔,从而使内部的PEG溶出量增多,所以温度低时PEG的溶出量大[21]。
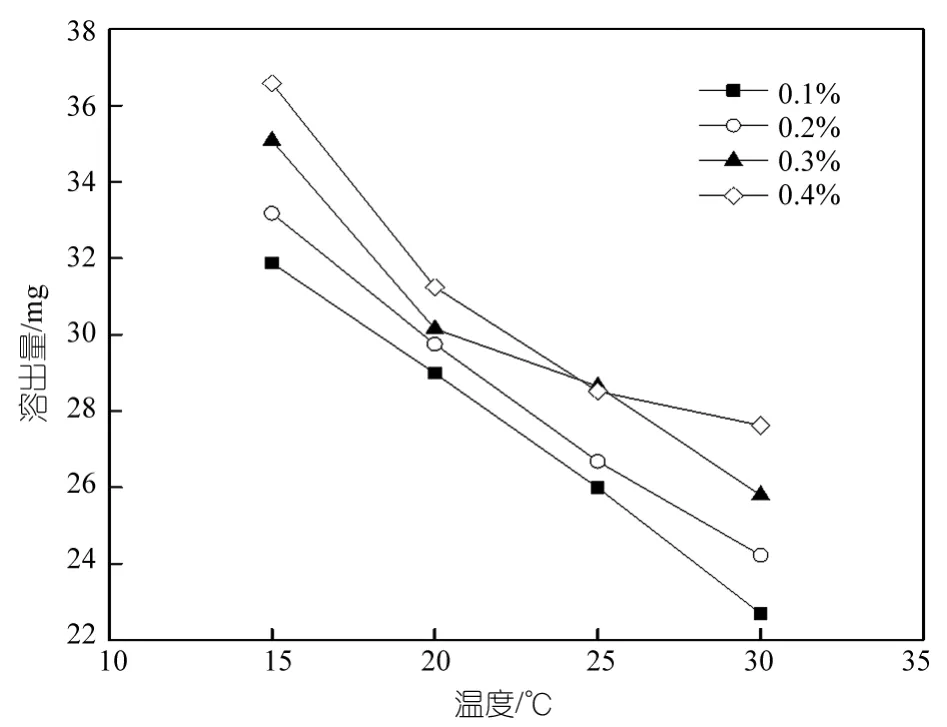
图9 温度对PEG溶出量的影响
2.4 TiO2浓度对PEG溶出动力学的影响
由图10可以看出随着TiO2浓度的升高铸膜液中PEG的溶出量逐渐的增加,这主要是因为:
(1)铸膜液中添加了改性剂TiO2后,TiO2的表面含有大量的羟基,正因为这些羧基的存在改善了PSF超滤膜的亲水性,因此随着TiO2浓度的增加,PSF超滤膜表面吸附和镶嵌的TiO2粒子也随之增加,从而使膜的水接触角逐渐的减小,亲水性也随之增强。
(2)TiO2颗粒改变了表层下面的结构,加强了表面孔和亚表层的连通性[21]。故随着TiO2浓度的升高铸膜液中成孔剂PEG的溶出量也随之逐渐的增加。

图10 TiO2浓度对PEG溶出量的影响
3 结论
本文采用浊点滴定法利用相图理论研究TiO2浓度及温度在成膜过程中对热力学相图的影响。利用紫外分光光度计法研究了温度、时间以及TiO2浓度对成膜过程中PEG溶出量和速度的影响。得出以下四条结论:
(1)随铸膜液中TiO2浓度的升高,浊点曲线逐渐靠近溶剂轴,铸膜液对非溶剂的容纳能力降低,随着滴定时温度的升高浊点曲线逐渐远离溶剂轴,铸膜液对非溶剂的容纳能力提高。
(2)随时间的增加成膜过程中PEG的溶出量逐渐增加且慢慢趋于稳定,PEG溶出速率随时间的增加而减小。
(3)随着凝胶浴温度的升高,PEG的溶出量逐渐降低。
(4)随着TiO2浓度的升高,PEG的溶出量逐渐升高。

