腹壁子宫内膜异位症的临床资料分析
刘怡瑾,马平川,朱颖军
(1.天津医科大学研究生院,天津300070;2.天津市中心妇产科医院普妇科,天津300100)
子宫内膜异位症(endometriosis,EMs)是指子宫内膜腺体和间质存在于子宫体以外,影响约6%~10%的育龄期妇女,最常见的症状包括痛经、性交痛、慢性盆腔疼痛、不孕。它分为盆腔内和盆腔外子宫内膜异位症,盆腔内子宫内膜异位症主要包括卵巢、输卵管、子宫韧带、盆腔腹膜子宫内膜异位症[1]。因子宫内膜异位症具有类似恶性肿瘤远处转移和种植生长能力[2],故病灶可出现在其他部位,我们称之为盆腔外子宫内膜异位症,如发生在脐、膀胱、肾、输尿管等,其中腹壁子宫内膜异位症(abdominal wall endometriosis,AWE)是最常见的盆腔外种植。AWE是指异位子宫内膜组织种植在皮下脂肪组织或腹壁肌层。大多数病例与既往的腹部手术相关,称之为腹壁瘢痕子宫内膜异位症(abdominal scar endometriosis,ASE),指子宫内膜组织出现在腹部手术切口处或附近组织,其中最常见的是剖宫产术。现就238例AWE患者进行分析探讨。
1 资料与方法
1.1 一般资料 选取2012-2017年天津市中心妇产科医院收治的AWE患者238例,其中5例因个人原因出院,其余233例均经过术后病理证实为AWE。其中232例均为在剖宫产切口处发现AWE,其中1例患者主因早孕(孕7周)合并子宫肌瘤入院,要求行人工流产,于我院行吸宫术后4 d行开腹子宫肌瘤剔除术,术中未透宫腔。其中1例手术治疗前应用GnRHa治疗。患者的平均年龄为32.5岁(24~43岁),其中23人有两次剖宫产史,均为第2次剖宫产术后发病。所有患者均行手术治疗,手术平均时间48 min(20~120 min),平均出血 33 mL(1~200 mL)。
1.2 研究方法 根据患者既往手术史、症状、体征和超声检查,对病变的范围和手术适应证进行评估。手术过程中测量结节大小,用电刀在病灶周围0.5~1 cm左右切除整个病灶。手术标本均经病理检查证实是AWE。于术后完成治疗后6个月随访复发情况。
1.3 统计学方法 采用SPSS 20.0统计学软件进行统计分析,计量资料以()表示,两独立样本用t检验,计数资料采用χ2检验,多组间比较用多因素方差分析,组间指标两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 年龄、月经复潮时间与潜伏期的关系 我们把既往腹部手术史与出现AWE之间的时间称之为潜伏期,潜伏期时间窗平均为71个月(3~167月)。月经复潮时间平均为4个月(1~14个月),患者年龄≥35岁的潜伏期长于年龄<35岁者,差异有统计学意义(P<0.05)。月经复潮时间≥6个月的潜伏期与<6个月者,差异无统计学意义(P>0.05)。见表1。
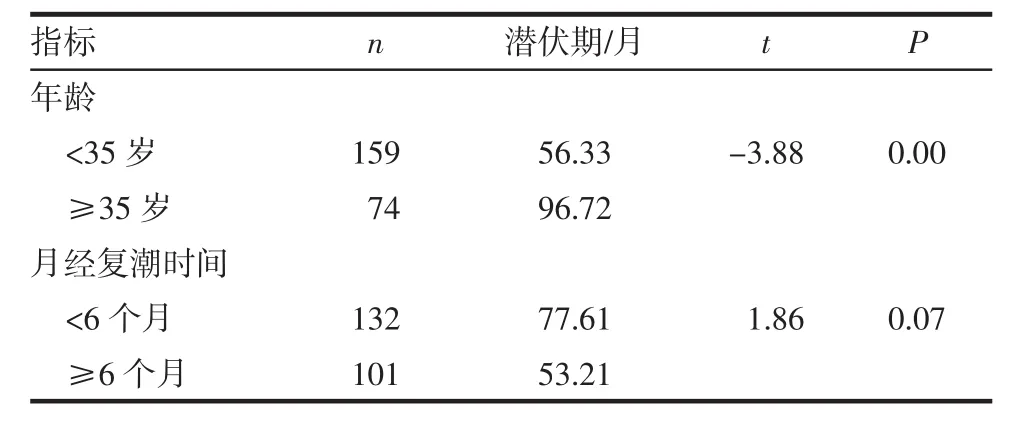
表1 患者年龄及月经复潮时间与潜伏期的关系Tab 1 The relationship among latency,patient age and menstrual recuperation time
2.2 临床表现与诊断 23例可触及无痛性腹壁下结节,其余发现与月经周期有关的疼痛结节。查体在腹部手术切口下可触及压痛结节,其中24例可触及大于1个腹壁下结节,其余209例为单发腹壁下结节。所有患者超声检查均发现腹部切口下低回声区,其中191例低回声区周围未见明显血流,42例低回声区周边可见星点状血流。149例行血清CA125检查,平均24.51 U/mL,126例在正常范围内,筋膜型>前鞘肌肉型>腹膜型。CA125的值:筋膜型(21.30~226.30 mIU/mL)95%可信区间为 25.34~65.37 mIU/mL;前鞘肌肉型(14.64~30.99 mIU/mL)95%可信区间为 19.70~24.19 mIU/mL;腹膜型(7.20~16.12 mIU/mL)95%可信区间为 9.61~13.51 mIU/mL。其中2例CA125值大于100,均为筋膜型。
2.3 治疗 所有患者均行手术治疗,患者出现症状与手术治疗之间的时间平均为30个月(1月~10年)。其中,4例病灶仅在皮下脂肪层,128例病灶达浅筋膜,76例侵犯肌肉层,25例侵犯腹膜,侵犯深度达浅筋膜的最多,病灶局限在皮下脂肪层的发病率最低。其中24例为多发病灶,其余可探及一处病灶,平均病变的体积为21.51 cm3(2~336 cm3)。腹壁下结节只有3例直径大于5 cm,最大直径8 cm,为腹膜型。术中探及异位病灶与筋膜、腹直肌、腹膜关系,于病灶外切除病灶,182例在病灶之外0.5 cm处,51例在病灶外大于1 cm处切除病灶。所有标本均送病理科进行病理证实。术后112例单纯AWE行GnRHa治疗,8例合并卵巢子宫内膜异位症者行GnRHa治疗,113例单纯AWE术后未进一步药物治疗。
2.4 腹壁下结节大小、CA125与病灶深度的关系 根据病灶侵及深度,我们分成3型,一型为筋膜型,侵及皮下脂肪层或达浅筋膜层;二型为前鞘肌肉型,病灶达腹直肌前鞘或达肌层;三型为腹膜型,侵及腹膜。结节大小与腹壁子宫内膜异位症分型有关,腹膜型与筋膜型、前鞘肌肉型病灶大小均有显著性差异(P<0.05)。血清CA125在诊断AWE并没有特异性,但我们发现,筋膜型与前鞘肌肉型和腹膜型血清CA125相比,差异具有统计学意义(P<0.05)。手术出血量,腹膜型与前鞘肌肉型、筋膜型相比,差异具有统计学意义(P<0.05),腹膜型的手术出血量大于筋膜型、前鞘肌肉型,前鞘肌肉型的手术时间大于筋膜型,差异具有统计学意义(P<0.05)。见表2。
表2 不同腹壁子宫内膜异位症分型结节大小、CA125值、手术出血量、时间的比较Tab 2 Comparison of the lesion volume,serum CA125 and blood loss and operation time among different types of AWE()
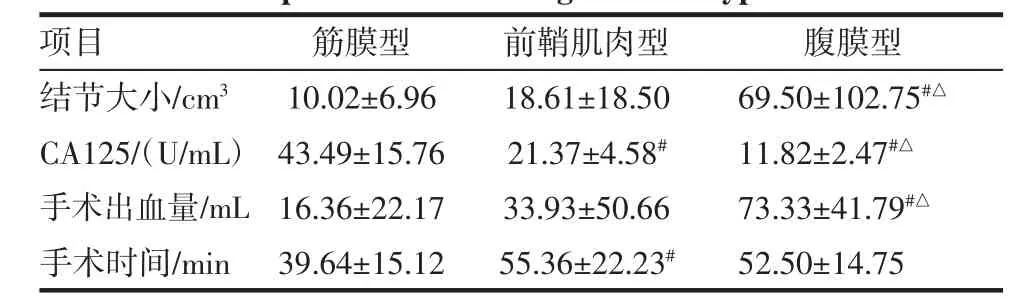
表2 不同腹壁子宫内膜异位症分型结节大小、CA125值、手术出血量、时间的比较Tab 2 Comparison of the lesion volume,serum CA125 and blood loss and operation time among different types of AWE()
与筋膜型相比,#P<0.05;与前鞘肌肉型相比,△P<0.05
项目 筋膜型 前鞘肌肉型 腹膜型结节大小/c m 3 1 0.0 2±6.9 6 1 8.6 1±1 8.5 0 6 9.5 0±1 0 2.7 5#△C A 1 2 5/(U/m L)4 3.4 9±1 5.7 6 2 1.3 7±4.5 8#1 1.8 2±2.4 7#△手术出血量/m L 1 6.3 6±2 2.1 7 3 3.9 3±5 0.6 6 7 3.3 3±4 1.7 9#△手术时间/m i n 3 9.6 4±1 5.1 2 5 5.3 6±2 2.2 3# 5 2.5 0±1 4.7 5
2.5 术后随访 术后患者根据是否接受GnRHa治疗分为两组,均在结束治疗后半年得到电话或门诊随访,结果显示,未治疗组仅有1例复发,其余患者腹壁下疼痛症状均消失,无复发,术后无疼痛出现。术后是否追加GnRHa治疗与复发之间的差异无统计学意义(P>0.05)。见表 3。
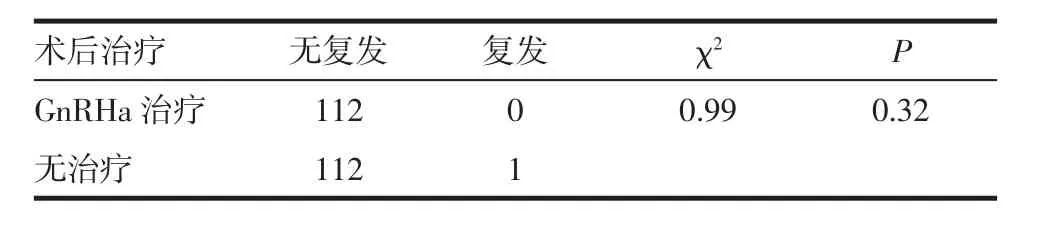
表3 GnRHa治疗对术后复发的影响Tab 3 The influence of GnRHa treatment on postoperative recurrence
3 讨论
盆腔外子宫内膜异位症发病率为9%~15%,AWE占子宫内膜异位症的0.04%~12%[3],我院为9.83%。在手术操作后发生AWE约0.03%~0.8%[4],其中剖宫产术后为0.03%~3.5%,且呈增加趋势。AWE最常见的病因是在手术操作中将子宫内膜组织直接种植到筋膜或肌肉层中,随后在雌激素刺激下产生[4]。Wang等[5]认为在产科手术中,羊水可以促进暴露的子宫内膜细胞的分离,并且失血量多可为子宫内膜组织的生长提供相对丰富的营养环境。其他手术操作如子宫切除术、腹腔镜检查、会阴切开术后,也可在手术切口出现子宫内膜异位症[6]。我们纳入的1例为子宫肌瘤剔除术后发生AWE,患者行吸宫术后行子宫肌瘤剔除术,术中未透宫腔。但是可能是由于吸宫时残留蜕膜组织异位至腹腔,再次手术时被带入腹壁组织中,或为子宫肌瘤术中缝线穿过子宫内膜层所致。因此应避免在妊娠期间行腹部择期手术。腹腔镜套管针部位子宫内膜异位症到目前为止文献报道仅有16例,我院收治的病例中有10例为会阴切开瘢痕处子宫内膜异位症。AWE也可不继发于腹部手术,荟萃分析发现441例AWE中自发性AWE病例有63例,占14.3%[6]。子宫内膜异位症常被误诊为疝、血肿、肉芽肿[7]。
所有病例均经病理学证实为AWE,大部分以肿瘤—子宫内膜异位囊肿的形式存在[8]。本研究既往腹部手术史和症状出现之间的平均时间为71个月(3~167个月)。时间跨度大,与异位组织的活性与激素支持有关。我们发现结节大小与距腹部手术史的时间无明显关系。文献报道术后AWE结节是一个取决于个体差异的可变的生长模式[9]。在我们的研究中,患者年龄大于35岁的潜伏期长于年龄小于35岁的患者,而与月经复潮时间无明显关系。Pas等[10]报道潜伏期长短与患者发病年龄呈正相关,这可能与患者雌激素基础分泌量有关。
AWE特征性临床表现为腹部手术后发现与月经周期有关的腹壁下痛性硬结,即Esquivel三联征:腹壁下肿块、与月经相关的周期性疼痛和腹部手术史[4]。超声检查由于具有价格低及易操作,灵敏度92%[4]等优点,成为最主要的检查手段。超声发现腹壁下存在边界不清的低回声圆形或椭圆形结节,即使患者无子宫内膜异位症病史或腹部手术史,也应高度怀疑AWE,可以将超声探头压在结节上能否引起压痛来应进一步明确诊断[11]。文献报道,AWE的典型超声图像为:不均匀的圆形或椭圆形低回声结节,也可表现为多个小囊性区,或伴有纤维化改变(以强回声斑点或线样形式出现),周边可有强回声环或有毛刺样边缘,彩色多普勒检查可见多个血管蒂从不同的位点进入肿块,肿块中央区血管较丰富,而较小的子宫内膜病灶内血管相对少见或缺乏。形成这种典型特征的原因可能是由于长期的周期性出血,导致液体积聚形成低回声区,或由于出血本身触发的周围组织炎症和纤维化变化导致的病灶结节低回声区表现[12]。在我们的研究中,86%的病灶未见明显血流,可能是结节体积偏小和周围纤维化导致。仅有13例超声确定侵及深度,符合率69%。此外核磁和CT也有助于区分AWE与其他腹壁软组织块[13]。而核磁在术前确定周围组织浸润部位和深度有一定优势[14]。必要时可行超声引导细针穿刺,以排除恶性可能。血清CA125的升高可能提示AWE,但并不特异[6]。文献报道,CA125升高的子宫内膜异位症可能是由于脱落的子宫内膜异位细胞进入外周循环引起的[15],而AWE中由于病灶周围纤维化增生,形成局限性包裹,导致阳性率低于盆腔子宫内膜异位症。另外CA125水平与细胞增殖活性之间存在相关性,在腹膜或体积较大子宫内膜瘤的患者中CA125水平可升高。Karimi等[16]报道CA125高的子宫内膜异位症患者发生粘连的风险较高。我们研究中可能是由于筋膜型AWE与周围组织较重导致CA125相对较高。考虑到术前行CA125检查的患者样本例数少,且三型数量分布差异大,存在偏倚,应进一步增加CA125的检测例数。
腹膜型AWE结节体积大于筋膜型以及前鞘肌肉型,最大直径8 cm[6]。因此,我们在术前评估病变时,发现结节较大,且血清CA125值较低时,应高度警惕腹膜型的发生。腹膜型的手术出血量大于筋膜型及前鞘肌肉型,因此,可疑腹膜型的在术前备血及麻醉配合上应加以考虑。肌肉型的手术时间明显长于筋膜型,可能与病灶与肌肉的粘连松解有关,应注意术中严密止血。因此,在术前拟诊AWE的分型对手术的准备有指导意义。
AWE首选治疗为手术,距病灶边缘≥1 cm的局部广泛切除被认为是目前最佳的临床实践[10]。目前没有文献表明术后药物治疗能抑制复发[16]。药物治疗有效率低且停药后易复发。但也有学者认为,术前药物治疗可缩小病灶,达到根治性切除病灶的目的。在我们资料中有一例为GnRHa治疗后入院行手术治疗,术前结节直径缩小1.5 cm。术后如患者合并盆腔子宫内膜异位症,应继续药物治疗。其他治疗有高强度聚焦超声(HIFU)和经皮影像学引导下冷冻消融治疗。有研究报道HIFU和外科手术治疗AWE术后疼痛缓解率无差异,但HIFU治疗后无明显出血,有住院时间短,无疤痕,无麻醉等优点[17]。经皮影像学引导下冷冻消融治疗可在许多不能手术的AWE中应用,且腹壁完整性和功能均得以保留,并发症可能有腹壁缺损、脓肿形成,严重者可发生慢性盆腔疼痛[18]。然而,AWE有恶变的可能,因此必须在冷冻消融前行细针活检。在我们研究中,腹膜型患者结节大小最大为8 cm,采用连续缝合关闭腹膜,文献报道术中如出现腹膜缺损大可用网片进行腹壁修复。
文献给出了在术中减少子宫内膜异位组织种植的建议:将子宫移位至盆腔外进行子宫切开术;使用不同的缝合材料缝合子宫和其他部位;在术中避免清洁子宫腔,缝合子宫后应彻底清洗腹腔;剖宫产手术中注意避免宫腔内容物进入腹腔;关腹操作时可用高压盐水灌注伤口;并保护手术切缘以防止子宫内膜植入手术切口中[6]。在腹腔镜手术中所有组织都应在标本袋中取出,气腹应彻底放气,以减少压力能使腹腔的组织从套管针切口处播散的烟囱效应[19]。AWE复发率文献报道不一致,约为1.5%~9.1%[3],其中切缘阳性是复发的重要因素。AWE恶变率约0.3%~1%[20],子宫内膜异位症恶性转化的主要危险因素包括高龄、绝经状态、子宫内膜异位病灶直径>9 cm[21]。恶变类型和子宫内膜异位症相关卵巢癌类似,主要为透明细胞癌[8,23],AWE恶变后卡铂和紫杉醇联合化疗是首选治疗。
综上所述,为降低AWE的发生,应在腹部手术中注意避免子宫内膜的播散,尤其是在剖宫产手术中。在腹部手术后出现与月经周期有关的腹壁下痛性硬结,应高度怀疑AWE的发生,可选用超声及血清CA125的检查明确分型及诊断。治疗以手术为主,尽可能在病灶周围1cm切除,术后追加GnRHa治疗对防止复发作用有限。

