乳腺癌侵袭转移中Artemin作用的探讨
张路漫 ,田 刚 ,魏殿军
(1.天津医科大学研究生院,天津300070;2.天津市公安医院检验科,天津300010;3.天津医科大学第二医院检验科,天津300211;4.天津医科大学医学检验学院,天津300010)
近年来由于工作节奏的加快和生活环境的变迁,影响女性身心健康的恶性肿瘤发病呈上升趋势,据不完全统计生殖系统恶性肿瘤占女性新发癌症总数的将近一半。乳腺癌居女性各类恶性肿瘤死亡率之首,侵袭转移是恶性肿瘤加重病情变化的主因,如何早期发现乳腺癌病灶,抑制瘤细胞血道淋巴道远端转移成为各研究机构的焦点问题。神经胶质细胞源性神经营养因子(GDNF)家族配体中Artemin(ARTN)作用独特,目前的研究表明,ARTN是一个癌基因,在不同的肿瘤组织中表达水平有所不同,该基因在肿瘤组织中的异常激活可能与肿瘤的发生、发展、侵袭和转移相关[1]。ARTN在乳腺癌侵袭转移中的作用,国内尚少见报道。本研究试图从ARTN角度探索其与乳腺癌侵袭转移的关系,为早期诊断乳腺癌遏制其发生提供一些有价值数据。
1 材料与方法
1.1 材料
1.1.1 组织标本和细胞系 乳腺癌组织标本来自天津市公安医院2000年6月-2010年6月手术切除的39例乳腺癌患者。其对应的乳腺癌旁正常组织标本作为对照组。调阅住院乳腺癌患者病历,结合随访资料完善基本资料分析。乳腺癌MDA-MB-231细胞株由天津医科大学实验中心惠赠。
1.1.2 主要试剂和仪器 细胞培养基(Hyclone公司);Artemin(abcam Biotechnology公司);兔抗人β-actin多克隆抗体(Invitrogen公司)。超净工作台(细胞培养专用,中国Air Tech);Olympus IX70倒置显微镜(日本 Olympus);转膜仪:(Bio-Rad);凝胶成像系统 (Kodak 440CF);ID KODAK凝胶成像系统(美国Kadak公司);Transwell小室(美国Millipore公司)。
1.2 方法
1.2.1 细胞培养 人乳腺癌细胞系MDA-MB-231用含 10%NBS、100 μg/mL 链霉素、100 U/mL 青霉素的RPMI-1640培养,在37℃、5%CO2细胞培养箱中每48 h更换培养液1次。细胞进入对数生长期后,胰酶消化成熟细胞后清洗死细胞,用1 mL完全培养基终止消化后吹打为单细胞悬液,接种到6孔板内继续培养准备后序试验。
1.2.2 siRNA质粒转染 把对数生长期的适量细胞平铺到培养皿中,温箱培养24 h;用移液枪旋转加入 1.6 μg 质粒和 4 μL Lipofectamin 2000,混匀后室温放置20 min;细胞表面滴加质粒DNA-脂质体复合物,轻轻摇匀培养皿后放5%CO2孵化箱内培养,6 h后换成普通1640培养液;细胞转染24 h后传代;贴壁细胞加入HygromycinB,荧光筛选单克隆细胞[2]。
1.2.3 免疫组化检测Artemin表达 应用免疫组化检测临床乳腺癌标本石蜡切片中Artemin蛋白表达情况。按照操作说明书进行,染色浅黄至棕黄色为阳性细胞。
1.2.4 划痕实验 细胞平铺6孔培养板孵育过夜,待细胞对数生长期铺满培养皿后,沿比例尺用移液枪对培养基中贴壁细胞划线。散落的破碎细胞用PBS冲洗,加入无血清培养基放培养箱中饥饿细胞。0 、6、9、12、24 h 测量划痕处细胞愈合距离,不同的测定点取均值后绘制曲线。
1.2.5 趋化运动实验 在趋化小室的下室加入用含0.5%精制胎牛血清的培养液配置不同浓度的EGF溶液,混匀的细胞悬液加入上室。37℃CO2培养箱孵育2 h后弃去未粘附细胞,固定染色后倒置显微镜下观察穿膜细胞。
1.2.6 粘附实验 细胞消化计数后离心,重悬于培养基配成密度为2.7×105个/mL细胞悬液。不同浓度EGF刺激后冰浴终止反应,固定染色后镜下计数粘附细胞数。
1.2.7 细胞侵袭实验 Transwell小室中加入已融化的Matrigel胶。将细胞重调浓度加入上室,下室加入含10%血清的培养基,37℃孵育48 h后,去除未穿膜的细胞,固定细胞后结晶紫染色,显微镜下观察穿膜细胞数。
1.3 统计学分析 研究资料用SPSS 11.0软件进行处理,组间比较采用方差分析或t检验进行分析。
2 结果
2.1 免疫组化检测Artemin在乳腺癌组织中表达 39例乳腺疾病患者其中淋巴结转移的26例,淋巴结未转移的13例。在26例淋巴结转移病例中,有24例Artemin表达阳性(P=0.003)。然而,在无淋巴结转移13例病例中,只有1例Artemin表达阳性(图1)。提示Artemin的表达与乳腺癌转移具有相关性。本研究未发现Artemin的表达与肿瘤大小有关。
2.2 siRNA技术分析MDA-MB-231细胞中Artemin表达情况
2.2.1 Artemin降表达的MDA-MB-231细胞蛋白表达水平 稳定转染MDA231细胞而获得siATRN-MDA231,同时用一段无关序列转染MDA231细胞作为阴性对照(scr表示)。用Western blot检测Artemin的表达情况。和scr/MDA231细胞比较,siATRN-MDA231细胞Artemin的蛋白表达水平明显降低。
2.2.2 Artemin表达降低对MDA-MB-231细胞迁移和定向运动能力影响 siATRN-MDA231细胞迁移和定向运动能力明显比对照组降低(图2)。
2.2.3 Artemin降表达对细胞趋化运动影响 Artemin降表达的细胞趋化运动能力降低(图3)。
2.2.4 Artemin降表达对MDA231细胞粘附能力影响 粘附于纤维粘连蛋白的scr/MDA231细胞数量在EGF刺激下经5和15 min的不同间隔明显增加。siATRN-MDA231细胞经过相同的EGF刺激时间间隔有较少的数量增加(图4)。
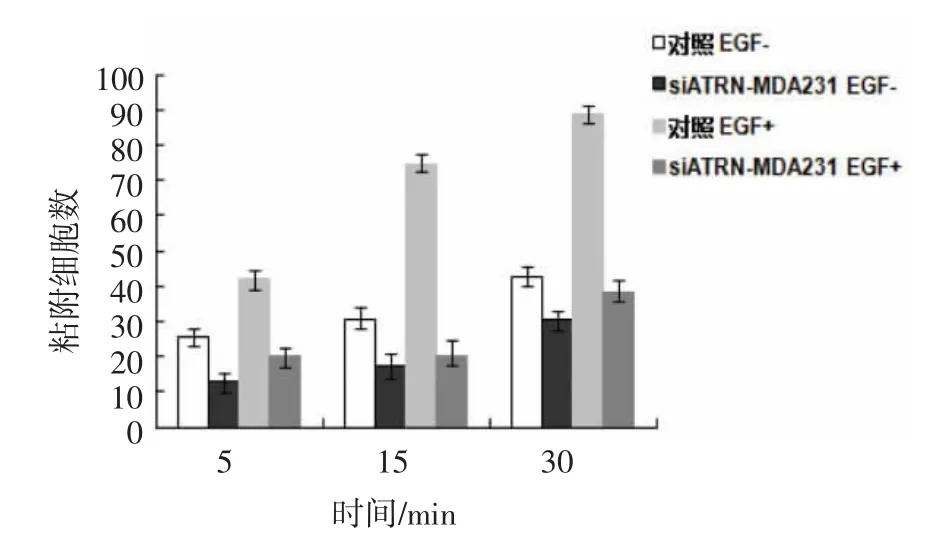
图4 Artemin降表达对MDA231细胞粘附能力影响Fig 4 Effect of Artemin down-expressin on adhesion of MDA231
2.2.5 siATRN-MDA231细胞侵袭能力观察 对照组和siATRN-MDA231细胞平均视野侵袭细胞数量之比为250.65/52.22个,siATRN-MDA231细胞穿透matrigel胶的能力明显低于对照组,与对照组相比侵袭能力下降了 76.5%(P<0.01)(图5)。
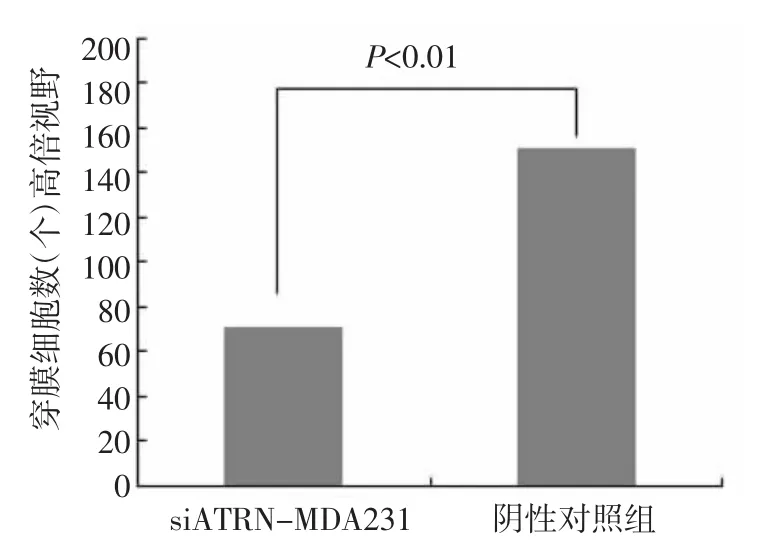
图5 siATRN-MDA231细胞侵袭能力变化Fig 5 Change in invasion of siATRN-MDA231 cells
3 讨论
在西方乳腺癌是最普通的恶性肿瘤之一,在患有恶性肿瘤的妇女死亡病例中位于第二位。近年来我国乳腺癌的发病率有上升的趋势。如何预防乳腺癌发病,特别能尽早有效抑制癌细胞转移,是治疗乳腺癌的关键问题。
Artemin(ARTN)是一种神经胶质细胞源性神经营养因子(GDNF)家族配体,目前的研究表明,ARTN是一个癌基因,在不同的肿瘤组织中表达水平有所不同,该基因在肿瘤组织中的异常激活可能与肿瘤的发生、发展、侵袭和转移相关[3]。研究表明:ARTN与非神经源性恶性肿瘤发生关系密切[4]。近年来研究发现ARTN在消化系统和呼吸系统恶性肿瘤中的表达能够促进癌细胞的侵袭能力,进一步的研究证实ARTN是神经旁分泌的重要调控因子[5]。在生殖系统恶性肿瘤的研究中国外学者研究证实ARTN在多个乳腺癌细胞系中表达,过表达该基因的乳腺癌细胞的克隆形成能力、侵袭能力均明显增加;高表达ARTN的患者总生存率明显低于阴性患者,且与肿瘤的复发、远端转移相关[6]。在子宫内膜癌中的表达明显高于正常的子宫内膜组织,进一步的研究表明,子宫内膜癌细胞高表达ARTN增加细胞的侵袭能力可能与AKT1表达水平的增高相关[7]。
本研究对乳腺浸润性导管癌组织切片进行免疫组化分析发现,Artemin在有无淋巴结转移的乳腺癌组织中表达差别明显,有淋巴结转移的乳腺癌组织处Artemin染色深棕黄色,预示表达水平偏高。说明Artemin的表达水平的高低与淋巴结转移与否关系密切。这些充分印证Artemin参与肿瘤的发生和转移。
在乳腺癌细胞系MDA231中,下调Artemin的乳腺癌细胞的迁移和定向运动能力与对照组相比明显降低,乳腺癌细胞的趋化和粘附能力也显著下降。siATRN-MDA231细胞穿透matrigel胶的能力明显低于对照组,与对照组相比侵袭能力下降了76.5%(P<0.01)。表明Artemin对乳腺癌的侵袭和转移作用是不可或缺的。
乳腺癌发病机制主要涉及肿瘤细胞的粘附、迁移、细胞外基质降解、新生血管形成及癌基因和肿瘤抑制基因的异常表达等方面。癌细胞基因调控存在于染色体水平、转录水平、翻译水平中一个或多个层次,其中以转录水平的调控最为重要。ATRN在乳腺癌侵袭转移中的作用,国内尚少见报道。本研究试图从ATRN角度探索其与乳腺癌侵袭转移的关系,为遏制乳腺癌发生提供一些有价值的信息。

