养猪业常用抗生素的发光细菌急性毒性研究
曾 卓, 施 城, 施一妃, 郑 平
(1.浙江大学 环境工程系, 杭州 310058; 2.浙江大学 临床医学系, 杭州 310058)
随着集约化养猪业的发展,兽用抗生素被广泛使用。抗生素是一类由微生物代谢产生,能抑制其它微生物生长和代谢的物质,可用来治疗和预防疫病。亚治疗水平的抗生素常用作饲料添加剂,以期提高猪的生长速率和饲料效率[1-2]。在我国农业部颁布的《饲料药物添加剂使用规范》中,允许长期饲用的抗生素多达33种,允许医用的抗生素也达24种[3]。限于我国养猪业的饲养水平,许多养猪业主都将抗生素视为防控疫病的唯一手段,导致抗生素滥用现象极为普遍。抗生素随排泄物进入废水,可抑制微生物生长和代谢,从而影响废水生物处理[4]。
养猪业是主要的农业污染源。猪场废水通常采用生物处理,达到排放标准后进入纳污管道或受纳水体[5]。据文献报道,猪场废水中的抗生素会对生物处理系统中的污染物降解菌产生明显的抑制作用。孙建平等发现,猪场废水中存在10 mg·L-1阿莫西林时,试验组的最大甲烷产率只有不含阿莫西林的对照组的41%[6]。Lallai[7]等发现,浓度为80 mg·L-1的甲砜霉素会导致猪场粪浆厌氧消化的累积产甲烷量减少40%。抗生素对废水生物处理的影响不容忽视,值得系统研究。
发光细菌(Luminescent bacterium)是一种能发生荧光的微生物,Photobacteriumphosphoreum是发光细菌的典型代表。P.phosphoreum的发光机理是黄素单核苷酸(FMNH2)与荧光素酶(luciferase)结合,在氧气的作用下,形成结合于荧光素酶上的4a-过氧化黄素复合体(a luciferase-bound 4a-peroxyflavin),该复合体再与脂肪醛反应,生成一种稳定的中间产物,这种中间产物缓慢分解,释放光子[8]:
在正常生长条件下,发光细菌的发光强度稳定。但遇到外来毒性物质时,发光细菌的发光强度衰减,衰减程度与抑制强度正相关。发光细菌急性毒性测试法具有成本低、速度快和灵敏度高等优点,已广泛用于医药、农药、食品添加剂等急性毒性的测试[9~11]。但迄今为止,还未见发光细菌急性毒性测试法应用于养猪业常用抗生素急性毒性测试的报道[12]。有鉴于此,笔者采用发光细菌急性毒性测试法,系统地检测了7类,9种兽用抗生素的急性毒性,并分析了所试抗生素的毒性机理,以期为猪场废水生物处理工程的设计和优化提供理论依据和技术参数。
1 材料与方法
1.1 材料
1.1.1 试剂
盐酸金霉素(USP级)、氯霉素(98%)、青霉素G钠(1650 U·mg-1)、恩诺沙星(98%)、杆菌肽(Titer> 60 Units·mg-1)、硫酸链霉素(720 IU·mg-1)、硫酸多粘菌素E(USP级)、氟苯尼考(≥99%)、林可霉素(95%)均购于上海阿拉丁生化科技股份有限公司。NaCl,NaOH,HCl,乙酸均为分析纯。
1.1.2 菌种
明亮发光杆菌(Photobacteriumphosphoreum)T3变种,购自中国科学院南京土壤研究所。菌液制备过程如下:将保存在4℃下的发光细菌冻干粉用1.0 mL,4℃的2%NaCl溶液复苏,将菌液冰浴保存,30 min后检测菌液的发光强度。菌液的初始发光强度应在600~1900 mV,若低于600 mV时,可将DXY22生物毒性测试仪的倍率调至“×2”档,若高于1900 mV,可将倍率调至“×0.5”档,若仍不达标,则更换冻干粉。
1.1.3 仪器
DXY22型生物毒性测试仪(中国科学院南京土壤研究所);pH计(METTLER TOLEDO);10μL微量进样器(Agilent公司)。
1.2 抗生素的急性毒性测定
控制室温在20℃~25℃,首先用3% NaCl溶液分别将水溶性抗生素配成500 mg·L-1母液,用0.1 mol ·L-1的NaOH 或0.1 mol·L-1的HCl溶液调节母液pH值至6.98~7.02,配置成不同的浓度梯度。以3% NaCl溶液作为空白对照,将空白对照和各浓度抗生素溶液各取2 mL于测试管中,做3组平行。用微量注射器依次取10 μL发光细菌菌液于各测试管中,振荡混匀,15 min后用生物毒性测试仪测定发光强度[13]。
对于不溶于水的抗生素:氟苯尼考,先用1 mL乙酸溶解,然后用3% NaCl溶液配制浓度为100 mg·L-1母液,再制成20,40,60,80,100 mg·L-1的梯度浓度溶液,对应的乙酸浓度是2,4,6,8,10 g·L-1。同时将乙酸用3% NaCl溶液稀释成梯度浓度溶液,测试乙酸的毒性。测定过程与水溶性抗生素一致。
1.3 数据处理
通过空白对照发光度(相对发光单位RLU 表示)的平均值RLU0和各浓度3组平行样发光度的平均值RLU,计算发光细菌的相对抑制率X(%), 即:

采用Originlab 统计软件对抗生素浓度与相对抑制率进行线性回归,用直线内插法求出抑制率为50% 时所对应的抗生素浓度,即为该种抗生素对发光细菌的半抑制浓度(IC50)。
2 结果
在2.00~10.00 g·L-1浓度范围内,林可霉素对发光细菌的发光抑制率如图1所示。根据拟合方程,算出IC50为19.45 g·L-1。在1.00~8.00 g·L-1浓度范围内,青霉素G钠对发光细菌的发光抑制率如图1~图3所示。根据拟合方程,算出IC50为10.10 g·L-1。在0.50~2.00 g·L-1浓度范围内,杆菌肽对发光细菌没有显著的抑制作用,甚至可促进发光细菌的发光强度;但在2.00~8.00 g·L-1浓度范围内,杆菌肽具有抑制作用,IC50为6.91 g·L-1。

图1 林可霉素与发光抑制率的关系

图2 青霉素G钠与发光抑制率的关系

图3 杆菌肽浓度与发光抑制率的关系
在200~600 mg·L-1浓度范围内,氯霉素对发光细菌的发光抑制率见图4,算出IC50为473 mg·L-1。在100~275 mg·L-1浓度范围内,恩诺沙星对发光细菌的发光抑制率见图5,算出IC50为157 mg·L-1。在100~500 mg·L-1浓度范围内,硫酸链霉素对发光细菌的发光抑制率见图6,算出IC50为142 mg·L-1。在20~100 mg·L-1浓度范围内,不溶于水的抗生素氟苯尼考对发光细菌的发光抑制率见图7,算出IC50为95 mg·L-1。

图4 氯霉素与发光抑制率的关系

图5 恩诺沙星与发光抑制率的关系

图6 硫酸链霉素与发光抑制率的关系
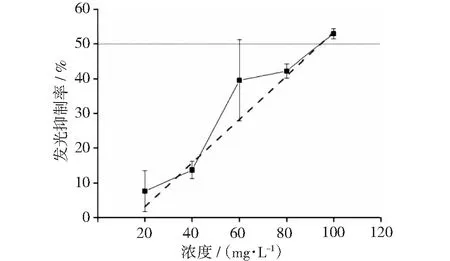
图7 氟苯尼考浓度与发光抑制率的关系

图8 盐酸金霉素与发光抑制率的关系
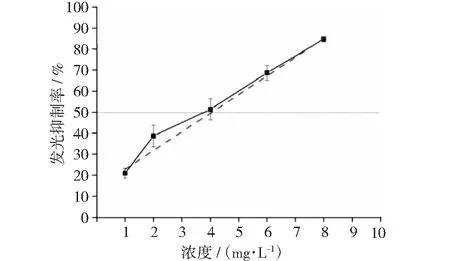
图9 硫酸多粘菌素E与发光抑制率的关系
在5~20 mg·L-1浓度范围内,盐酸金霉素对发光细菌的发光抑制率如图8所示,算出IC50为12 mg·L-1。在1~8 mg·L-1浓度范围内,硫酸多粘菌素E对发光细菌的发光抑制率如图9所示,算出IC50为4 mg·L-1。
乙酸的毒性也被考察,乙酸的浓度(5.00~40.00 g·L-1)与发光细菌的发光抑制率呈现非线性增长关系(见图10)。但在浓度范围5.00~20.00 g·L-1内,乙酸浓度与发光细菌的发光抑制率呈线性增长关系,IC50为12.35 g·L-1。表1总结了9种抗生素和乙酸在线性变化区域的浓度与发光抑制率的拟合方程,并给出了IC50。
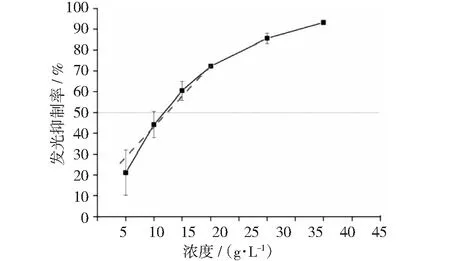
图10 乙酸浓度与发光抑制率的关系
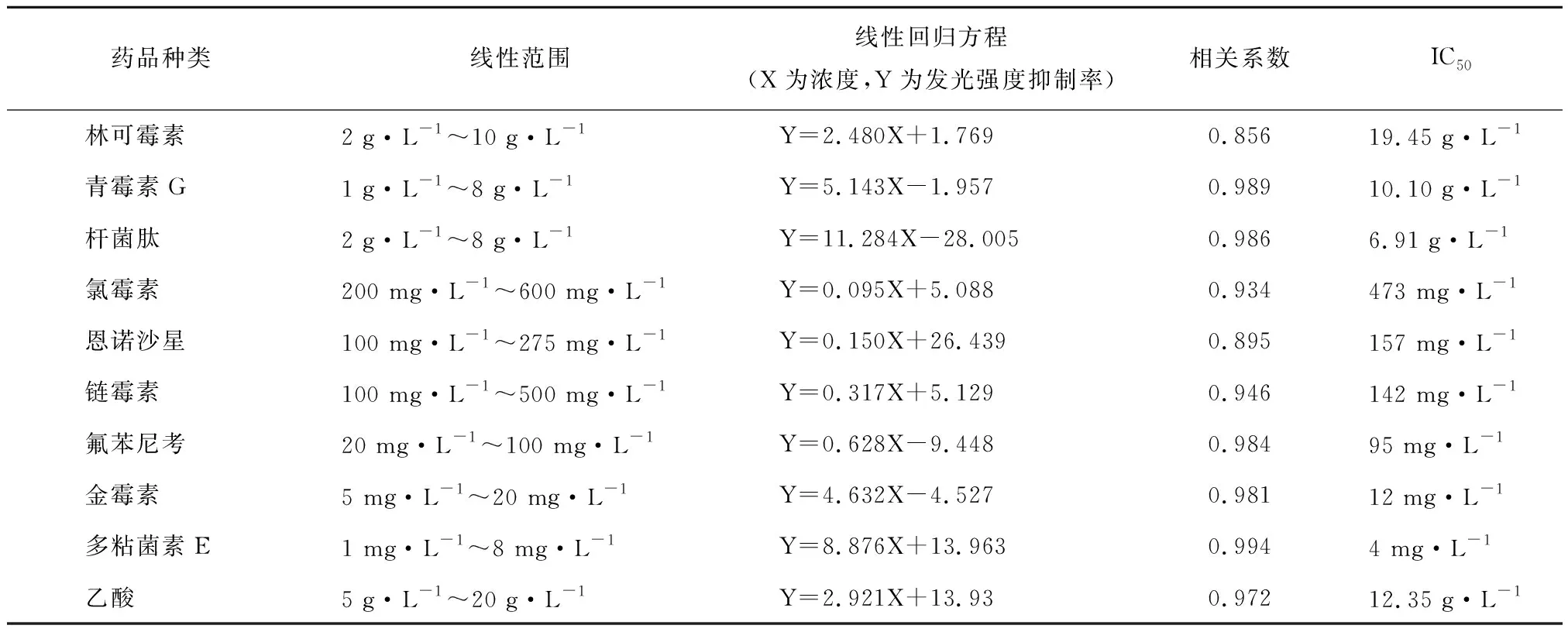
药品种类线性范围线性回归方程(X为浓度,Y为发光强度抑制率)相关系数IC50林可霉素2 g·L-1~10 g·L-1Y=2.480X+1.7690.85619.45 g·L-1青霉素G1 g·L-1~8 g·L-1Y=5.143X-1.9570.98910.10 g·L-1杆菌肽2 g·L-1~8 g·L-1Y=11.284X-28.0050.9866.91 g·L-1氯霉素200 mg·L-1~600 mg·L-1Y=0.095X+5.0880.934473 mg·L-1恩诺沙星100 mg·L-1~275 mg·L-1Y=0.150X+26.4390.895157 mg·L-1链霉素100 mg·L-1~500 mg·L-1Y=0.317X+5.1290.946142 mg·L-1氟苯尼考20 mg·L-1~100 mg·L-1Y=0.628X-9.4480.98495 mg·L-1金霉素5 mg·L-1~20 mg·L-1Y=4.632X-4.5270.98112 mg·L-1多粘菌素E1 mg·L-1~8 mg·L-1Y=8.876X+13.9630.9944 mg·L-1乙酸5 g·L-1~20 g·L-1Y=2.921X+13.930.97212.35 g·L-1
3 讨论
本课题测定了7大类,9种抗生素对发光细菌的急性毒性。它们分别是β-内酰胺类:青霉素G;林可酰胺类:林可霉素;多肽类:杆菌肽、多粘菌素E;氨基糖苷类:链霉素;四环素类:金霉素;氯霉素类:氯霉素、氟苯尼考;喹诺酮类:恩诺沙星。借鉴环境毒物的毒性分类标准,9种抗生素可分为3类:轻度毒性(IC50>500 mg·L-1)的抗生素有:林可霉素、青霉素G钠和杆菌肽;中度毒性(500 mg·L-1> EC50>50 mg·L-1)的抗生素有:氯霉素、恩诺沙星、链霉素和氟苯尼考;高度毒性(50 mg·L-1> EC50>1 mg·L-1)的抗生素有:金霉素和多粘菌素E。
青霉素G的作用靶点是细菌细胞膜上的青霉素结合蛋白(PBP)。PBP参与细菌细胞壁的合成、维持和调整。青霉素G钠通过抑制PBP从而阻碍细胞壁合成,导致细菌细胞渗透裂解[14]。杆菌肽的作用靶点是C55-O-PO3。C55是细胞膜上的脂质载体,在细胞壁合成过程中起着转移肽聚糖单体(二糖五肽单元)的作用。杆菌肽与C55-O-PO3形成配合物,阻断C55再生循环,从而阻碍细胞壁合成[15-16]。林可霉素不可逆地结合于细菌核糖体的50S亚基,从而抑制细菌蛋白质合成。这3种抗生素的IC50>500 mg·L-1,说明其对发光细菌的毒性很小。据报道,青霉素G和杆菌肽主要抑制革兰氏阳性细菌,林可霉素仅抑制革兰氏阳性细菌[16-17]。试验所用的P.phosphoreum是一种革兰氏阴性细菌,因此3种抗生素无明显抑制效应。
恩诺沙星属喹诺酮类抗生素,其抑菌机理是抑制细菌拓扑异构酶Ⅱ(DNA促旋酶),阻碍DNA复制而停止细菌繁殖,对革兰氏阴性细菌和阳性细菌都有抗菌效果[18-19]。链霉素属于氨基糖苷类抗生素,可在许多环节抑制细菌蛋白质的合成。氨基糖苷类抗生素可抑制70S上转录起始复合物的形成;选择性地结合于30S亚基的靶蛋白上,导致mRNA错译;阻碍终止因子与核蛋白体结合,难以释放所合成的肽链。在氨基糖苷类抗生素中,链霉素的抗菌谱较窄,但可有效抑制革兰氏阴性细菌[18]。
氯霉素和氟苯尼考同属于氯霉素类的抗生素,其作用机理相似,都是结合于细菌核糖体上的50S亚基,抑制蛋白质合成[20-21]。两者对革兰氏阳性细菌和阴性细菌均有抑制效果[18]。氟苯尼考不溶于水,以乙酸溶解后需考虑乙酸的毒性。从图4中可以看出,乙酸对发光细菌也有抑制作用,其抑制机理是:在一定pH值条件下,未解离的乙酸可直接跨膜进入细胞质内,消除膜内外质子浓度差,阻碍ATP合成[22]。氟苯尼考的IC50=95 mg·L-1,而乙酸的IC50=12.35 g·L-1。氟苯尼考的抑制作用是氟苯尼考和乙酸联合作用的结果,但主要是氟苯尼考的贡献。
金霉素属于四环素类抗生素,作用机理是干扰细菌蛋白质的合成,还可引起细胞膜通透性的改变,造成细胞质成分外漏。金霉素可抑制革兰氏阴性细菌和阳性细菌[23]。金霉素对发光细菌的毒性很大,IC50为12 mg·L-1。多粘菌素E的抑菌机理是其聚阳离子环与脂多糖的脂A发生作用,插入细胞膜的磷脂层中,破坏细胞的完整性。多粘菌素E分子带有5个正电荷,可穿透革兰氏阴性细菌的细胞外膜和内膜,毒性很大,IC50只有4 mg·L-1 [24-25]。
养猪业常用9种抗生素的抑菌机理和抗菌谱见表2。从半抑制浓度看,当废水中含有轻度毒性抗生素:青霉素G,杆菌肽和林可霉素时,对生物处理功能菌的影响不大;当残留中度毒性抗生素:链霉素、恩诺沙星、氯霉素、氟苯尼考时,需要检测其浓度,以确定是否产生抑制作用;当残留高度毒性抗生素:金霉素和多粘菌素E时,应采取预处理措施消除抗生素活性再进行生化处理。

表2 养猪业常用抗生素的抗菌机理和抗菌谱
注:G+菌指革兰氏阳性菌;G-菌指革兰氏阴性菌。
4 结论
采用发光细菌急性毒性测试法,测定了养猪业常用的9种抗生素的急性毒性,试验证明,9种抗生素的急性毒性大小为:多粘菌素E >金霉素 >氟苯尼考 >恩诺沙星 >链霉素 >氯霉素 >杆菌肽 >青霉素G >林可霉素。林可霉素、青霉素G和杆菌肽有轻度急性毒性,IC50分别为19.45 g·L-1,10.10 g·L-1,6.91 g·L-1;氯霉素、链霉素、恩诺沙星和氟苯尼考有中度急性毒性,IC50分别为473 mg·L-1,142 mg·L-1,157 mg·L-1和95 mg·L-1;金霉素和多粘菌素E有高度急性毒性,IEC50分别为12 mg·L-1和4 mg·L-1。

