O-季铵化硫脲壳寡糖的制备及与鲱鱼精DNA的相互作用
冯小强, 李小芳, 朱元成, 王红玉
(天水师范学院 化学工程与技术学院, 甘肃 天水 741001)
壳寡糖(COS)是一种来源丰富、无毒、可吸收降解的碱性氨基多糖, 具有生物降解性、生物相溶性和抗菌等多种生理功能活性[1-2], 在食品工业、纺织、化工、生物工程和医药等领域应用广泛[3]. 由于壳寡糖分子链中存在大量的功能基团羟基(—OH)和氨基(—NH2), 易形成分子间与分子内稳定的氢键, 因此影响壳寡糖的部分活性[4]. 壳寡糖的季铵化是一种重要的改性方法, 由于N-季铵化壳寡糖在氨基上进行反应, 影响壳寡糖氨基自身的聚阳离子型, 从而影响其抗菌能力. 因此, 仅在壳寡糖C3和C6上的羟基进行O-季铵化改性, 可保持壳寡糖C2上氨基自身聚阳离子性及形成双抗菌活性基团结构[5-6], 以得到具有更高活性的衍生物.
DNA作为抗癌、抗肿瘤药物的主要靶点[7], 其药效与DNA的嵌插键合方式及作用程度有关[8]. 近年来, 新型药物与DNA的作用方式已引起人们广泛关注. 研究药物分子与DNA间的作用方式有助于了解药物抗病的作用机理, 为设计和合成新型抗病药物提供理论依据. 本文先在壳寡糖化学结构的氨基上引入硫脲, 得到氨基硫脲壳寡糖(TUCS), 再在C3和C6的羟基上引入季铵盐基团, 得到O-季铵化硫脲壳寡糖(QTUCS), 并考察QTUCS与鲱鱼精DNA之间的作用方式.
1 实 验
1.1 主要试剂和仪器
硫脲(西安化学试剂厂, 分析纯); 环氧氯丙烷(汕头陇西化工厂, 分析纯); 2,3-环氧丙基三甲基氯化铵(萨恩化学技术上海有限公司, 分析纯); 壳寡糖(济南海得贝海洋生物工程有限公司,M<5 000); 鲱鱼精DNA(美国Sigma公司, 生化试剂).
UV-2450型紫外可见光谱仪(日本岛津公司); 热重-差热分析(TG-DTA)仪(美国Perkin Elmere公司); Spectrum One型Fourier红外光谱仪(美国Perkin Elmere公司); CH1612C型电化学分析仪(上海辰华仪器有限公司).
1.2 QTUCS的制备
称取1.30 g壳寡糖溶于50 mL蒸馏水中, 加入4 mL环氧氯丙烷, 室温下磁力搅拌1 h. 称取1.51 g硫脲溶于18 mL无水乙醇中, 加入上述反应体系中, 磁力搅拌, 70 ℃回流5 h. 反应结束后冷却, 抽滤, 将所得样品先用体积分数为95%的乙醇于索式提取器回流提取4 h后, 再用丙酮溶液浸泡12 h, 抽滤, 将得到的样品于60 ℃电热恒温干燥, 即为TUCS, 产率为59.02%.
称取0.80 g TUCS溶于40 mL异丙醇中, 置于装有磁力搅拌器和回流装置的三颈烧瓶中, 缓慢滴加4 mL质量分数为40%的氢氧化钠溶液, 水浴加热并搅拌, 使体系温度在55 ℃下恒温碱化4 h. 升温至60 ℃后, 缓慢多次滴加16 mL质量分数为40%的2,3-环氧丙基三甲基氯化铵溶液, 继续反应4 h. 将反应液先用1 mol/mL的盐酸溶液调节pH至中性, 过滤, 再用体积分数为85%的乙醇反复浸泡、洗涤, 最后将滤饼于温度不低于90 ℃的烘箱中烘干, 即得产物QTUCS, 产率为46.86%, 合成路线如图1所示.
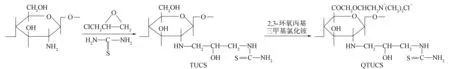
图1 QTUCS的合成路线Fig.1 Synthetic route of QTUCS
1.3 QTUCS与鲱鱼精DNA的作用
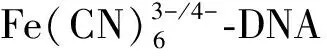
R=ρ(QTUCS)/ρ(DNA).
2 结果与讨论
2.1 QTUCS的表征
图2为QTUCS的红外光谱. 由图2可见, COS原位于1 664 cm-1处较强的酰胺吸收峰和1 599 cm-1附近的 —NH2面内弯曲振动吸收峰, 在QTUCS中分别移至1 633 cm-1和1 603 cm-1处, 峰形变窄. QTUCS在2 924~2 834 cm-1及1 419 cm-1和1 366 cm-1处分别产生了新的吸收峰, 归属为甲基和亚甲基产生了新的吸收峰, 同时C—H的伸缩振动吸收峰, 表明COS中引入了羟丙基三甲基氯化铵的季铵盐侧链. 此外, QTUCS在1 478 cm-1处出现弱的吸收峰, 表明COS中引入了硫脲基团.
以体积分数为1%的醋酸分别作为溶剂和参比, 在190~500 nm内扫描COS,TUCS和QTUCS的紫外光谱, 结果如图3所示. 由图3可见, COS在233.0,274.5 nm处出现两个较弱的吸收峰, TUCS在238.5,273.15 nm处出现两个较强的吸收峰, QTUCS在280.0 nm处出现一个较强的吸收峰, 与COS和TUCS的吸收峰相比, QTUCS的峰位发生了红移, 且吸收强度增加; 同时, QTUCS在213.5 nm处出现一个较弱的吸收峰.
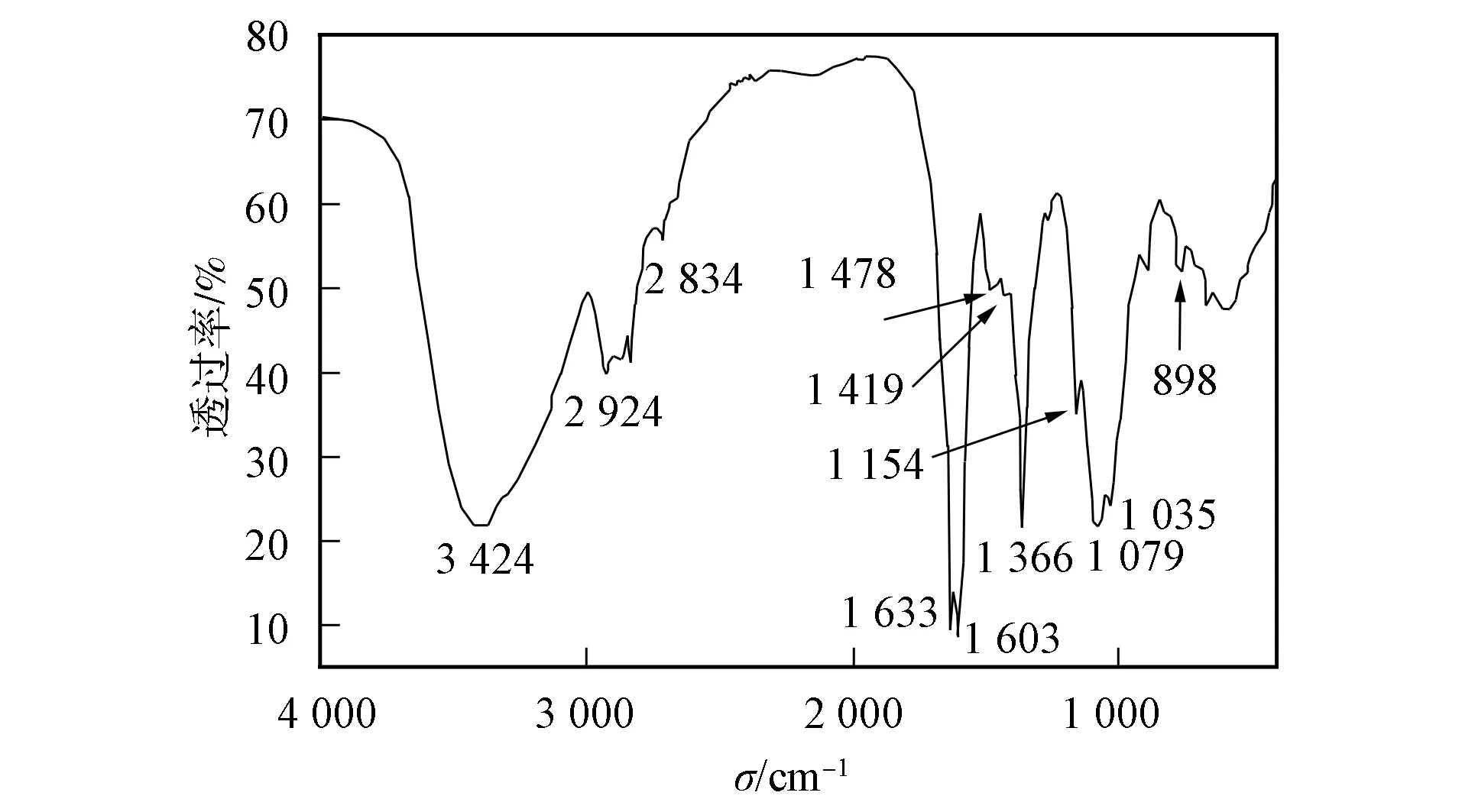
图2 QTUCS的红外光谱Fig.2 IR spectrum of QTUCS
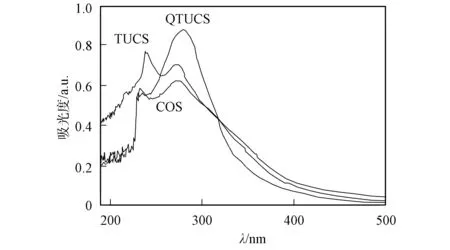
图3 COS,TUCS和QTUCS的紫外-可见吸收光谱Fig.3 UV-Vis absorption spectra of COS,TUCS and QTUCS
在氮气保护下, 以10 ℃/min升温至900 ℃, 测定QTUCS的TG-DTG曲线, 结果如图4所示. 由图4可见, QTUCS的热分解分为两个阶段: 第一阶段, 在165 ℃附近有明显的失重现象, 其失重率为25.9%, 在DTG曲线上的65.5 ℃处有一个放热峰, 这是由于QTUCS失去吸附水和自由水所致; 第二阶段, 在180~550 ℃有47.3%的失重, 在DTG曲线上的266 ℃处有一个很强的放热峰, 可能是由于QTUCS中支链的氧化分解所致. 550 ℃后的热重曲线较平缓, 当温度升至900 ℃时, 仍有18.6%的质量剩余.
2.2 QTUCS与鲱鱼精DNA的作用方式
2.2.1 QTUCS与鲱鱼精作用的紫外-可见吸收光谱 QTUCS与鲱鱼精DNA相互作用的紫外-可见吸收光谱如图5所示. 由图5可见, QTUCS在238.5 nm(吸光度为1.02)和280.20 nm(吸光度为1.36)处有明显的特征吸收峰. 在加入100 μL质量浓度为1 mg/mL的鲱鱼精DNA后, QTUCS于238.5 nm处的吸收峰蓝移至233.5 nm处, 吸收峰强度减色至0.661; 当加入200 μL鲱鱼精DNA后, QTUCS的吸收峰分别蓝移至230.0,272.0 nm处, 吸收峰强度分别减色至0.55,0.88. 由于DNA碱基与嵌入其中的有机小分子产生电子相互作用, 耦合后的π*轨道因部分填充电子, 使π→π*跃迁几率减小, 产生了减色效应[11]. 因此, QTUCS与鲱鱼精DNA间以嵌入方式发生作用.
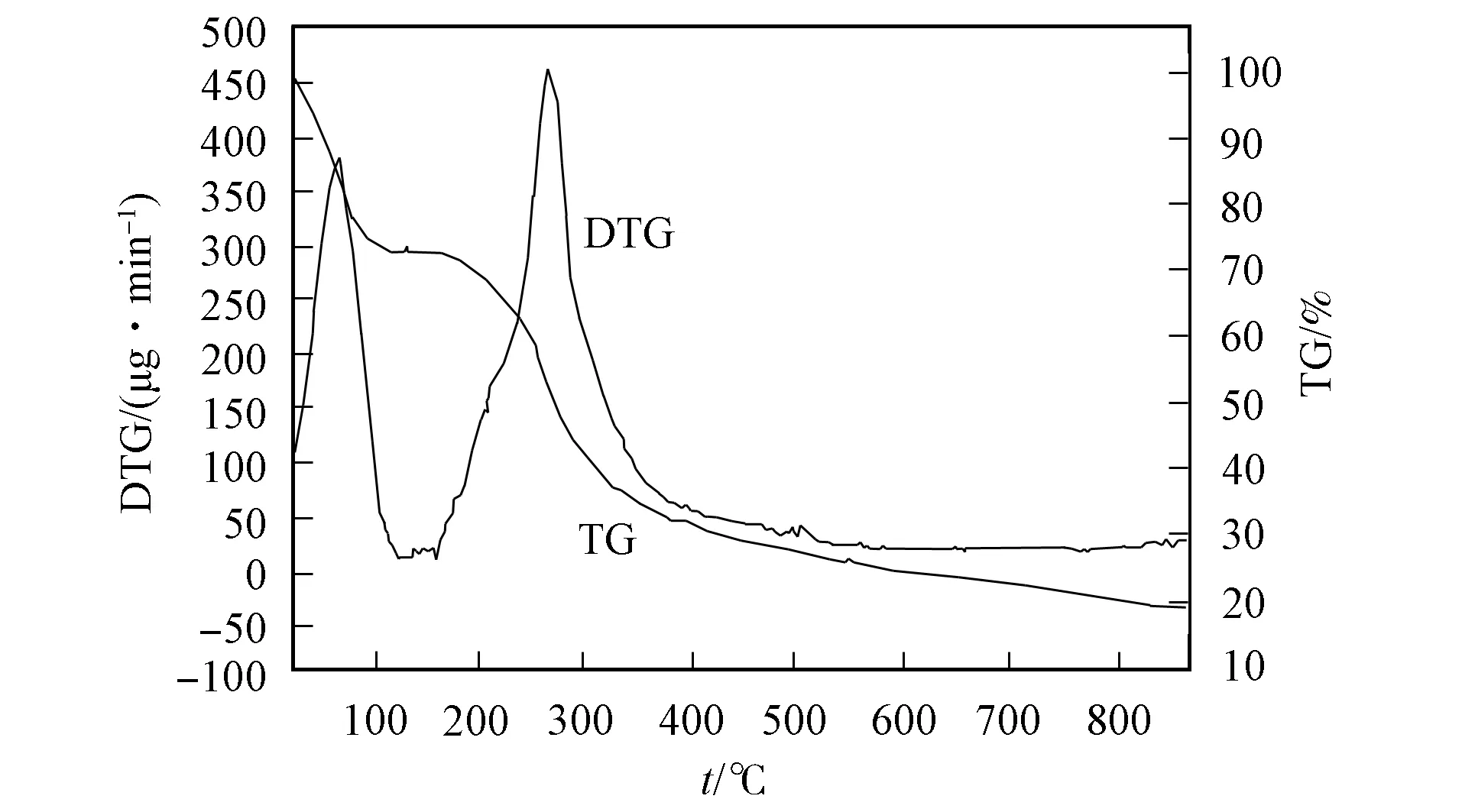
图4 QTUCS的TG-DTG曲线Fig.4 TG-DTG curves of QTUCS
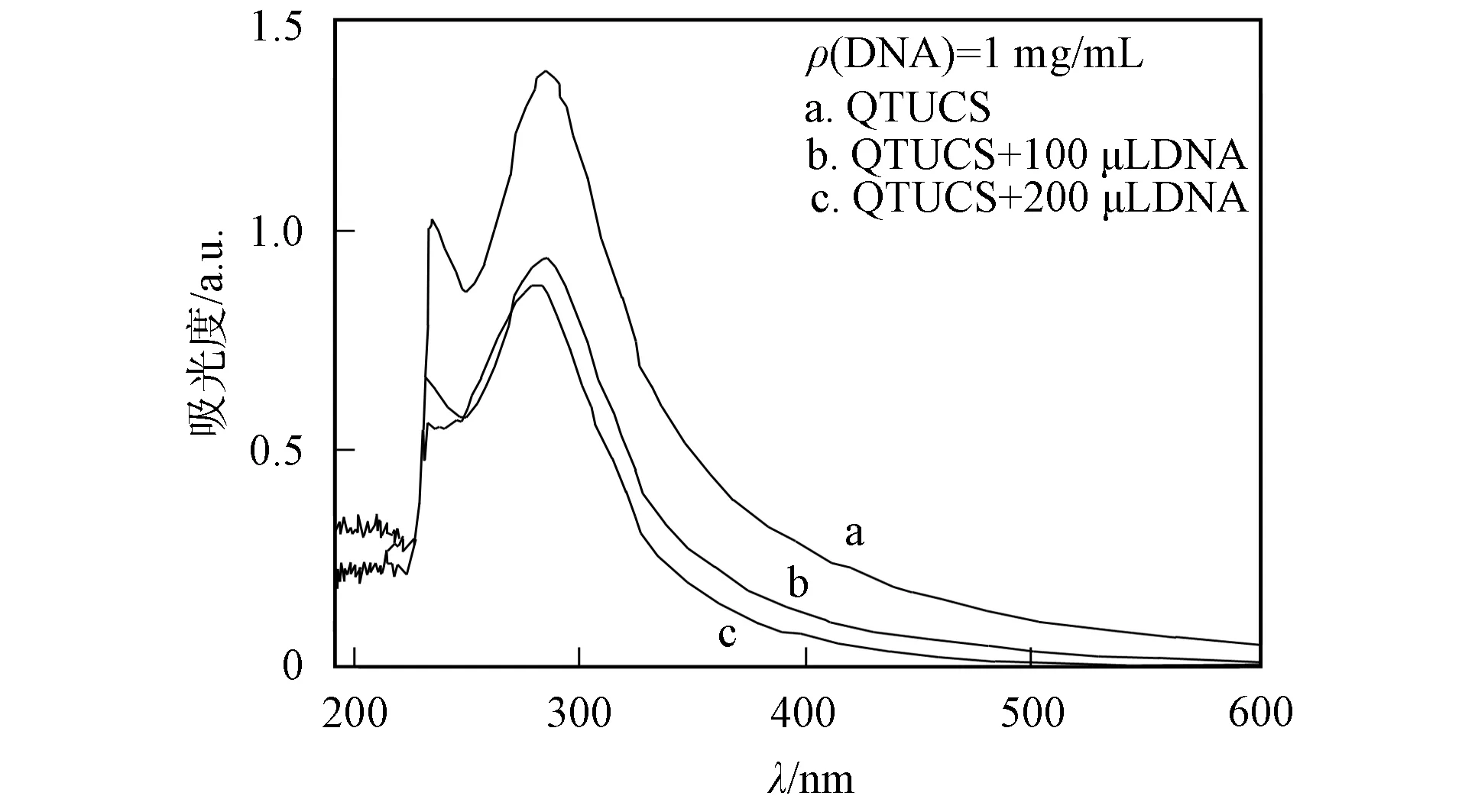
图5 鲱鱼精DNA对QTUCS紫外-可见吸收光谱的影响Fig.5 Effects of herring sperm DNA on UV-Vis absorption spectra of QTUCS
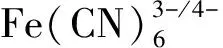
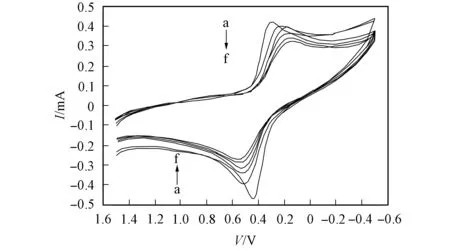
a. K4Fe(CN)6; b. K4Fe(CN)6+DNA; c. K4Fe(CN)6+DNA+0.8 mL QTUCS; d. K4Fe(CN)6+DNA+1.6 mL QTCUS; e. K4Fe(CN)6+DNA+2.4 mL QTUCS; f. K4Fe(CN)6+DNA+3.2 mL QTUCS. 图6 QTUCS加入前后铁氰化钾-DNA体系的循环伏安曲线Fig.6 Cyclic voltammograms of DNA-K4Fe(CN)6system before and after adding QTUCS
在DNA/K4Fe(CN)6体系中加入QTUCS后, 体系的氧化还原峰峰电流减小, ΔEp电位增大. 当加入0.8 mL质量浓度为1 mg/mL的QTUCS时, 位于0.511 4 V处的氧化峰(峰电流为-0.397 7 mA)峰位正移至0.522 3 V处(峰电流为-0.341 4 mA), 位于0.227 5 V处(峰电流为0.400 4 mA)的还原峰峰位负移至0.173 5 V处(峰电流为0.394 8 mA); 在加入2.4 mL QTUCS后, 氧化峰峰位正移至0.576 3 V处, 峰电流下降至-0.269 1 mA, 还原峰峰位负移至0.141 3 V处, 峰电流下降至0.323 9 mA. 因此, QTUCS使DNA/K4Fe(CN)6体系的式量电位增大, 峰电流下降, 且随着QTUCS剂量的增大, 式量电位增大与峰电流下降的趋势越来越明显. 表明QTUCS与鲱鱼精DNA之间存在嵌插作用.
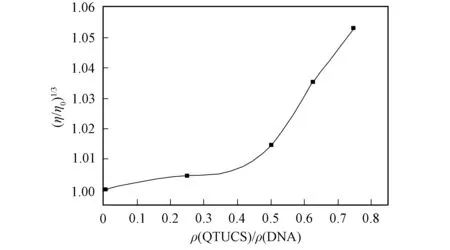
图7 QTUCS对DNA黏度的影响Fig.7 Effect of QTUCS on viscosity of DNA
2.2.3 黏度法 QTUCS对DNA黏度的影响如图7所示. 由图7可见, 在鲱鱼精DNA中加入QTUCS后, 体系的相对黏度增大, 且随着ρ(QTUCS)/ρ(DNA)值的增大, 鲱鱼精DNA溶液黏度增大的趋势越来越明显, 即鲱鱼精DNA黏度的增大程度与QTUCS剂量呈正相关. 文献[13]研究表明, 若产物与鲱鱼精DNA的作用方式为嵌插作用, 则DNA的黏度增大, 可见QTUCS能嵌插到DNA分子的双螺旋结构内部, 增长了鲱鱼精DNA分子的直链, 导致DNA溶液黏度增大. 因此可推断, QTUCS与鲱鱼精DNA间以嵌插方式相互作用.
综上所述, 本文采用紫外-可见吸收光谱、热重-差热分析法对合成的QTUCS进行了表征, 并通过紫外-可见吸收光谱、循环伏安法和黏度法研究了QTUCS与鲱鱼精DNA的作用方式. 结果表明: 合成的QTUCS紫外-可见吸收光谱分别在213.5,280.0 nm处出现吸收峰; 其热稳定性较差, 在180 ℃开始氧化分解; QTUCS与鲱鱼精DNA间主要以嵌插结合模式相互作用.
——勇敢者的游戏

