豉香型传统工艺饼曲及机械化麸曲中的糖和糖醇
王晨晶,范文来*,徐岩,何松贵,刘幼强
1(教育部工业生物技术重点实验室,江南大学 生物工程学院,酿造微生物与应用酶学研究室,江苏 无锡, 214122) 2(广东省九江酒厂有限公司,广东 佛山,528203)
酿造豉香型白酒的传统饼曲是小曲中的“酒饼”曲,通常以饼丸接种,与浸泡蒸煮后的大米、黄豆等原料混合搅拌,压制成曲饼,悬挂培养,干燥后在酒饼仓中贮藏[1]。豉香型白酒在制曲机械化过程中,通常采用圆盘制曲机制曲,通过添加麸皮减少大米黏性,此为“麸曲”或“散曲”,仍以饼丸接种,培养过程中通过鼓风调节温度及湿度。目前,酿酒生产中已经发现麸曲和饼曲酿造的酒在感官品质上是有差异的。
糖类物质是曲中微生物生长繁殖的重要营养源,并影响着微生物的代谢产物[2]。目前对曲中糖的研究报道较少,小曲特别是豉香型饼曲的相关研究还未见报道。现有研究主要集中在微生物领域及挥发性香气组分上[3-4],仅有石亚林[5]等曾对大曲及其发酵过程的糖及糖醇进行了详细分析。
糖及糖醇的常用分析方法主要有高效液相色谱法(HPLC)[6]、气相色谱法(GC)、裂解气相色谱法(pyrolysis gas chromatography, PGC)、高效阴离子交换色谱-脉冲安培法(high performance anion-exchange chromatography-pulsed amperometric detection, HPAEC-PAD)[7]等方式,通常与质谱仪(MS)及核磁共振仪(NMR)等多种分析手段联用。衍生化法结合气相色谱的分析方法以其高分辨率、高灵敏度及简单易行的优势为多种化合物的同时分析提供了可能,并在大曲研究中得到有效应用[5]。
为进一步了解豉香型酒曲中糖类物质的组成,本研究采用肟化-硅烷化衍生并结合GC-MS方法对豉香型传统工艺饼曲及机械化麸曲中的糖及糖醇进行研究,以期对豉香型酒曲中糖类化合物以及2种工艺的酒曲差异有初步认识,对改进传统制曲和麸曲工艺,提高曲的品质提供指导。
1 材料和方法
1.1 材料与试剂
样品:传统工艺饼曲及机械化麸曲成品曲均取自广东九江酒厂,各取5个批次,按照5点取样法取样,粉碎后混合均匀并于-20 ℃贮藏。
试剂:盐酸(分析纯),国药集团化学试剂有限公司;乙腈(色谱纯);六甲基二硅胺烷(hexamethyldisilazane,HMDS)(色谱纯);三氟乙酸(色谱纯);吡啶(色谱纯);L-阿拉伯糖、D-葡萄糖、D-木糖、半乳糖、麦芽糖、D-纤维二糖、海藻糖、龙胆二糖、甘油、L-苏糖醇、赤藓糖醇、木糖醇、D-阿拉伯糖醇、核糖醇、D-松醇、D-半乳糖醇、myo-肌醇、D-甘露醇及水杨苷(内标,IS)(色谱纯),Sigma公司。
1.2 仪器与设备
BZFS-02粉碎机,西安宝正实业有限公司;色谱-Trace1310 质谱-TSQ8000,Thermo Scientific;Organomation N-EVAP氮吹仪,安捷伦;纯水机,MolliQ SYNERGY;Avanyi J-E高速冷冻离心机,贝克曼;Centrifuge 5418 离心机,Eppendorf;SB-25-12D超声波清洗机,宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 水分测定
年轻刑警歪着脖子慢条斯理地说,编啊,继续编啊?你是不是皮和骨头发痒了,要我给松松?你以为我们是吃干饭的不是?年轻刑警又一拍桌子说,老实交代,为什么要编?
参照QB/T 4247—2011[8]进行曲样水分测定。
1.3.2 糖和糖醇提取
将样品粉碎,过80目筛并混合均匀,称取5.00 g曲粉置于50 mL烧杯中,加入25 mL 0.1 mol/L 的HCl水溶液过夜浸泡;冰水浴超声提取1 h,并于4 ℃、10 000 r/min下离心30 min ,上清液再用0.45 μm水系膜过滤;收集滤液,并向其中加入等体积乙腈沉淀蛋白,离心除蛋白后取上清液于4 ℃储存[9]。
1.3.3 肟化-硅烷化衍生
参考ANA等人的方法[10],采用两步衍生法。吸取150 μL大曲浸提液置于2 mL气相小瓶中,加入150 μL质量浓度为882 mg/L的内标水杨苷,氮气吹干;然后向小瓶中加入150 μL 2.5%(体积分数)盐酸羟胺吡啶,于密闭环境下75 ℃反应30 min,冷却至室温后再向小瓶中加入95 μL HMDS及10 μL三氟乙酸,45 ℃密闭反应30 min;反应结束后,待样品冷却至室温,将其移至1.5 mL离心管中,于室温12 000 r/min离心3 min;样品在衍生反应后24 h内进行GC-MS分析。
1.3.4 GC-MS条件
色谱柱:TG-5(30 m×0.25 mm×0.25 μm);升温程序:65 ℃保持2 min,6 ℃/min升温到280 ℃,保持10 min;进样口温度280 ℃,传输线温度280 ℃,载气为氦气,流速1 mL/min,分流比10∶1,进样量1 μL。EI电离源,电子能量70 eV,发射电流25 μA,离子源温度300 ℃,质量扫描范围50~650 amu[5]。
1.3.5 定性及定量
2 结果与讨论
2.1 糖及糖醇定性与定量分析方法
还原糖先经甲肟化反应然后进行硅烷化衍生处理,形成anti-((E)-)和syn-((Z)-)型同分异构体,同一化合物色谱图出现2个峰,鉴定时依据该化合物2个保留指数鉴定(如图1和表1);将同一物质2个峰面积相加用于该物质定量分析。曲中还原糖如L-阿拉伯糖(6 和8号峰)、D-葡萄糖(13和14号峰)等单糖及麦芽糖(20和21号峰)、纤维二糖(18和19号峰)、龙胆二糖(22和23号峰)等二糖,均为二个色谱峰;非还原糖(如海藻糖)和糖醇均为单个色谱峰[11](见图 1)。

1-甘油;2-赤藓糖醇;3-L-阿拉伯糖醇;4-核糖醇;5和7-D-木糖;6和8-D-阿拉伯糖;9-D-松醇;10-D-甘露醇;11-D-半乳糖醇;12和15-半乳糖;13和14-D-葡萄糖;16-myo-肌醇;17-海藻糖;18和19- D-纤维二糖;20和21-麦芽糖;22和23-龙胆二糖图1 豉香型传统工艺饼曲中糖及糖醇衍生后GC-MS图Fig.1 GC-MS of silylated sugars and sugar alcohols in traditional Bingqu for Chixiang aroma type liquor
所有待测定化合物标准曲线R2在0.984~0.997之间;相对标准偏差(RSD)在2%~11%;样品回收率在81%~116%(见表 1)。
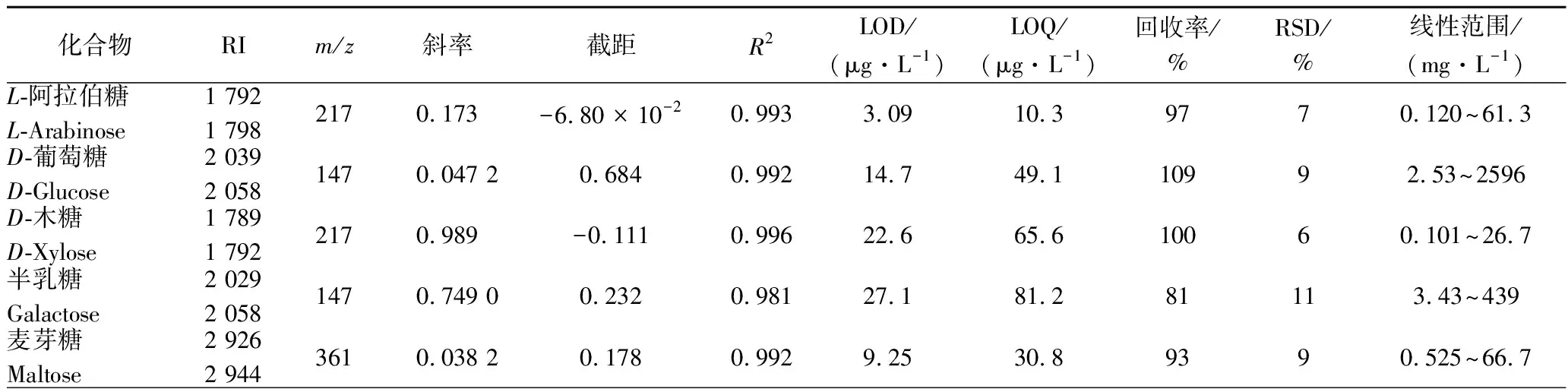
表1 糖及糖醇RI、定量离子、标准曲线、R2、LOD、LOQ、回收率、RSD(n=3)及线性范围Table 1 The RI, m/z, calibration curves, R2, LOD, LOQ, recovery, RSD and linearity range of sugars and sugar alcohols
续表1
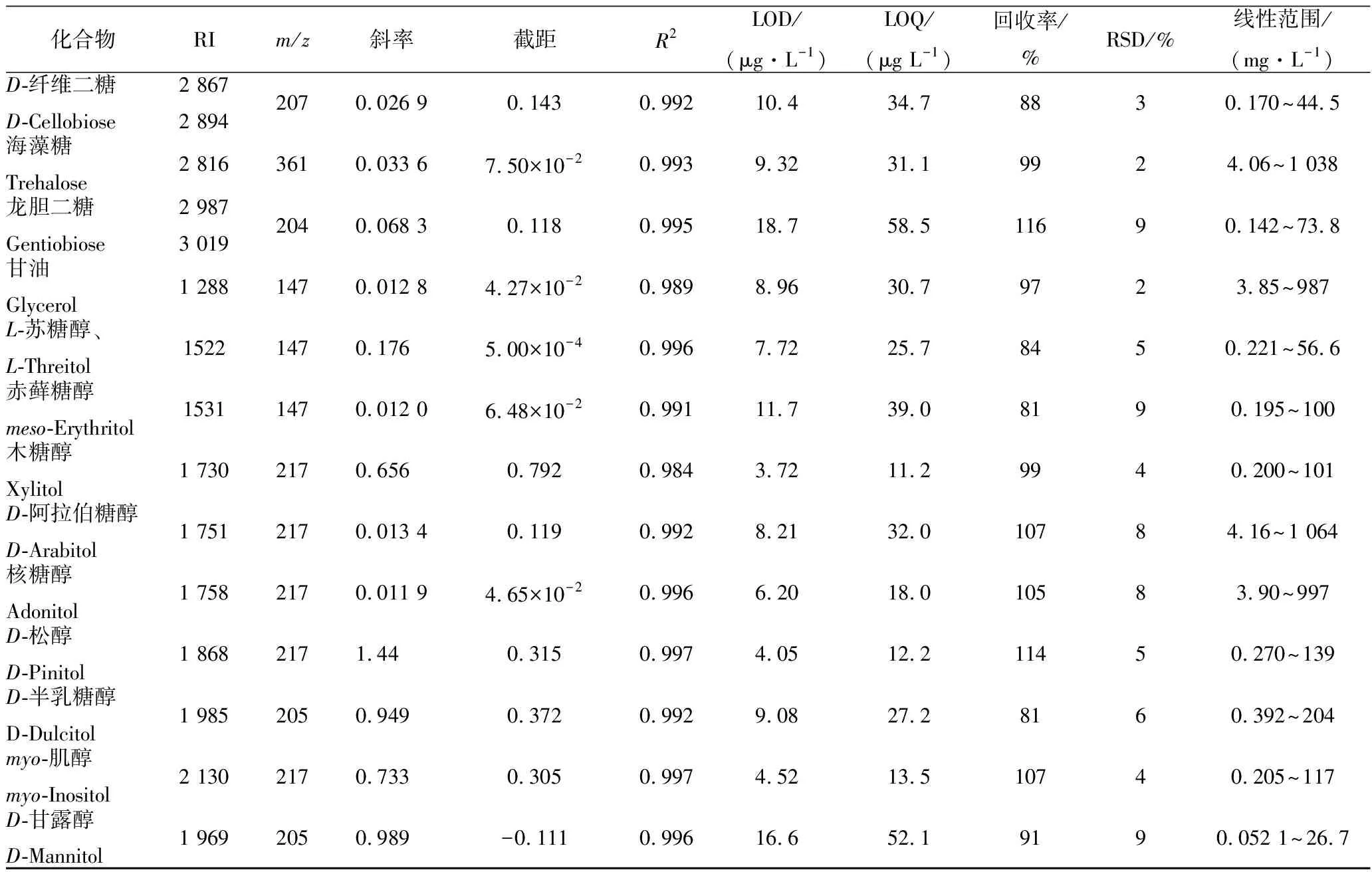
化合物RIm/z斜率截距R2LOD/(μg·L -1)LOQ/(μg L -1)回收率/%RSD/%线性范围/(mg·L -1)D-纤维二糖D-Cellobiose2 8672 8942070.026 90.1430.99210.434.78830.170~44.5海藻糖Trehalose2 8163610.033 67.50×10-20.9939.3231.19924.06~1 038龙胆二糖Gentiobiose2 9873 0192040.068 30.1180.99518.758.511690.142~73.8甘油Glycerol1 2881470.012 84.27×10-20.9898.9630.79723.85~987L-苏糖醇、L-Threitol15221470.1765.00×10-40.9967.7225.78450.221~56.6赤藓糖醇meso-Erythritol15311470.012 06.48×10-20.99111.739.08190.195~100木糖醇Xylitol1 7302170.6560.7920.9843.7211.29940.200~101D-阿拉伯糖醇D-Arabitol1 7512170.013 40.1190.9928.2132.010784.16~1 064核糖醇Adonitol1 7582170.011 94.65×10-20.9966.2018.010583.90~997D-松醇D-Pinitol1 8682171.440.3150.9974.0512.211450.270~139D-半乳糖醇D-Dulcitol1 9852050.9490.3720.9929.0827.28160.392~204myo-肌醇myo-Inositol2 1302170.7330.3050.9974.5213.510740.205~117D-甘露醇D-Mannitol1 9692050.989-0.1110.99616.652.19190.052 1~26.7
2.2 传统工艺饼曲与机械化麸曲中糖及糖醇
在饼曲和麸曲中共检测到4种单糖、4种二糖、9种糖醇及甘油(如表 2)。在所有检测到的物质中,含量最高的是D-葡萄糖,其次为海藻糖及甘油,这3种物质占整个总量67.8%(饼曲)~71.7%(麸曲)。根据物质类别分析,单糖含量最高,占整个总量56.7%(饼曲)~68.5%(麸曲),其次为二糖,占13.6%(麸曲)~21.2%(饼曲),再次是糖醇,占12.2%(麸曲)~15.7%(饼曲),甘油占5.70%(麸曲)~6.40%(饼曲)。
饼曲中检测到单糖主要有L-阿拉伯糖、D-葡萄糖、D-木糖及半乳糖,含量最高的是D-葡萄糖,达16.5 mg/g绝干曲,占单糖总量82.8%(饼曲),占所有糖及糖醇总量47.0%(饼曲)。麸曲中含量最高的单糖也是D-葡萄糖,含量为21.8 mg/g绝干曲,占麸曲单糖总量88.3%,占麸曲所有糖及糖醇总量60.6%。
饼曲中二糖检测到海藻糖、麦芽糖、龙胆二糖及D-纤维二糖4种,含量最高的为海藻糖,高达5.14 mg/g绝干曲,占二糖总量69.1%(饼曲),占所有糖及糖醇总量21.1%。麸曲中麦芽糖与海藻糖含量接近,麦芽糖占麸曲二糖总量38.0%,海藻糖占麸曲二糖总量40.1%。

表2豉香型传统工艺饼曲及机械化麸曲中糖及糖醇含量Table 2 The content of sugars and sugar alcohols in Chixiang traditional Bingqu and mechanical-making moldy bran
饼曲中糖醇共检测到9种,虽然种类高于单糖与二糖之和,但总含量较低,仅为5.53 mg/g绝干曲。饼曲及麸曲的糖醇类物质中均为赤藓糖醇含量最高,在饼曲中达到1.89 mg/g绝干曲,占糖醇总量34.1%;在麸曲中为1.55 mg/g绝干曲,占糖醇总量35.2%。
非还原性的二糖海藻糖及一系列多元醇如甘油、D-阿拉伯糖醇、山梨糖醇及D-甘露醇等具有稳定、抗逆等作用[12-13]。海藻糖在酵母、霉菌及细菌中可由D-葡萄糖、麦芽糖等产生,D-阿拉伯糖醇可由葡萄糖代谢生成[14],还可在酵母细胞中由甘油生成[15]。
2.3 传统工艺饼曲与机械化麸曲糖及糖醇差异
总体上讲,与传统工艺饼曲相比,机械化麸曲单糖总量较高,单糖总量上升23.6%;而二糖及糖醇总量较低,二糖总量下降34.4%,糖醇总量下降20.5%。
与饼曲相比,麸曲含量明显上升的物质有D-葡萄糖、麦芽糖、D-松醇和myo-肌醇,麦芽糖上升129%,D-松醇上升117%,myo-肌醇上升93.9%,D-葡萄糖含量上升了31.9%;L-苏糖醇、D-阿拉伯糖醇及海藻糖在麸曲中下降明显,L-苏糖醇含量下降80.3%,D-阿拉伯糖醇下降69.8%,海藻糖下降62.0%。甘油下降了8.50%。
差异产生的原因可能是由于两种工艺下曲中微生物和酶系所处的环境不同,消耗淀粉质原料、葡萄糖并引起海藻糖及糖醇累积的途径不同[13],这些物质的含量差异从一个侧面反映了饼曲与麸曲发酵过程中微生物生长代谢的差异,也反映了2种曲品质的差异。
2.4 传统工艺饼曲与大曲糖类及糖醇比较
豉香型传统工艺曲是以大米为原料的饼曲,与以小麦为主要原料的大曲在原料配方及工艺上均有较大差异,因而这二者的成分差异较大。
文献报道大曲中检测到的糖类及糖醇物质共13种[5, 16],本研究在豉香型小曲中共检测到17种,其中D-纤维二糖、龙胆二糖、D-松醇、L-苏糖醇及D-半乳糖醇在大曲研究中未见报道,而在豉香型传统工艺饼曲中未检测到山梨糖醇。浓、清、酱三大香型大曲中游离态糖及糖醇总量41.5~61.3 mg/g绝干曲[9],均高于豉香型饼曲(35.2 mg/g绝干曲)。
豉香型饼曲中海藻糖含量是这4种酒曲中最高的,是浓香型大曲(0.150 mg/g绝干曲[9])的34.3倍,酱香型大曲(0.750 mg/g绝干曲[9])的6.86倍,清香型大曲(3.64 mg/g绝干曲[9])的1.4倍。豉香型饼曲中D-甘露醇小于定量限,而浓香及酱香大曲中该物质含量均超过10 mg/g绝干曲[9]。核糖醇在豉香型饼曲中含量仅为0.931 mg/g绝干曲,而在大曲中含量达7.74~12.5 mg/g绝干曲[9],大曲中核糖醇含量是豉香型传统工艺饼曲的8.32~13.5倍。甘油在浓、清、酱3种大曲中含量7.35~13.6 mg/g绝干曲[9],豉香型饼曲中仅为 2.24 mg/g绝干曲。
海藻糖、D-甘露醇、核糖醇、山梨糖醇及甘油在豉香型饼曲和大曲中的含量差异可能由于不同工艺下微生物的代谢通路不同、制曲原料不同造成的。这些差异对曲的品质到底有什么影响,还需要进一步的研究。
3 结论
本研究分析了豉香型传统工艺饼曲及机械化麸曲中的糖及糖醇,首次在酒曲中检测到龙胆二糖、D-纤维二糖、D-松醇、L-苏糖醇及D-半乳糖醇。在豉香型传统工艺饼曲与机械化麸曲中,单糖含量最高而糖醇种类最多。在所有检测到的物质中,含量最高的是D-葡萄糖,其次为海藻糖及甘油。2种曲中L-苏糖醇、D-阿拉伯糖和海藻糖含量差异最大;饼曲与大曲的区别则主要反映在豉香型饼曲糖及糖醇总量低,D-甘露醇、核糖醇、山梨糖醇及甘油含量低,海藻糖含量高。综合分析,高含量的海藻糖是豉香型饼曲不同于豉香型麸曲及大曲的典型特征。

