草甘膦对中华绒螯蟹成蟹主要免疫指标的影响
洪宇航
(西昌学院动物科学学院,四川西昌 615000)
中华绒鳌蟹(Eriochiersinensis)又称河蟹、大闸蟹,味道鲜美,营养丰富,是我国特有的淡水养殖蟹类,具有较高的经济价值。随着养殖年份的增加,养殖模式更加多元化,其中种养结合的养殖模式已在长江流域、辽河流域大面积推广[1]。稻田养蟹是一种高效又经济的立体生态种养技术模式,把水稻种植业和水产养殖业有效地结合起来,发挥各自的积极作用,充分利用整个系统的物质和能量,以获得水稻、河蟹双丰收[2]。稻田养蟹技术从开发推广至今已有30多年历程,但是一直存在着水稻施药与河蟹增产的矛盾[3]。草甘膦是美国孟山都公司研发生产的一种高效广谱灭生性除草剂,由于其水溶性好,效果快,目前在世界各国被普遍使用于农田、果园、养殖水体中的杂草清除,主要通过直接喷洒或地表径流影响附近水体水生生物[4]。目前,国内外已有较多关于草甘膦对水生生物安全的研究报道,如对于藻类、水蚤、鱼类以及虾蟹类等[5-7],但其对于甲壳类动物的毒性作用却少见报道,对我国重要的淡水经济养殖种类——中华绒螯蟹的影响的报道仅有1例,其主要探究了草甘膦对于中华绒螯蟹幼蟹的毒性[8],而针对成蟹的研究尚未见报道。
因此,本试验通过设置不同浓度梯度草甘膦水体,研究其对中华绒螯蟹成蟹主要免疫指标,包括总血细胞密度(THC)、血清中血蓝蛋白含量、酚氧化酶(PO)活性、酸性磷酸酶(ACP)活性、碱性磷酸酶(AKP)活性的影响,初步探究草甘膦胁迫下中华绒螯蟹成蟹的免疫应答情况,从而为草甘膦在稻蟹种养及常规养殖池塘除草过程中的使用提供理论参考。
1 材料与方法
1.1 材料
本试验动物中华绒螯蟹成蟹采自江苏省金坛市水产技术推广站养殖场。试验于2016年9月至11月在西昌学院动物科学学院进行。试验前在循环水养殖系统中暂养7 d以上,24 h气泵增氧,每日2次投喂人工配合饲料。挑选身体健康、大小均匀的中华绒螯蟹用于试验,雌雄各占50%,平均质量(107±13.45) g。将中华绒螯蟹随机放入125 cm×60 cm×60 cm水族缸箱中,每箱10只,箱中加入经曝气1 d以上的自来水50 L,箱底放置经消毒处理的PVC管作为遮蔽物。光暗周期12 h ∶12 h,试验期间每日09:00至19:00投喂人工配合饲料,并于投饵后3 h检查吃食情况,清理粪便和残饵。试验期间每日测定水质指标,保证水温(20±2)℃、pH值 7.2~7.8、溶氧量>5 mg/L、氨态氮含量<0.5 mg/L、亚硝酸盐含量 <0.15 mg/L。
1.2 浓度梯度设计
草甘膦异丙胺盐水剂(有效成分41%),购自浙江省美丰农化有限公司。参考草甘膦在中华绒螯蟹幼蟹毒性试验中的浓度[8]和其他水生动物毒性试验中的浓度[5-7],以及草甘膦在稻田水体中的残留和消解情况[5],设置1.90、4.10、6.30、8.50、10.70 mg/L 5个浓度组以及1个0 mg/L空白对照组。每组中华绒螯蟹30只,设置3个平行,分别放置于3个水族箱中。试验采用48 h半静水法,每12 h换水1次,并配置相同浓度草甘膦溶液以保证试验水体浓度不变。分别于3、6、12、24、48 h观察并记录中华绒螯蟹的存活情况,每组任意取5只蟹取血淋巴用于免疫指标的检测。
1.3 分析测定
1.3.1 存活率测定 试验开始后3、6、12、24、48 h观察中华绒螯蟹存活情况,以触碰眼柄无反应,捞出后1 min仍无活动能力判定为死亡。观察每个观察点并记录。
1.3.2 THC测定 每个观察点取中华绒螯蟹,第5步足基膜处抽取血淋巴100 μL,加入等量抗凝剂(0.1 mol/L葡萄糖、0.14 mol/L氯化钠、30 mmol/L柠檬酸、10 mmol/L EDTA、pH值=4.6)混匀,立即采用血球计数板进行血细胞计数,每个样品计数3次,取平均值。
1.3.3 血蓝蛋白浓度检测 每个观察点取中华绒螯蟹,尽可能多抽取血淋巴至2 mL离心管,立即放置于-4 ℃冰箱4 h以上。11 000 r/min 4 ℃高速冷冻离心30 min,用移液枪小心取上清(血清)于2 mL离心管中,4 ℃保存备用。血蓝蛋白含量的测定参考章跃陵等的方法[9]进行改良,用血蓝蛋白稀释液(50 mmol/L Tris-HCl、10 mmol/L CaCl2、pH值=8.0)对中华绒螯蟹血清进行100倍稀释,分光光度计测定334 nm下吸光度,根据Lambert-Beer定律,血蓝蛋白浓度:C=D/(EL)(D为吸光度、E为消光系数、L为比色皿厚度),本试验采用 1 cm 比色皿,按E334nm=2.3 nm计算血蓝蛋白浓度(mg/mL)。
1.3.4 PO活性测定 血清制备方法同“1.3.3”节,PO活性的测定参考Ashida的方法[10],将50 μL 3 g/LL-dopa、50 μL血清以及50 μL PBS缓冲液(0.1 mol/L、pH值7.0)加入96孔板中,在室温下混匀孵育20 min,490 nm波长下读取起始和10 min时的吸光度(D490 nm),以10 min内每分钟吸光度增加0.001为1个酶活力单位(U)计算。
1.3.5 ACP活性测定 血清制备方法同“1.3.3”节,ACP活性测定方法遵照ACP活性检测试剂盒说明书(江苏南京建成生物科技有限公司),使用Bio-Rad iMark酶标仪在520 nm波长下测定96孔板各孔吸光度,以每100 mL血清在37 ℃与基质作用30 min产生1 mg酚为1个金氏单位。酶活性最终数据统一换算为国际单位(U/L)。
1.3.6 AKP活性测定 血清制备方法同“1.3.3”节,AKP活性测定方法遵照AKP活性检测试剂盒说明书(江苏南京建成生物科技有限公司),使用Bio-Rad iMark酶标仪在520 nm波长下测定96孔板各孔吸光度,以每100 mL血清在37 ℃与基质作用15 min产生1 mg酚为1个金氏单位。酶活性最终数据统一换算为国际单位(U/L)。
1.4 数据分析
采用SPSS V13.0软件对试验数据进行统计分析,用Levene法进行方差齐性检验,不满足齐性方差时对数据进行反正弦或者平方根处理,采用ANOVA对试验结果进行方差分析,采用Tukey’s法进行多重比较,在GraphPad Prism 5上绘制相关图表。
2 结果与分析
2.1 草甘膦对中华绒螯蟹成蟹存活的影响
试验期间,除最高浓度10.70 mg/L组外,其他各组均未出现死亡现象。10.70 mg/L组在24 h出现1只死亡,48 h出现3只死亡,48 h死亡率仅为13.3%
2.2 草甘膦对中华绒螯蟹成蟹THC的影响
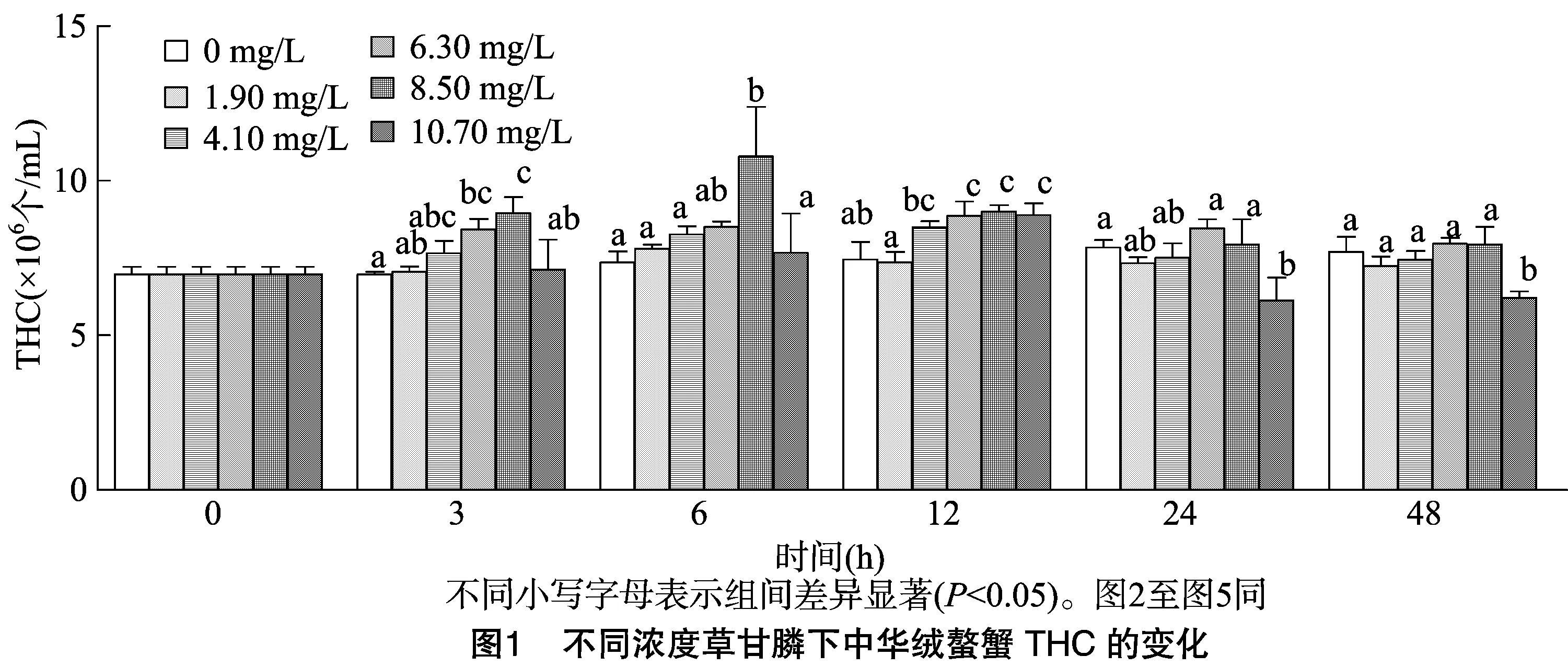
从图1可以看出,中华绒螯蟹成蟹THC正常值约为(6.98±0.24)×106个/mL,各组THC随着攻毒时间延长而上升,且有随着浓度提高增加幅度加大的趋势,随后各组均有所恢复。其中8.50 mg/L组增长幅度最大,并于6 h达到峰值,显著高于其他各组。10.70 mg/L组THC最初也有所上升,并在12 h达到最大值,但在24 h时出现了下降的情况,并低于0 h正常水平,在48 h显著低于其他各组。
2.3 草甘膦对中华绒螯蟹血清血蓝蛋白含量的影响
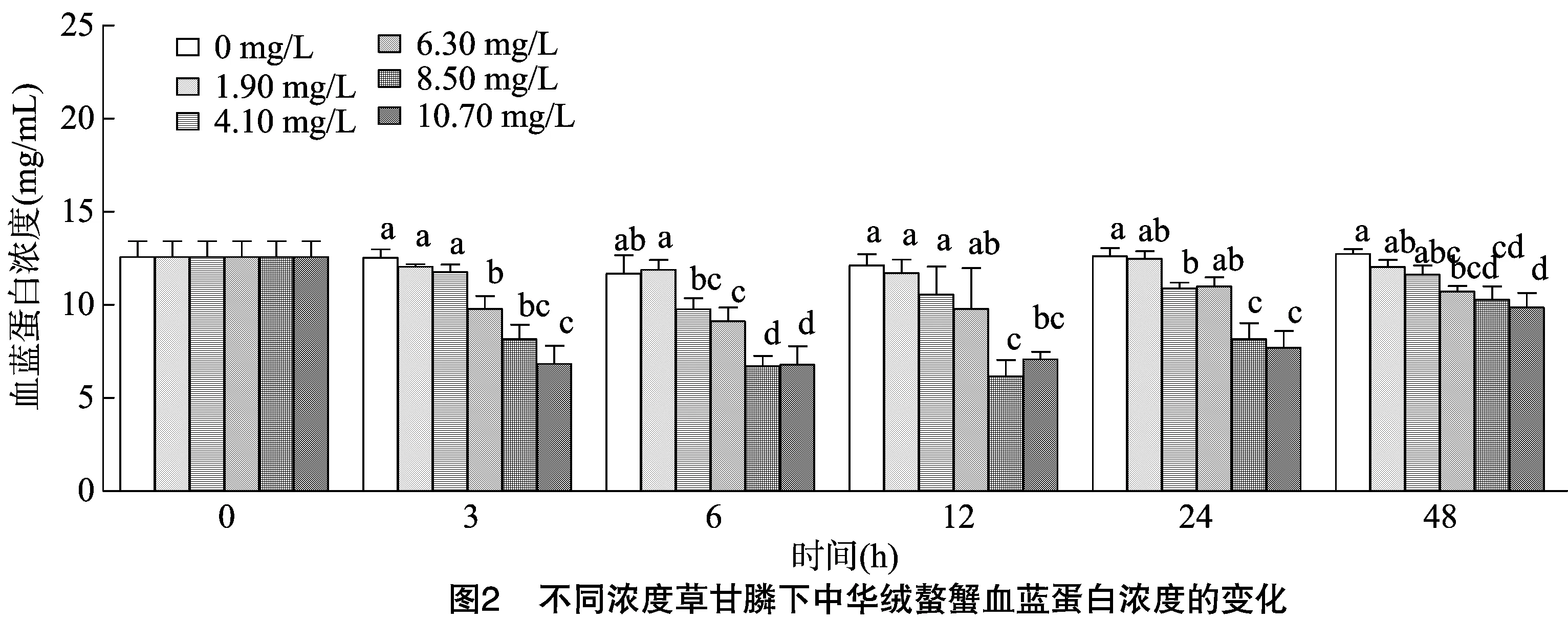
从图2可以看出,随着接触时间的延长,不同浓度草甘膦各组血清血蓝蛋白浓度均出现先下降再恢复回升的趋势。且随着浓度的增加,下降趋势越明显。其中8.50 mg/L组下降最多,在12 h达到最低值。在6、12 h,8.50、10.70 mg/L 组血蓝蛋白水平均显著低于其他4组。至48 h 1.90、4.10 mg/L组基本恢复到正常水平,与空白组差异不显著,而其他3组均显著低于空白组。
2.4 草甘膦对中华绒螯蟹血清PO活性的影响
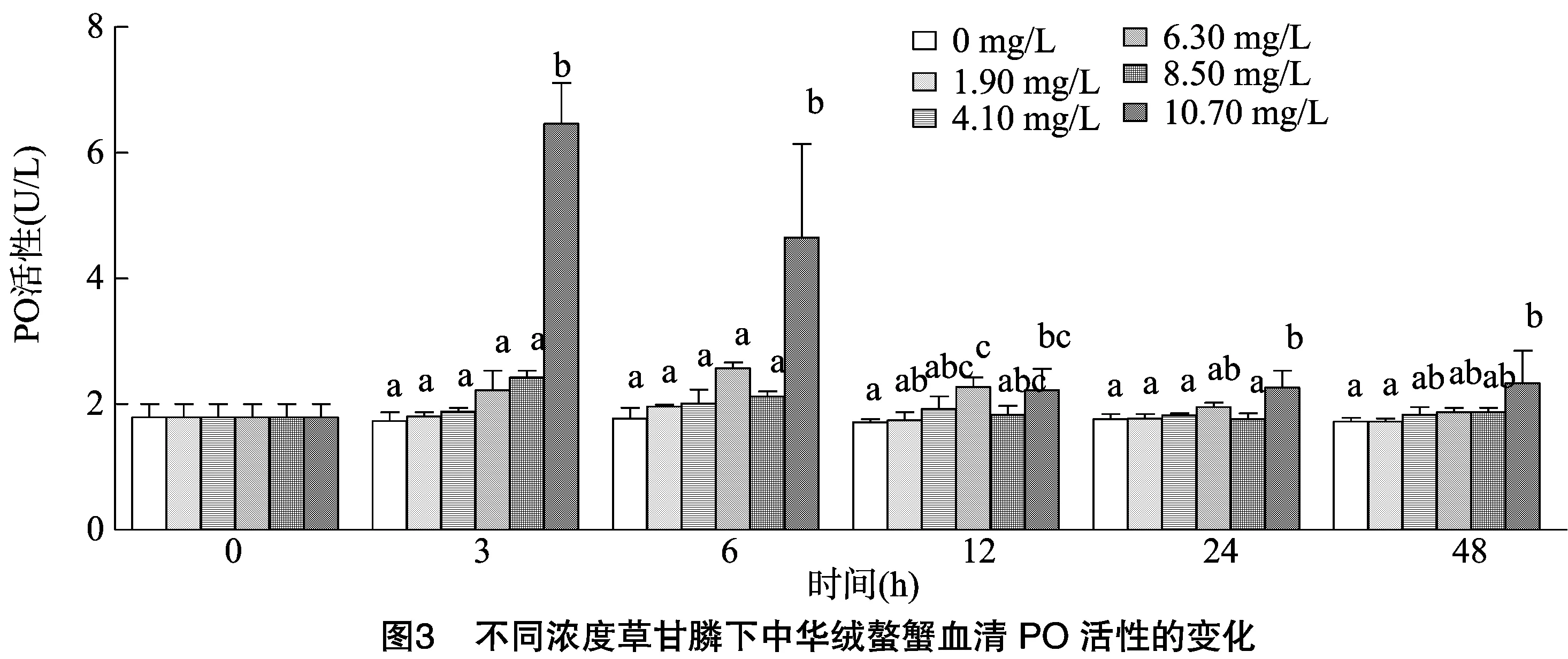
从图3可以看出,各浓度组血清PO活性均有所上升。其中最高浓度10.70 mg/L组上升最为明显,在3 h时即达到最大值,约为0 h正常水平的3.7倍,显著高于其他各组;随后有所下降,但在6 h仍显著高于其他各组;在12 h时有明显下降,随后继续下降,至48 h仍显著高于空白组。相比之下,低浓度组变化幅度不大,除12 h外,其他各组在各时间点均同空白组无显著性差异。
2.5 草甘膦对中华绒螯蟹血清ACP活性的影响
各浓度组血清ACP活性随着试验时间延长而下降,其中10.70 mg/L较其他组下降最为明显,12 h时降至最低值,且在试验后不同时间段均显著低于其他各组。8.50 mg/L组下降幅度其次,3 h时并未有明显下降,至6 h较前3组显著降低,此后有所恢复。而1.90 mg/L组ACP活性起初虽有减低,但在各时间段与空白组均无显著差异(图4)。

2.6 草甘膦对中华绒螯蟹血清AKP活性的影响
各浓度组AKP活性均呈下降趋势,特别是8.50、10.70 mg/L 组,在3 h检测时便有明显下降,显著低于对照组以及其他3个浓度组;10.70 mg/L组在6 h时降至最低水平,仅有(18.42±2.14) U/L,并在各检测时间点均显著低于空白组及低浓度组(图5)。
3 讨论与结论
近年来,草甘膦作为常用广谱灭生性除草剂,在国内被广泛使用,包括稻蟹共作的稻田以及空心莲子草和水葫芦丛生的养殖池塘等。草甘膦通过直接施加入水以及地表径流影响附近河流、湖泊,关于其对水生生物的毒性及安全评估有较多报道。傅建炜等研究结果发现,草甘膦对草鱼、鲢鱼和鲫鱼96 h LC50分别为0.251 8、0.258 8、0.259 9 mg/L,均属于高毒农药[6];刘晓伟等研究了草甘膦对多刺裸腹蚤的急性毒性作用,认为草甘膦对多刺裸腹蚤为低毒[11];朱国念等的研究指出,草甘膦对麦穗鱼、蚤状蚤和斜生栅藻均属于低毒[5],而关于草甘膦对虾蟹类的毒性研究则鲜有报道。史建华等研究了草甘膦对中华绒螯蟹幼蟹急性和慢性毒性,结论为草甘膦对中华绒螯蟹幼蟹毒性属于低毒,安全浓度为 1.9 mg/L[8]。但其并没有研究草甘膦对于中华绒螯蟹成蟹的影响。在草甘膦对水体环境安全性研究中,有学者指出,在施用草甘膦后,养殖池塘水体草甘膦残留量当日为 6.286 mg/L,施药后1 d下降90%左右,至施药后6 d降至 0.003 mg/L,消失十分迅速;而在鱼塘沉积物中检测的残留浓度则较高,1 d后仍高达2.835 mg/L[5],这对于依赖底质营养的虾蟹类动物十分不利。目前,已有研究表明,草甘膦对于虾蟹类,包括日本蟳[7]、克氏原螯虾[12]、中华绒螯蟹幼蟹[8]等均属于低毒。因此,草甘膦对于主要经济虾蟹类的毒性作用,包括是否能显著影响其免疫功能,造成应激胁迫而诱发疾病的爆发,成为后续研究的重点。笔者参考草甘膦对于中华绒螯蟹幼蟹的安全浓度以及在水体中当日残留浓度,设置5个试验浓度,检测不同浓度草甘膦对于中华绒螯蟹成蟹主要免疫指标的影响,为后续毒理机制和安全施药提供理论依据。

血淋巴细胞在甲壳动物机体免疫系统中处于非常关键的地位,血细胞总数可以间接反映出动物机体的健康状态及免疫应激能力,因此经常作为衡量甲壳类动物免疫水平的指标之一[13]。试验结果表明,不同浓度草甘膦作用下各组中华绒螯蟹THC均有所升高,随着浓度的增加,升高的趋势也越明显。其中8.50 mg/L组上升最明显,6 h时达到峰值。浓度为10.70 mg/L组在24 h时出现下降。在Cu2+对斑节对虾毒性研究中,低浓度Cu2+(0.05、0.5 mg/L)下斑节对虾THC出现了上升,而高浓度(1.5、3.5 mg/L)组则造成THC显著下降,与本研究结果相似[14]。Gallo等研究表明,对螳螂虾注射微球菌后,其THC在1 h内显著上升,并在3 h有明显回落[15]。而本研究在对健康中华绒螯蟹成蟹注射一定量嗜水气单孢菌后,注射组较空白组和生理盐水组THC有明显上升,在6 h时达到最高,然后逐渐恢复。本研究认为,低浓度草甘膦可以刺激中华绒螯蟹机体的免疫系统,使其THC水平升高以应对应激胁迫。相反高浓度草甘膦则会对免疫功能产生抑制作用,致使THC水平下降。
血蓝蛋白分散在机体的血淋巴中,是甲壳类动物的呼吸色素,不仅具有输氧和免疫防御功能,还与其他理化调节有关,是一种多功能蛋白[9]。本研究表明,不同浓度草甘膦下中华绒螯蟹血蓝蛋白含量均出现不同程度减少,且减少程度与草甘膦浓度大致呈正相关。本结果与Yoganandhan等研究中印度对虾感染WSSV后血蓝蛋白含量明显减少结果[16]一致。此外,乐亚玲研究表明,高浓度铜绿微囊藻可以引起克氏原螯虾血清血蓝蛋白含量在1 h明显上升,随后剧烈下降至显著低于正常水平,并在5 h达到最低值[17]。表明低毒浓度下的草甘膦也能造成中华绒螯蟹血清中血蓝蛋白的分解,从而降低了其输氧和免疫防御的功能。
中华绒螯蟹体液中不具有免疫球蛋白,酚氧化酶(PO)作为其体液免疫主体之一,是抵御外界不利环境的第一道防线,与机体的免疫有直接的关系[18]。结果表明,各浓度草甘膦作用下中华绒螯蟹机体内PO活性都有明显增强,其中最高浓度组增幅最为明显,并于3 h达到最高值,随后下降。这与陆宏达等报道中不同刺激造成机体PO活性增强的结果[19]相似。此外,Dong等在dsRNA攻毒中华绒螯蟹的研究中证实,GFP-dsRNA作用下中华绒螯蟹血淋巴PO活性于6 h时显著升高并达到峰值[20];Xian等研究表明,0.5 mg/L Cu2+作用下斑节对虾血淋巴PO活性会有所上升,同样在6 h时升至最高[14]。因此,笔者推测高浓度草甘膦可以激活中华绒螯蟹酚氧化酶系统,引起血淋巴中PO活性显著上升,而作用时间在1~6 h之间,这可能也是多数甲壳动物酚氧化酶系统激活的时间范围。
ACP、AKP是甲壳动物体内一组重要的水解酶,在甲壳动物免疫应答中起到重要作用。本研究中中华绒螯蟹ACP活性低浓度组出现略微上升,而高浓度组出现下降;AKP则各浓度组均出现下降,且随着浓度升高愈加明显。与Zhao等在组织胺对中华绒螯蟹免疫影响研究中的结论[21]相同。不同浓度组织胺注射后,在6 h均引起中华绒螯蟹血清中ACP、AKP活性显著下降。然而,这一结论同王洪斌等在草甘膦对日本蟳毒性胁迫的研究中所得到的ACP、AKP有明显上升的结论[7]相悖。这可能是物种差异造成的,具体原因有待进一步分析。
本试验结果表明,中华绒螯蟹成蟹对于草甘膦的耐受能力远强于幼蟹,在接近幼蟹48 h半致死浓度的10.70 mg/L浓度下,仅出现13%死亡率。但通过检测中华绒螯蟹各项免疫指标,笔者发现即使在幼蟹1.90 mg/L安全浓度下,仍对其免疫产生不良影响,特别是AKP活性仍在各时段显著降低。且随着药物浓度升高,对各项免疫指标影响更大。因此,虽然草甘膦在较低浓度下不会直接造成中华绒螯蟹的死亡,但是会对其免疫功能造成影响,尤其是在高温天气、水质恶化等情况下增大病害发生的风险,加大了发病概率。此外,在高浓度(达到8.50 mg/L以上)草甘膦作用下,中华绒螯蟹各项免疫指标在48 h仍未恢复至正常水平,表明即使在非致死浓度下,草甘膦可48 h甚至更长时间对中华绒螯蟹的免疫系统造成影响。鉴于此笔者建议在养蟹水体应避免使用草甘膦。

