超声协同糖基化对蛋清粉致敏性及结构的影响
宋启东 涂宗财,2 王 辉 杨文华 刘光宪 陆建伟
(1. 南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2. 江西师范大学生命科学学院,江西 南昌 330022)
食物过敏是指机体摄入食物或食品添加剂而引起的消化系统内或全身性免疫反应,常见的过敏症状有胃肠道紊乱、荨麻疹和哮喘等[1]。近年来,食物过敏发生率不断增加,有近5%的成年人和8%的儿童对食物过敏[2]。因此,降低食物过敏发生率是目前亟待解决的问题。众所周知,鸡蛋是人类最主要的食物资源之一,由于其具有优良的加工特性,因此广泛应用于加工食品中。但它也是引起食物过敏的主要过敏源,且过敏原主要存在于蛋清中[3]。因此,研究蛋清中的过敏蛋白对于降低鸡蛋过敏发生率具有重要意义。目前,对鸡蛋蛋白致敏性的研究主要是采用单一方法降低鸡蛋中某种特定过敏蛋白,如Mine等[4]报道通过羧甲基化可以降低卵转铁蛋白和卵类黏蛋白的致敏性;Shin等[5]报道热处理可以降低卵清蛋白致敏性但增加了卵类黏蛋白致敏性;Seo等[6]报道10 kGy剂量的伽马射线辐照可以部分降低卵清蛋白致敏性。而关于采用复合改性方法降低鸡蛋蛋白体系的研究还很少。
复合改性具有高效、协同等优点,既可以互补单一方法的不足,又可以更快速、全面地改性样品。本课题组前期研究中发现高强度超声能够促进蛋白结构展开[7],Ma等[8]通过外接葡萄糖的糖基化使卵清蛋白致敏性显著降低,Guan等[9]发现超声波对糖基化有积极的促进作用。由于食品是一个复杂的体系,有必要研究食品加工方式对复杂体系过敏蛋白(如市售蛋清粉)致敏性的影响。因此,本试验拟采用超声预处理结合糖基化复合改性市售蛋清粉,通过间接ELISA法,以人血清IgE结合力为指标评价蛋清粉中蛋清蛋白的致敏性,通过间接竞争ELISA法,以兔血清IgG结合力为指标评价蛋清粉中卵清蛋白的致敏性,利用紫外光谱、荧光光谱和电泳分析其结构及分子量变化,研究超声波协同糖基化修饰对蛋清粉结构和致敏性的影响,为脱敏蛋制品的研发提供更具实际参考价值的依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
蛋清粉:郑州奥冉化工有限公司;
卵清蛋白、羊抗兔酶标二抗、羊抗人酶标二抗:美国Sigma公司;
兔血清:自制;
人血清:美国PlasmaLab International公司;
其他试剂均为常用分析纯。
1.1.2 主要仪器设备
电泳仪:Mini protean Tetra MP4型,美国BIO-RAD公司;
酶标仪:SynergyH1型,美国Bio Tek公司;
荧光光谱仪:F-7000型,日本日立公司。
1.2 方法
1.2.1 样品处理 将蛋清粉用pH 8.0的磷酸盐缓冲液(phosphate buffered saline, PBS)稀释到10 mg/mL,离心后取上清液,再分别进行以下处理:
(1) 热处理:冻干处理后在70 ℃、相对湿度75%的条件下反应6 h。
(2) 糖基化:按糖∶蛋白质量比2∶1向溶液中加入葡萄糖,冷冻干燥后于70 ℃、75%相对湿度下反应6 h。
(3) 不同强度超声预处理结合糖基化:分别在120,360,600,840,1 080 W下超声15 min和在600 W下超声5,10,15,20,25 min,整个超声过程通过冰浴将溶液温度控制在20 ℃ 以下。然后按糖∶蛋白质量比2∶1加入葡萄糖,冷冻干燥后于70 ℃、75%相对湿度下反应6 h。
1.2.2 分子量测定 将样品用PBS稀释至10 mg/mL,加上样缓冲液后煮沸10 min,再离心20 s,使用5%的浓缩胶和12%的分离胶,样品上样量10 μL,80 V跑胶,结束后染色1 h,再用脱色液脱去底色。
1.2.3 内源性荧光测定 根据文献[10],将样品用PBS稀释成0.1 mg/mL,激发波长280 nm,在300~450 nm对发射波长进行光谱扫描。
1.2.4 表面疏水性测定 根据文献[11],以ANS为荧光探针,将样品用PBS稀释成一系列浓度梯度(0.25~2.00 mg/mL),取2 mL样品与10 μL ANS试剂混匀,在激发波长390 nm,发射波长400~600 nm的条件下进行测定。以样品浓度为横坐标,荧光强度为纵坐标作图,斜率为表面疏水性(H0)。
1.2.5 自由氨基含量测定 根据文献[12],将样品用PBS稀释成40 mg/mL,分别取10 μL样品和不同浓度(0.0~0.4 mg/mL)赖氨酸与200 μL OPA试剂混匀,避光反应2 min,于340 nm处测定其吸光值,根据赖氨酸标曲计算样品自由氨基含量。
1.2.6 卵清蛋白致敏性测定 以兔血清IgG结合力为指标,采用间接竞争ELISA法测定样品中的卵清蛋白致敏性。每孔加入100 μL 2 μg/mL卵清蛋白标品,4 ℃包被过夜,洗板,拍干;加250 μL 5%脱脂奶粉37 ℃封闭1 h,洗板,拍干;分别加50 μL卵清蛋白标品(0.25~64.00 μg/mL)和50 μL 40 μg/mL 样品,再加50 μL兔抗卵清蛋白血清,37 ℃温育1 h,洗板,拍干;加100 μL二抗37 ℃温育1 h,洗板,拍干;加100 μL显色液37 ℃反应15 min;加100 μL H2SO4终止反应,450 nm测吸光值。以卵清蛋白标品的浓度对数为横坐标,吸光值为纵坐标作图,通过线性函数得到样品致敏性,进而计算其降低率。
(1)
式中:
c——卵清蛋白致敏性降低率,%;
C0——未处理原样的致敏性,μg/mL;
C1——处理后样品的致敏性,μg/mL。
1.2.7 蛋清蛋白致敏性测定
(1) 血清库:1支对鸡蛋不过敏的血清以及4支对鸡蛋过敏的血清,4个患者(P1、P2、P3、P4)的病史见表1。
(2) 每孔加入100 μL 100 μg/mL的样品,4 ℃包被过夜,洗板,拍干;加250 μL 5%脱脂奶粉进行37 ℃封闭1 h,洗板,拍干;加100 μL人血清37 ℃温育1 h,洗板,拍干;加100 μL二抗37 ℃温育1 h,洗板,拍干;加100 μL显色液37 ℃ 反应15 min;加100 μL H2SO4终止反应,450 nm测吸光值。按式(2)计算IgE结合力。

表1 鸡蛋过敏患者病史Table 1 Clinical history of egg allergy patients' sera
A=A1-A0,
(2)
式中:
A——IgE结合能力;
A0——一抗为未对鸡蛋过敏的人血清所测得的吸光度;
A1——一抗为患者血清所测得吸光度。
1.2.8 数据统计与分析 Origin 9.0作图,SPSS 17.0分析显著性(P<0.05),平行试验至少3次。
2 结果与分析
2.1 分子量分析
如图1所示,经热处理、糖基化和复合处理后只有卵转铁蛋白条带几乎完全消失,说明卵转铁蛋白不稳定,易发生聚集。经糖基化和复合处理后卵清蛋白、卵类黏蛋白和溶菌酶的条带变浅且发生了轻微的上移,说明这3种蛋白发生了糖基化反应,并且复合处理后上移程度更大,说明超声预处理可以显著促进糖基化反应,该结果和Guan等[9]的一致。同时,不同功率超声波-糖基化处理后,其蛋白质条带的上移程度明显不同,呈先增加后降低的趋势,且在600 W时上移程度最大,说明相比于超声时间,功率对糖基化影响程度更大,并且适度的超声功率才能更好地促进糖基化反应。这可能是超声功率的增加影响了蛋白更深层的结构,促进更多的结构展开,使空间位阻更大程度地降低并暴露出更多的糖基化结合位点,促进糖基化反应,但过度超声也会使蛋白结构重新折叠[13]进而阻碍糖基化反应。

U0为未处理原样;C1为单独热处理;C2为单独糖基化处理;5,10,15,20,25,120,360,600,840,1 080分别代表600 W下超声5,10,15,20,25 min和120,360,600,840,1 080 W下超声15 min预处理后再进行糖基化的复合处理
图1 超声协同糖基化对蛋清蛋白分子量的影响
Figure 1 Ultrasound synergistic glycosylation on the molecular weight of egg white protein
2.2 内源性荧光分析
蛋白的内源荧光取决于色氨酸(Trp)和酪氨酸(Tyr)的极性以及蛋白质间、蛋白-配体间的相互作用[14]。如图2所示,复合处理后样品内源荧光强度随超声强度(时间和功率)的增加呈先降低后升高的趋势,在15 min、600 W时最低,且均低于单独糖基化的样品。这可能是超声产生的机械、空化等效应使蛋白质结构舒展,暴露更多的发色团发生荧光猝灭。并且糖基化可以使色氨酸环位置变化、蛋白结构改变、色氨酸等残基本身发生氧化,这些都会降低荧光强度[15]。过高强度超声后复合处理的样品荧光强度略微升高,可能是高功率或长时间的超声会使蛋白部分结构重新折叠,将部分暴露的发色团重新包埋。相比于热处理,经复合或糖基化处理后样品的内源荧光变化程度更小,说明糖基化可以一定程度稳定蛋白结构避免热处理对蛋白结构的过度破坏[16]。

图2 超声协同糖基化对蛋清蛋白内源荧光强度的影响
Figure 2 Ultrasound synergistic glycosylation on the intrinsic fluorescence intensity of egg white protein
2.3 表面疏水性分析
表面疏水性(H0)是蛋白分子表面疏水基团与极性水分子环境接触数量的指标,可反映蛋白的结构变化。如图3所示,复合处理后H0随超声强度的增加呈先升高后降低的趋势(15 min、600 W达到最大),且均高于未处理原样,而单独糖基化后样品的H0显著降低。这可能是糖基化可以通过外接亲水性基团提高亲水性并将更多的疏水基团包埋进内部,并且糖基化后样品内源荧光图谱发生轻微的红移,说明糖基化通过改变蛋白结构增强其极性,使H0显著降低。而复合处理过程中,尽管促进糖基化会降低疏水性,但超声诱导空化作用使蛋白的球形结构变为网状结构,大量暴露内部疏水基团,还能通过破坏蛋白的疏水性相互作用诱导变性,最终显著增加疏水性[17-18]。在15 min、600 W时H0最大也说明该条件下蛋白结构的展开程度最大,进一步增加超声强度会使展开的蛋白重新折叠,将部分疏水基团重新包埋进内部。
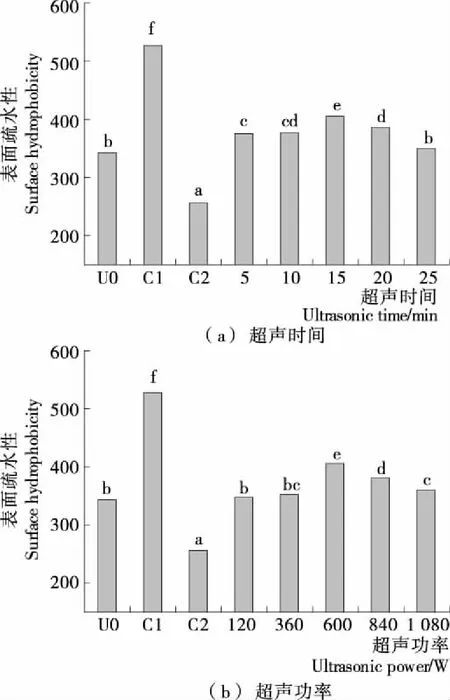
U0为未处理原样;C1为单独热处理;C2为单独糖基化处理;不同字母表示差异显著(P<0.05)
图3 超声协同糖基化对蛋清蛋白表面疏水性的影响
Figure 3 Ultrasound synergistic glycosylation on the surface hydrophobicity of egg white protein
2.4 自由氨基含量分析
自由氨基含量可以反映糖基化程度。如图4所示,复合改性后样品自由氨基含量随超声强度的增加呈先降低后升高的趋势(15 min、600 W达到最大),且均低于糖基化后的样品。说明随着超声强度的增加,蛋白结构逐渐展开,可以有效促进糖基化反应的进行,在超声强度超过15 min或600 W 时,蛋白分子重新折叠、聚集使空间位阻增加阻碍了糖基化反应进行。
2.5 卵清蛋白致敏性分析
卵清蛋白是蛋清蛋白最主要的过敏原[19]。如图5所示,复合处理后蛋清粉中卵清蛋白致敏性降低率随超声强度的增加呈先升高后降低的趋势(15 min、600 W达到最大),且均高于单独糖基化的样品。这是因为复合处理过程中,超声可以展开蛋白结构修饰构象表位、促进糖基化反应,而糖基化也能通过改变蛋白结构修饰构象表位,还能通过外接糖分子阻塞线性表位[20],最终使过敏表位得到更全面的修饰。并且其致敏性变化与蛋清蛋白的结构变化明显一致,说明卵清蛋白对蛋清蛋白结构影响显著。对比实验室的前期研究发现,相同条件下高纯度卵清蛋白致敏性与杂蛋白(蛋清粉)中卵清蛋白致敏性的变化趋势基本一致,但蛋清粉中卵清蛋白的致敏性降低效果较差,可能是杂蛋白中不同抗原间普遍存在交叉反应[21],这会增强抗体的反应性,而且作为未处理原样的市售蛋清粉的部分构象表位可能已经在传统加工中得到修饰。

U0为未处理原样;C1为单独热处理;C2为单独糖基化处理;不同字母表示差异显著(P<0.05)
图4 超声协同糖基化对蛋清蛋白自由氨基的影响
Figure 4 Ultrasound synergistic glycosylation on the free aminos of egg white protein

C1为单独热处理;C2为单独糖基化处理;不同字母表示差异显著(P<0.05)
图5 超声协同糖基化对蛋清蛋白中卵清蛋白致敏性的影响
Figure 5 Ultrasound synergistic glycosylation on the antigenicity of allergenicity from egg white protein
2.6 蛋清蛋白致敏性分析
不同患者的IgE结合能力不同[22]。如图6所示,经复合改性后样品的IgE结合能力随超声强度的增加呈先降低后增加的趋势,并在15 min、600 W时最低。这是因为超声有效促进了糖基化反应的进行,蛋白结构改变使更多的构象表位被修饰,并且通过接入糖分子也使大量线性表位被阻塞,致敏性显著降低。而过低或过高超声强度的IgE结合能力会高于单独糖基化,说明超声在展开蛋白结构促进糖基化反应的同时也暴露了更多的过敏表位,使致敏性增强,但仍低于未处理原样。通过与卵清蛋白致敏性的对比可以发现,二者的总体趋势是一致的,可能是卵清蛋白是蛋清蛋白最主要的过敏原,可以很好地反映蛋清蛋白的变化。但蛋清粉中不致敏的蛋白也会结合葡萄糖甚至阻碍糖与致敏蛋白接触,降低糖基化对致敏蛋白的修饰效果,同时包含多种抗原的杂蛋白存在着更复杂的交叉反应,在某抗原表位被修饰的过程中可能产生某些可被其他抗体识别的过敏表位,并且卵清蛋白含有20个糖基化位点,是糖基化效果最显著的蛋白[23],所以与卵清蛋白相比,蛋清蛋白经复合处理后致敏性降低程度较低,但效果仍显著。
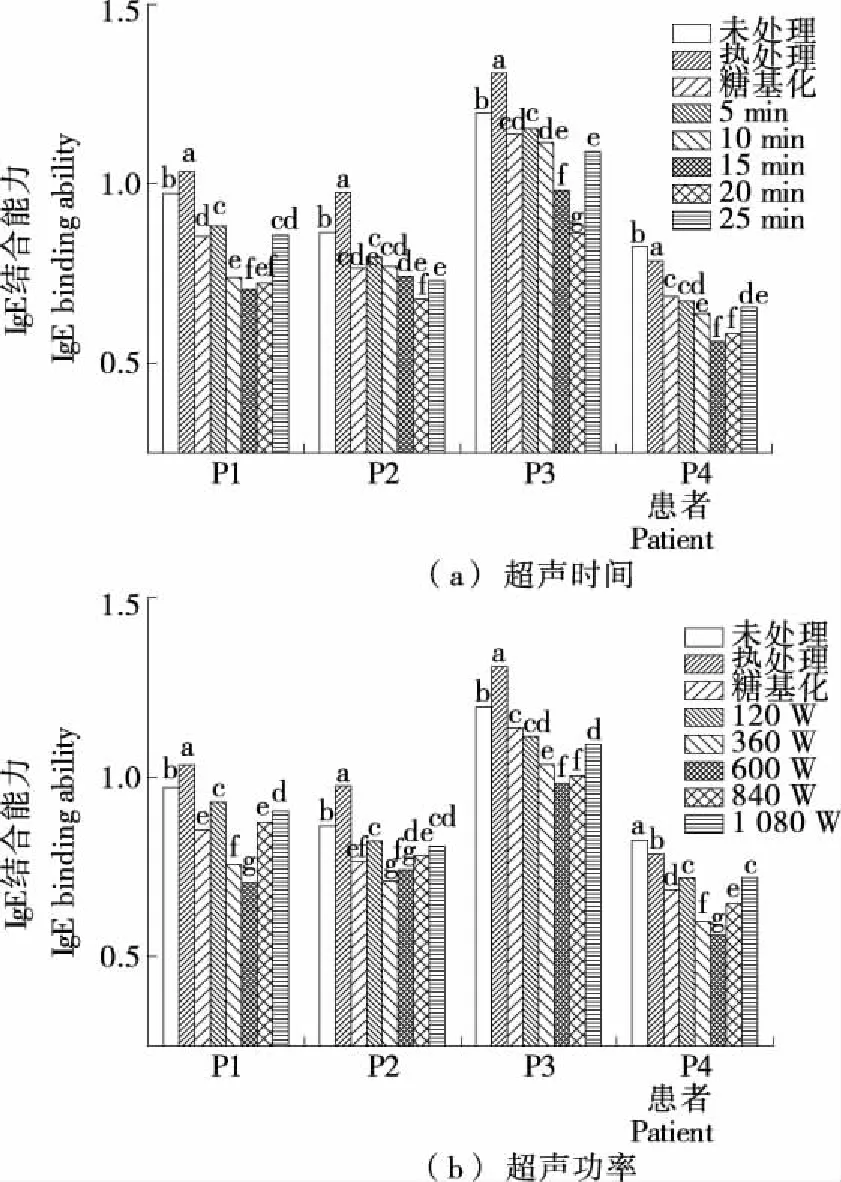
不同字母表示差异显著(P<0.05)图6 超声协同糖基化修饰对蛋清蛋白致敏性的影响
Figure 6 Ultrasound synergistic glycosylation on the allergenicity of egg white protein
3 结论
复合处理会改变蛋清蛋白结构从而使蛋白的致敏性发生变化,随着超声强度的增加蛋清粉中蛋清蛋白致敏性显著降低,致敏性随超声强度的增加呈先增加后降低的趋势,且在15 min、600 W的条件下有最大程度降低。同时,蛋清蛋白中的卵清蛋白致敏性也与蛋清蛋白结构变化相符,在15 min、600 W时有最大程度降低且降低程度比蛋清蛋白更显著。说明研究卵清蛋白致敏性也可以一定程度地反映蛋清蛋白的致敏性变化趋势。也说明超声波协同糖基化修饰是一种良好的降低蛋清粉致敏性的方法,可为脱敏蛋制品的开发提供理论指导。

