喷施不同浓度钙试剂对花后榛子果实生长及结实率的影响1)
陈龙涛 樊明寿 王迎男 杨博文 张会弟 耿婉婷
(内蒙古农业大学,呼和浩特,010018) (吉林师范大学)
榛子(CorylusheterophyllaFisch)属于桦木科榛属植物,与扁桃(AmygdaluscommunisL.)、核桃(Juglansregia)、腰果(AnacardiumoccidentalieLinn)并称为世界四大坚果,具有较高的营养价值[1-3]。我国榛子种植面积达到2万hm2,主要分布于黑吉辽、西南横断山脉部分地区以及华北和西北等24省[4-6]。由于榛子具有较为特殊延迟受精的生物学习性,在受精过程中引起的胚败育及受精至收获期发生的败育最终导致落果[7],直接影响榛子收获产量,导致低收益的经济问题突显,严重制约榛子种植业的可持续发展。
钙是植物生长所必须需的重要营养元素[8],在维持细胞功能、控制植物体内碳氮代谢、促进植物生长发育及基因表达等方面起着关键的作用[9-11],同时,钙元素在花粉管萌发的过程中能够起着重要的调控功能[12]。丁蕾[13]研究发现,当胞质Ca2+浓度增加到一定的范围后,直接激活花粉内依赖Ca2+的生理生化反应,进而促进花粉管的萌发及受精作用;邱超等[14]在Ca2+对胡柚的生长研究中发现,Ca2+能显著提高胡柚的果实产量。乙二醇双(2-氨基乙基醚)四乙酸(EGTA)是Ca2+的专一性螯合剂,能够与植物体内Ca2+螯合,从而降低植物体内游离的Ca2+。周卫等[15]研究发现,EGTA能够阻止植物细胞中Ca2+与钙调蛋白(CaM)的结合反应,进而影响植物体内的生理代谢过程。
近些年随着我国对榛子种植产业的重视程度不断加大,榛子品种选育等方面取得显著成效[16],但榛子种植的配套技术还在不断完善,尤其在营养调控方面研究较为薄弱。魏丽红等[17]研究发现,从花粉的萌发到榛子子房(幼果)的迅速发育,该时期是细胞组织生理代谢活动最旺盛的时期,需要足够的矿质营养供应,应注重养分积累。因此,本试验通过在榛子花后进行连续喷施不同浓度钙的CaCl2溶液及EGTA溶液处理,分析钙元素对榛子果实发育的影响、促进榛子果实发育的有效因子及适宜浓度,为提高榛子的收获产量提供参考。
1 材料与方法
试验于2015年在吉林省四平市山门镇榛子试验园进行(东经124°30′16″,北纬43°9′20″)。试验区属于中高纬度下的大陆性温带季风区,年均气温5.9 ℃,年均降水量572.8 mm,无霜期135~140 d。土壤类型为暗棕壤,pH为5.4~6.6。试验材料为当地主栽品种达维和薄壳红2个品种,供试树体10年生,株高2.5~3.0 m,株距×行距为3 m×4 m,种植密度为840株·hm-2。
试验设计:在2015年4月初(榛子雄花未开放时)采集适当雄花枝条进行实验室温室培养,雄花开始散粉,用硫酸纸进行花粉收集,待雌花开花后施于雌花柱头上,并检测花粉萌发率为86%。对雌花序进行人工授粉并挂牌标记,在开花授粉后每隔3 d进行CaCl2溶液及EGTA溶液喷施处理,共计3次,喷施程度以叶面均匀布满雾状水滴为宜。CaCl2与EGTA的浓度均为3个浓度梯度,分别为5、10、20 mmol·L-1,以清水作为对照。每个浓度处理选择长势良好、树形较为一致的榛子树6棵进行喷施。在花后40、50、60 d及果实成熟期进行采样测定。
钙试剂处理的果实直径测定:在花后40、50、60 d,选择长势良好、树形较为一致的挂牌标记处理的榛子树每个处理随机采取30个果实,应用SMZ-168型解剖显微镜及显微标尺对榛子果实直径进行测量,求平均值,试验进行3次重复。
钙试剂处理的果实数量特征统计:在果实成熟期,采收挂牌标记的全部果簇,对每个果簇的平均果实数量、每个果簇中平均败育数量、每个果簇的败育率及坐果率进行统计。上述调查统计重复3次,每次重复50个果簇。每个果簇中果实败育率={每个果簇中败育果实数量/(每个果簇中平均果实数量+每个果簇中败育果实数量)}×100%;坐果率={标记的雌花花序得到的正常果实数量/(标记的雌花花序数量×每个花序包含的平均雌花数量)}×100%。
数据处理:采用SAS 8.01和Microsoft Excel 2016对试验数据进行统计分析,并运用邓肯氏检验法进行显著性差异检验。
2 结果与分析
2.1 不同浓度钙试剂处理对花后榛子果实大小变化的影响
在盛花期喷施不同浓度的CaCl2溶液,花后40、50、60 d对两品种的果实直径进行测定发现,均高于清水对照处理,且随着CaCl2溶液浓度的增加果实直径增大明显(见表1)。花后40 d,达维果实直径分别增加了7.32%、14.63%、17.07%,薄壳红果实直径分别增加了7.05%、12.82%、16.67%,且CaCl2溶液浓度为10、20 mmol·L-1时与清水对照相比达到显著差异水平。花后50 d,达维果实直径分别增加了4.82%、7.23%、8.84%,CaCl2溶液浓度为20 mmol·L-1时与清水对照相比达到显著差异水平;薄壳红果实直径分别增加了5.91%、9.28%、11.39%,CaCl2溶液浓度为10、20 mmol·L-1时,与清水对照相比均达到显著差异水平。花后60 d,达维果实直径分别增加了3.21%、6.22%、7.23%,不同CaCl2溶液浓度与清水对照相比差异不显著;薄壳红果实直径分别增加了5.58%、9.66%、12.23%,CaCl2溶液浓度为10、20 mmol·L-1时,与清水对照相比均达到显著差异水平。
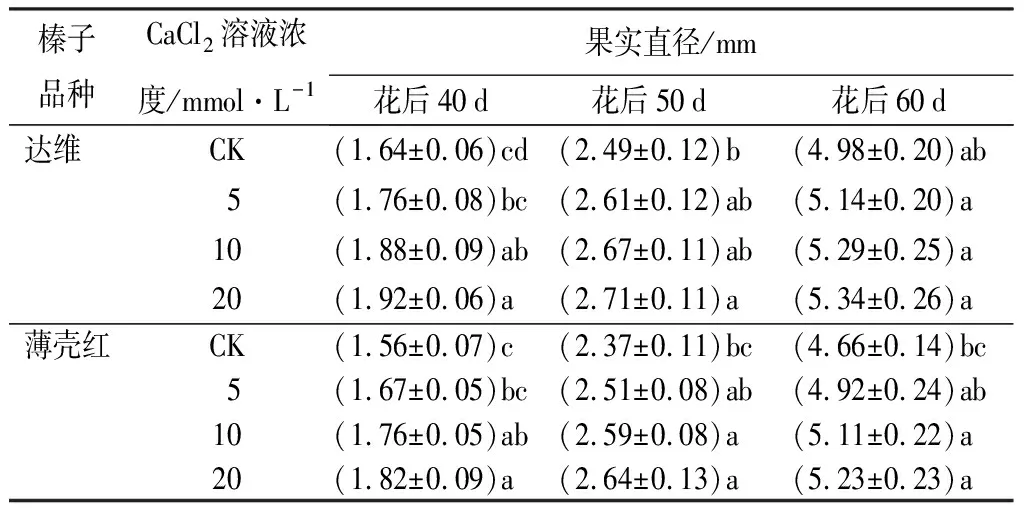
表1 不同浓度CaCl2溶液处理花后榛子果实直径变化的差异
注:表中数据为“平均值±标准差”;同一品种内,同列数据后不同字母表示差异显著(P<0.05)。
在盛花期连续对2个品种喷施不同浓度的EGTA溶液,花后40、50、60 d进行果实直径的测量,果实直径随喷施EGTA溶液浓度的增高而减小,且均小于清水对照处理(见表2)。花后40 d,达维果实直径分别降低了5.49%、8.54%、9.76%,EGTA溶液浓度为10、20 mmol·L-1时与清水对照相比达到显著差异水平;薄壳红果实直径分别降低了8.97%、12.18%、17.31%,且EGTA溶液浓度为5、10、20 mmol·L-1时与清水对照相比均达到显著差异水平。花后50 d,达维果实直径分别降低了11.24%、14.06%、16.06%,EGTA溶液浓度为5、10、20 mmol·L-1时与清水对照相比达到显著差异水平;薄壳红果实直径分别降低了5.49%、8.86%、15.19%,EGTA溶液浓度为10、20 mmol·L-1时与清水对照相比达到显著差异水平。花后60 d,达维果实直径分别降低了6.83%、11.24%、13.86%,薄壳红果实直径分别降低了5.36%、8.58%、9.23%,且EGTA溶液浓度为10 mmol·L-1及20 mmol·L-1时与清水对照相比均达到显著差异水平。
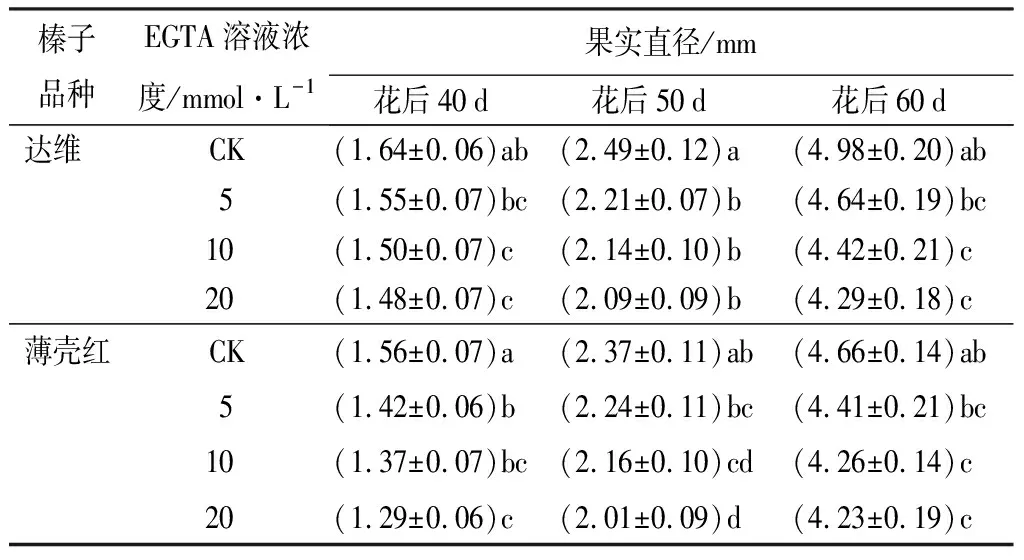
表2 不同浓度EGTA溶液处理花后榛子果实直径变化的差异
注:表中数据为“平均值±标准差”;同一品种内,同列数据后不同字母表示差异显著(P<0.05)。
2.2 不同浓度钙试剂处理对榛子果簇结实率的影响
由表3可见:2个品种成熟期,每个果簇中平均果实数量随盛花期喷施CaCl2溶液浓度提高而增加,且与清水对照相比均达到显著差异水平,达维平均果实数量分别提高16.67%、40.41%、46.53%,薄壳红平均果实数量分别提高12.95%、28.42%、30.22%。2个品种每个果簇中败育果实数量随喷施CaCl2溶液浓度提高而降低,达维败育果实数量分别降低8.00%、16.34%、18.81%,且均与清水对照相比呈显著差异;薄壳红败育果实数量分别降低5.21%、11.43%、12.16%,CaCl2溶液浓度为10、20 mmol·L-1时与清水对照相比呈显著性差异。2个品种每个果簇中果实败育率与每个果簇中败育果实数量变化趋势较为一致,随喷施CaCl2溶液浓度提高而降低,且CaCl2溶液浓度为10、20 mmol·L-1时与清水对照相比均呈显著性差异。2个品种坐果率随花期喷施CaCl2溶液浓度升高而提高,且CaCl2溶液浓度为5、10、20 mmol·L-1时与清水对照相比均呈显著性差异,达维坐果率分别提高25.94%、58.09%、63.16%,薄壳红坐果率分别提高22.02%、49.80%、54.46%。
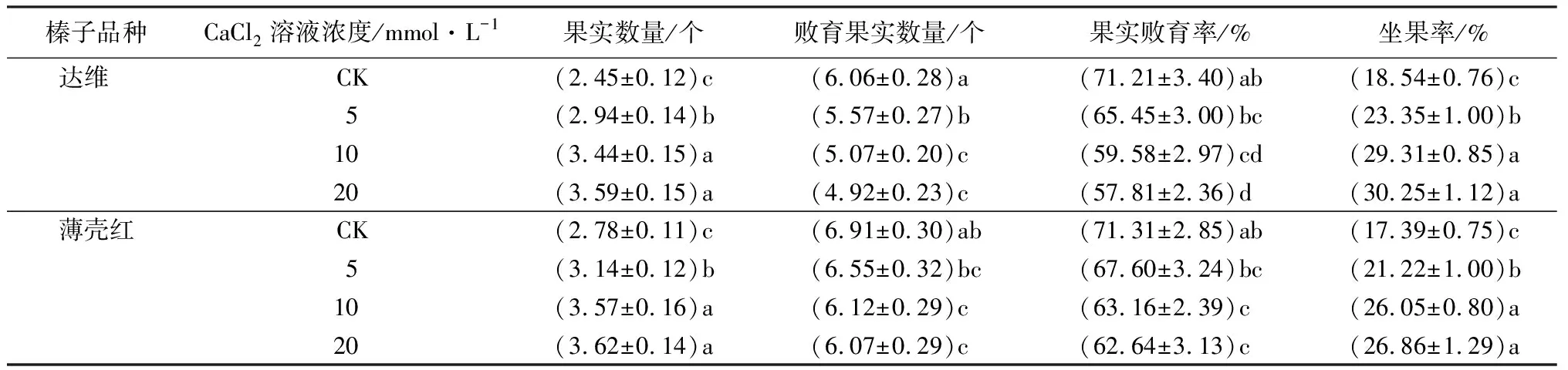
表3 不同浓度CaCl2溶液处理榛子果簇结实率的差异
注:表中数据为“平均值±标准差”;同一品种内,同列数据后不同字母表示差异显著(P<0.05)。
由表4可见:2个品种果实成熟后,每个果簇中平均果实数量随盛花期喷施EGTA溶液浓度升高而降低,且EGTA溶液浓度为10、20 mmol·L-1时与清水对照处理相比均达到显著性差异水平,达维平均果实数量分别降低8.57%、19.59%、24.90%,薄壳红平均果实数量分别降低5.76%、16.91%、23.38%。每个果簇中败育果实数量随EGTA溶液浓度升高而升高,2个品种在EGTA溶液浓度为20 mmol·L-1时与清水对照相比均呈显著性差异;其中,达维败育果实数量分别升高3.47%、7.92%、10.07%,薄壳红败育果实数量分别升高2.32%、6.80%、9.41%。2个品种每个果簇中果实败育率与每个果簇中败育果实数量变化趋势较为一致,随喷施EGTA溶液浓度升高而升高,2个品种在EGTA溶液浓度为20 mmol·L-1时与清水对照相比均呈显著性差异。2个品种坐果率随着EGTA溶液浓度升高而降低,且3个浓度处理与清水对照相比均呈显著性差异;其中,达维坐果率分别降低20.77%、34.47%、44.12%,薄壳红坐果率分别降低10.47%、27.60%、41.35%。
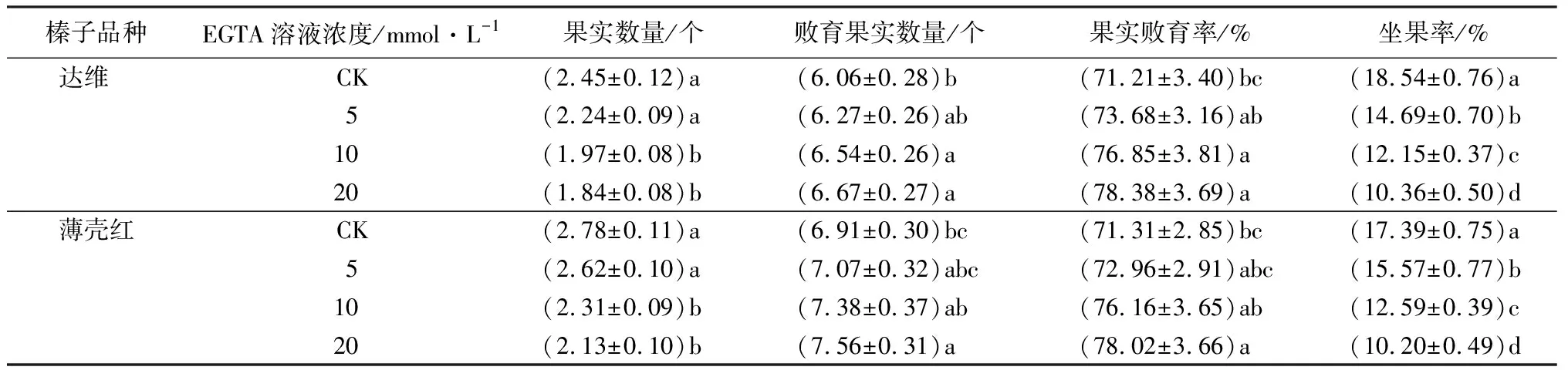
表4 不同浓度EGTA溶液处理花后榛子果簇结实率的差异
注:表中数据为“平均值±标准差”;同一品种内,同列数据后不同字母表示差异显著(P<0.05)。
2.3 榛子果实直径变化与榛子果簇结实率的相关性
由表5可见:2种试剂喷施后,榛子果实直径与每个果簇中果实败育率及坐果率呈相似的相关关系,说明榛子开花40 d后是果实发育的重要时期,这个时期通过有效农业措施的调控直接影响榛果的最终形成。
在花期喷施CaCl2溶液处理的2个品种,在花后40、50、60 d果实直径大小与每个果簇中果实败育率呈现显著负相关关系、与坐果率呈显著正相关关系。其中,达维在花后40、60 d与每个果簇中果实败育率及坐果率呈现极显著关系,而薄壳红各时期均呈现显著相关关系,这与2个品种存在品种间差异有关,在生长发育过程中的各阶段对Ca2+的需求及敏感性有所不同。
对花期喷施EGTA溶液处理,分析花后榛子果实直径变化与果簇结实率相关性发现,40、50、60 d两个品种果实直径大小,与每个果簇中果实败育率呈现负相关关系、与坐果率呈正相关关系,个别时期关系不显著,这说明EGTA与榛果中Ca2+结合形成螯合物,使得榛果内Ca2+浓度降低,其对不同生育时期的生长发育影响程度有所不同。
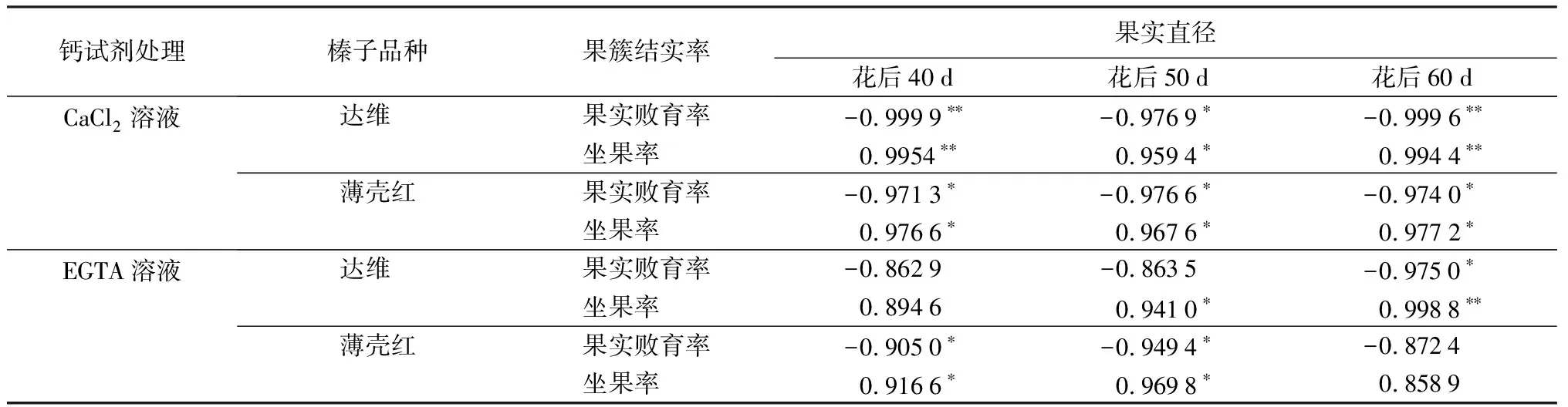
表5 喷施钙试剂处理花后榛子果实直径变化与榛子果簇结实率的相关性
注:*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。
3 结论与讨论
钙是植物体内重要营养元素,在植物生命周期中承担着极其关键的生理功能,有着“植物细胞代谢的总调节者”之称[18]。植物体内的钙,一方面与细胞壁构成及细胞的功能稳定有着重要的关系[19],影响着生长过程中矿物质的吸收;另一方面钙能够与作为细胞信使的钙调蛋白结合,对植物体内的生理代谢过程进行调控,进而促进植物的生长[20]。孙大业等研究发现,Ca2+能够降低原生胶体的分散度,调节原生质的胶体状态,使细胞充水度、黏滞性、弹性以及渗透性等发生改变,使其适应植物生长。当植物受到外界环境刺激胁迫时,细胞膜透Ca2+通道开启,胞内Ca2+迅速增加,Ca2+与CaM结合后活化CaM,然后激活相应的靶酶,引发相应的生理生化反应,进而调控植物的正常生长[18,21]。王芳等在Ca2+对花生的生长研究中发现,Ca2+能够显著促进花生各生长期的株高及鲜质量等生长指标[22],同时可以提高植株叶片氮代谢酶活性及不同形态氮含量,提高产量及品质[9],这表明Ca2+能够增强植物体内氮代谢酶活性,提升了植株的光合作用及蛋白质的合成能力,使得植株得到显著增长。EGTA是钙离子的抑制剂,通过与植物细胞中Ca2+鳌合而降低植物细胞中参与代谢的Ca2+,从而抑制植物的生长发育,在研究中通常作为Ca2+的对照组进行相关研究。Friedman et al.在研究Ca2+对牵牛花生长的影响中发现,对牵牛花子叶施加EGTA,可抑制其开花等生长发育及生理生化反应[23]。本试验在花后连续喷施不同浓度的CaCl2溶液及EGTA溶液与喷施清水作对照,在花后40、50、60 d测定榛子果实直径大小发现,高浓度的CaCl2溶液能够促进果实的生长,且不同时期与对照组均达到显著差异水平;说明在榛子生长前期对其施加一定浓度的Ca2+,对果实后期的生长发育具有一定的促进作用,这与冯静等研究适宜钙浓度促进黄瓜生长的结论相一致[8]。这表明,一定浓度的Ca2+能够影响植物细胞内的正常有丝分裂,从而促进组织旺盛生长,同时,钙是植物体内部分酶的组分和活化剂,参与植物体内的氮代谢及碳水化合物的代谢,最终影响果实的生长[18,24]。EGTA处理,随浓度的升高抑制果实增长的作用明显加强,这与罗充等研究EGTA处理对刺梨果实发育抑制显著较一致[25]。
植物果实的发育通常与其花的发育为基础,花粉在雌蕊柱头上萌发不顺利、萌发速度较慢及花粉管的萌发最终不能到达子房完成正常的受精,均会严重影响果实的最终成果率。由于榛子具有特殊的延迟受精生物学习性,果实败育现象频繁发生[26]。榛子花后2 d花粉在柱头萌发并伸长生长,大约花后10 d停滞生长,此时花柱基本的子房原基迅速生长,花后15~24 d花粉管腔的直径和长度增长明显,24 d后花粉管继续伸长生长,子房在此过程中保持快速生长状态[6]。于晓俊等认为,花粉管生长受其顶端的限制,其生长速率与管顶端Ca2+的浓度呈正相关关系[27],通过外援钙的喷施调控可以影响植物花粉管的长势而完成受精作用。刘剑锋等研究发现,梨果等受精作用后,Ca2+与CaM含量均增加[28],部分败育子房不能形成正常的果实而最终导致落果[6]。本试验通过以清水为对照,在花后喷施不同浓度的CaCl2溶液及EGTA溶液发现,Ca2+浓度显著影响2个品种榛子的坐果率及败育率,同时发现,花后果实大小与坐果率及败育率有显著相关关系;这表明,通过喷施Ca2+在影响花粉管长势的同时对子房的生长起到了促进作用,提升了受精作用的效果,进而降低了果实的败育率,提高其坐果率;这与孙鹏等研究得出钙离子对花粉管的生长具有诱导作用并促进受精作用的结论相一致[29-30]。EGTA处理,表现出与CaCl2处理相反的效果,这与关军峰等对苹果果实发育中随EGTA浓度提高,EGTA抑制花粉萌发和花粉管生长的效应增强的结论较为一致[31]。
综上,本试验结果表明,通过花后喷施不同浓度钙的CaCl2溶液,可以促进当地2个主栽榛子品种果实的发育,提高果实的坐果率,降低果实的败育率,且随浓度的升高促进效果显著。喷施不同浓度的EGTA溶液,在一定程度上抑制了果实的发育,降低了果实的坐果率,提高了果实的败育率,且随浓度的增加抑制效果增强。通过对花后不同阶段榛子果实大小与成果率相关分析得出,不同阶段的果实大小与坐果率呈显著正相关关系、与败育率呈负相关关系。试验得到与前人相关研究较为一致的结果,但从分子水平上分析Ca2+如何进行调控榛子果实生长发育的机理有待深入研究。

