四倍体马铃薯块茎蛋白含量分子标记的开发与验证
单洪波 史佳文 石 瑛
东北农业大学农学院, 黑龙江哈尔滨 150030
蛋白含量是马铃薯块茎的重要品质性状, 也是重要的育种目标之一[1]。张泽生等[2]对马铃薯蛋白的氨基酸组成深入研究证实, 块茎内含有较高的必需氨基酸, 占其总量的47.90%左右。潘牧等[3]研究表明, 马铃薯蛋白的第一限制氨基酸为色氨酸, 且富含其他粮食作物所缺乏的赖氨酸, 可与大豆蛋白等谷类蛋白互补。通过对动物与人类试验证明, 马铃薯蛋白富有较高的生物价值[4-5]。因此, 马铃薯块茎蛋白是一种优质蛋白, 营养价值极高, 高蛋白含量马铃薯品种的选育能够提升马铃薯的营养价值。
传统的马铃薯育种周期较长, 筛选效率较低, 并伴随精确度低等诸多弊端, 分子标记辅助选择能极大地缩短育种年限, 提高育种效率。目前, 已有数十个马铃薯重要性状被标记, 例如抗病毒病、抗青枯病、抗晚疫病等抗病性状[6-7]; 炸片颜色、薯肉颜色等品质性状[8]; 耐干旱、抗冻性等抗性性状[9]。祁缘[10]通过BSA策略结合与QTL区域紧密连锁的分子标记DMC42144af、DMC42152bf, 将2个马铃薯晚疫病 AFLP标记定位在第 9染色体上的一个QTL dPI09a置信区间内; 雷剑等[11]根据 BSA混池方法开发了与马铃薯青枯病抗性紧密连锁的SRAP标记; Rak等[12]利用多倍体模型全基因组关联分析将薯片颜色 QTL定位到第2染色体的短臂上; Tiwari等[13]将源于二倍体马铃薯中的BR基因分子标记用于马铃薯抗晚疫病性状的筛选, 但在四倍体马铃薯材料的实际应用中, 复杂的遗传方式使目的性状与标记分离, 并伴随筛选准确率低等诸多问题。有关块茎蛋白含量的分子标记研究较少, 邬信康等[14]根据限制性片段长度多态性分析(RFLP)和脉冲电泳分析, 表明马铃薯蛋白多基因簇位于第 8染色体的 1.4 Mb的DNA片段上。随着BSA混池方法与测序技术的不断成熟, 高筛选效率与精准度得到了极大的保障, 能够为分子辅助育种提供新的标记资源。在四倍体水平上对马铃薯蛋白含量相关分子标记的开发与研究有利于加速马铃薯蛋白含量分子辅助育种进程。
本研究以四倍体马铃薯蛋白含量分离群体为材料,利用BSA混池构建与高通量简化基因组测序相结合(以下简称BSA混池测序), 开发四倍体马铃薯蛋白含量的分子标记, 并经极端高蛋白、极端低蛋白群体材料及四倍体马铃薯品种的验证, 获得与四倍体马铃薯蛋白质含量相关的分子标记, 为分子辅助育种提供便利, 也为加快优质马铃薯品种的选育提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 F1代分离群体 以蛋白含量 2.32%的高蛋白品种大西洋为母本, 蛋白含量1.31%的低蛋白品种定薯1号为父本, 杂交获得 173份 F1代分离群体, 以亲本和 F1代分离群体作为开发蛋白含量分子标记的试验材料。
1.1.2 供试品种 选取54个四倍体马铃薯品种作为蛋白含量分子标记的验证材料(表1)。
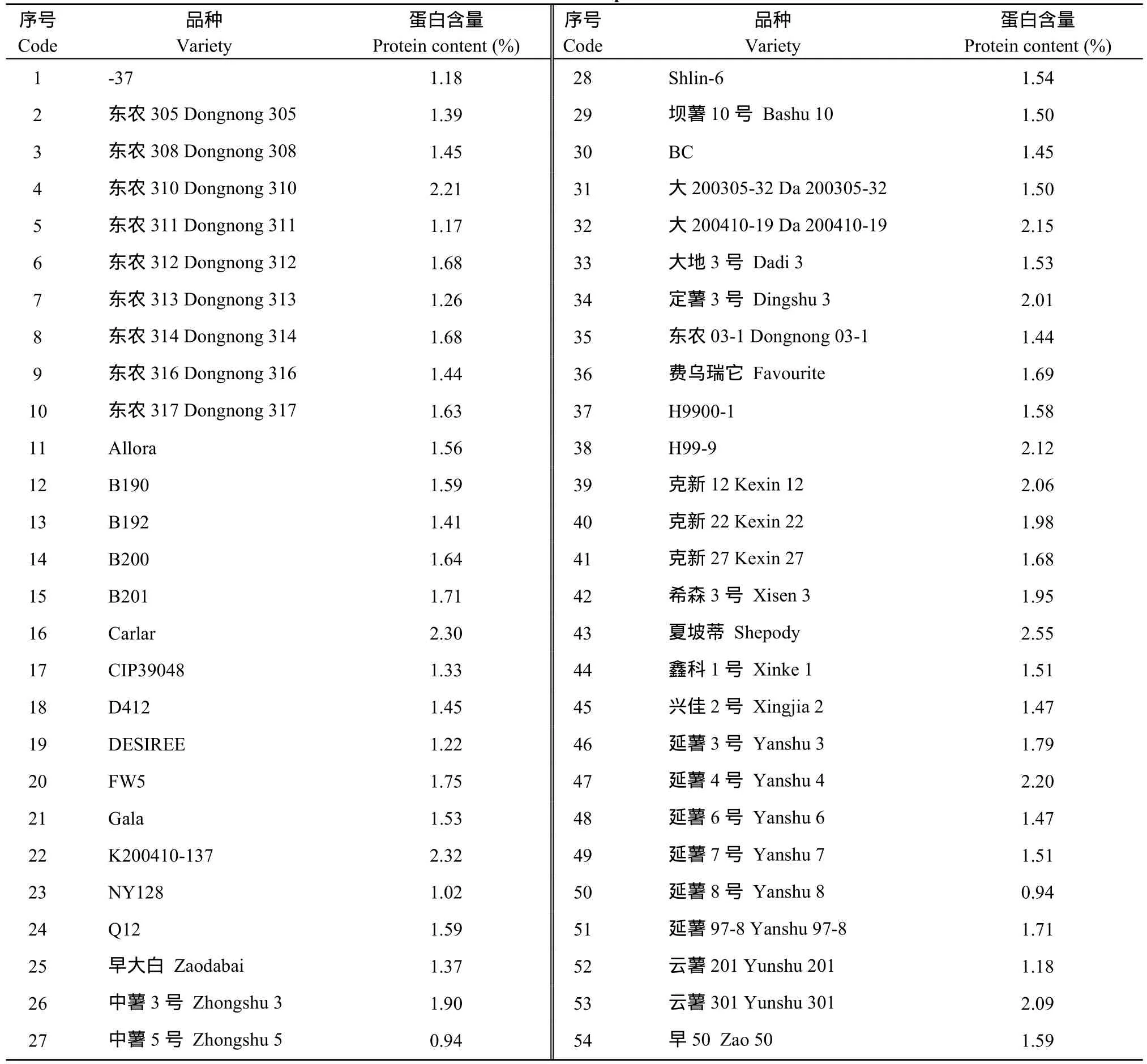
表1 马铃薯品种信息Table1 Information of potato varietie s
1.2 分离群体及四倍体品种蛋白含量的测定
2016—2017年连续 2年将分离群体种植于东北农业大学向阳农场实验基地, 每份材料种植7株, 于收获期收获材料, 选取每份材料3株进行样品处理。将粉碎并通过40~60目/寸网筛的试样0.1 g置洗涤干净且烘干的消化管中, 加入1 mL水和5 mL浓硫酸放置过夜。
将消化管放入通风橱中的消煮炉上, 设置温度为400~450℃, 每隔 15 min加3~4滴催化剂过氧化氢。待样品消化至澄清透明且无杂质, 取下放凉, 同时做空白试验。
将消化好的样品经凯氏定氮仪检测, 得到全氮含量,换算成蛋白含量。
1.3 DNA的提取与极端分离后代DNA混池的构建
采用 CTAB法提取马铃薯材料基因组 DNA, 用琼脂糖凝胶电泳检测DNA质量。
分别构建极端高蛋白含量和极端低蛋白含量后代的DNA混池, DNA的提取方法与质量检测方法同上。
1.4 标记开发
建库、简化基因组测序由上海欧易生物医学科技有限公司帮助完成, 根据测序结果获得了极端高蛋白与极端低蛋白混池间的差异片段, 参照马铃薯基因组序列网站(http://solanaceae.plantbiology.msuedu/pgsc_download.sht ml)对差异片段内的差异标签的位点利用在线引物设计网站(http://www.yeastgenome.org/cgi-bin/web-primer)进行引物的设计。将Tm值设定在55℃~60℃之间, 引物预扩增片段大小设定在400~900 bp之间。将设计好的引物送至博仕生物工程有限公司进行合成。
以高蛋白马铃薯品种大西洋和低蛋白马铃薯品种定薯1号的基因组DNA为模板进行PCR扩增, 选择仅能在亲本之一中扩增出条带或者在双亲中扩增出不同条带的引物用于开发SCAR标记。最后对极端分离群体材料进行标记验证。通过1.2%琼脂糖凝胶电泳对PCR产物进行质量与特异性检测。PCR体系为20 μL, 含8.2 μL ddH2O、10 μLTaq-Plus PCR Forest Mix (2×)、0.4 μL 引物 F (10 μmol L–1)、0.4 μL 引物 R (10 μmol L–1)、1 μL DNA (100 ng μL–1)。PCR扩增条件设定为预变性95℃ 3 min; 变性95℃ 30 s, 退火58℃ 30 s, 延伸72℃ 50 s, 35个循环; 终延伸72℃ 10 min。
1.5 标记的检测
分别以马铃薯F1代分离群体的74份高蛋白群体材料、42份低蛋白群体材料及54个四倍体马铃薯品种的基因组DNA作为模板, 以分子标记SCAR8-107为引物进行PCR扩增后利用琼脂糖凝胶电泳进行PCR产物的检测。
1.6 数据统计和处理
根据分子标记检验结果, 将与高蛋白含量亲本和低蛋白含量亲本带型一致的基因型分别记作1和0, 通过统计分析软件SPSS的Pearson’s双侧检验对分子标记检测结果与蛋白含量的鉴定结果进行双侧相关性分析。
2 结果与分析
2.1 蛋白含量的测定
测量获得蛋白含量大于2.0%的高蛋白材料74份, 蛋白含量小于1.5%的低蛋白材料42份以及介于1.5%~2.0%之间的中蛋白含量材料57份(表2); 经对分离群体蛋白含量的测定得到了分离群体的蛋白含量分布图, 可以看出极端材料较少, 中等蛋白含量材料较多, 并且曲线大致呈正态分布(图1)。说明马铃薯蛋白含量为数量性状。

图1 群体蛋白含量分布Fig. 1 Distribution of group protein content

表2 群体蛋白含量的测定结果Table 2 Determination of group protein content
2.2 蛋白含量基因区段引物的设计与检测
根据前期测序的结果, 在第 8染色体上 1.151~1.248 Mb区间内得到了目的性状的差异片段, 此片段与控制马铃薯高蛋白含量相关联, 区间大小在 97 kb,在该区段共设计引物34对(表3), 分别以高蛋白亲本品种大西洋与低蛋白亲本品种定薯1号的基因组DNA为模板对设计的引物进行特异性检测(图 2)。在该区段设计的引物中, 引物8-107展现出在差异蛋白含量亲本中的特异性, 即在高蛋白含量亲本扩增有条带, 低蛋白亲本无扩增条带。
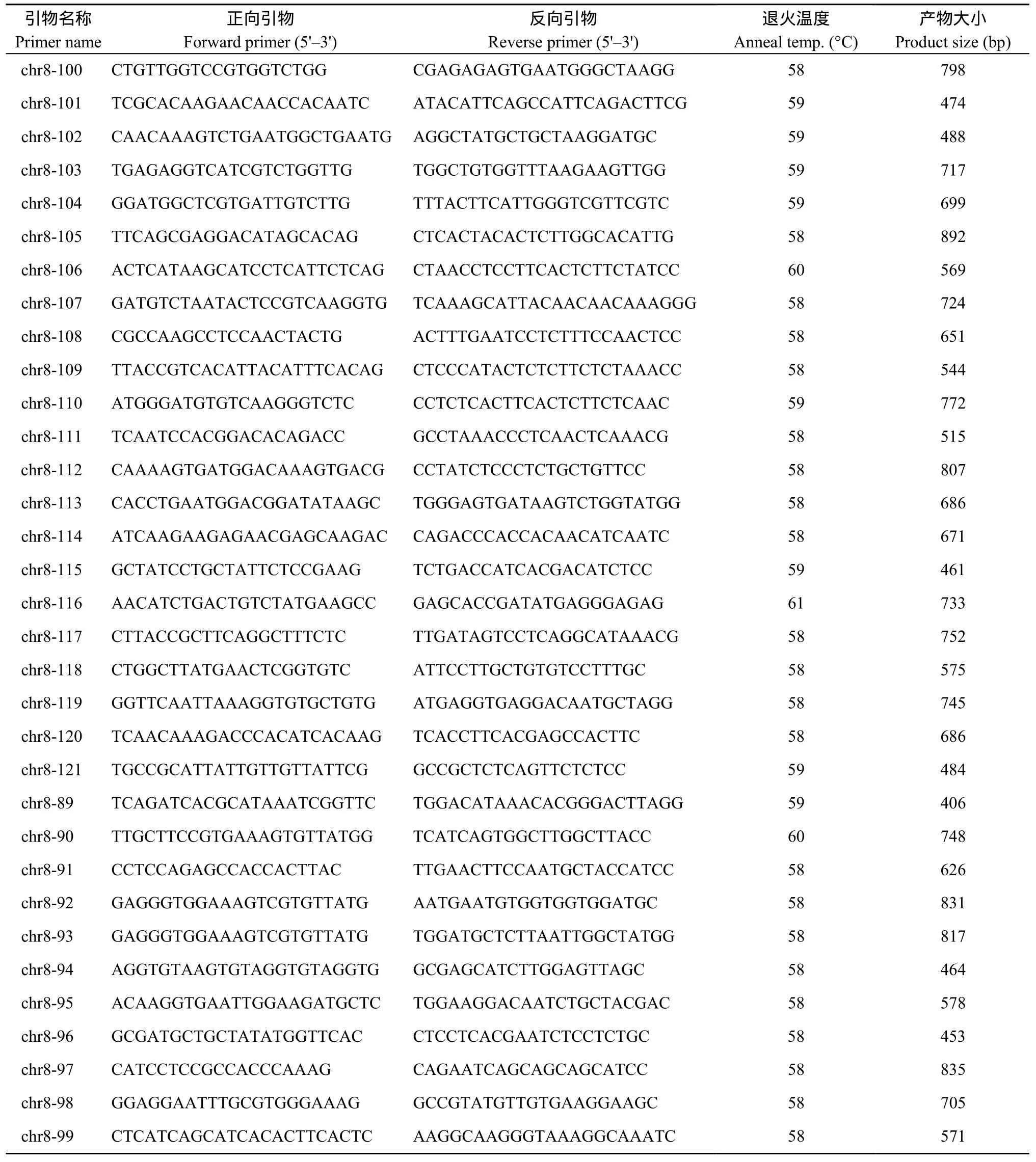
表3 引物信息Table 3 Primer information

图2 部分引物在亲本定薯1号和大西洋的扩增产物电泳图Fig. 2 PCR products of some primers in parents Dingshu 1 and Atlantic
2.3 分子标记的开发与验证
将在双亲中扩增出差异条带的引物, 通过 25份极端高蛋白与 25份极端低蛋白后代验证发现, 亲本扩增出现差异的引物8-107在极端高蛋白与极端低蛋白后代中扩增结果一致。即引物8-107在极端高蛋白材料中的扩增结果与亲本大西洋一致, 均扩增出条带, 而引物 8-107在极端低蛋白材料中的扩增结果与亲本定薯1号保持一致, 均未扩增出条带(图3)。因而, 本试验中, 筛选的引物8-107被选取用于后续的实验研究, 命名引物 8-107为SCAR8-107。
2.4 标记SCAR8-107在分离群体高蛋白和低蛋白子代中的检测
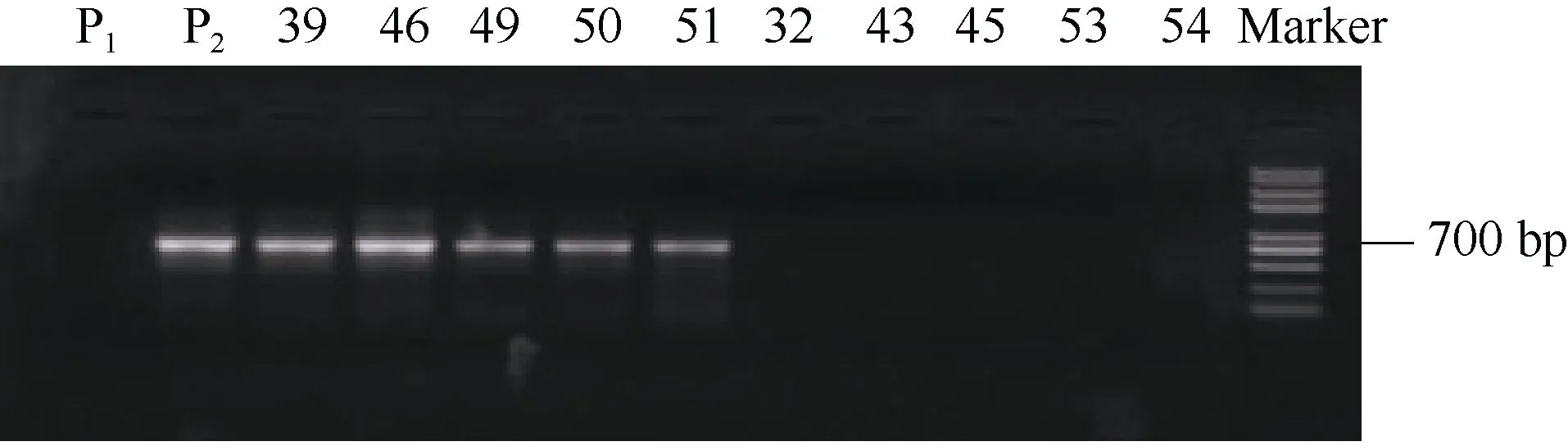
图3 引物8-107标记在部分极端高蛋白与极端低蛋白分离后代中的PCR扩增结果Fig. 3 PCR amplification results of primers 8-107 in partial extremely high protein and extremely low protein progenies
在四倍体马铃薯F1代的173份分离群体中, 存在74份高蛋白材料、42份低蛋白材料以及 57份中蛋白材料,以其中的74份高蛋白群体材料和42份低蛋白群体材料作为SCAR8-107标记检测的目的材料。在标记为阳性的(有PCR扩增产物)的70份材料中有67份为高蛋白含量材料,分子标记的检测结果与表型的对应度达到了 95.71%。在标记为阴性的(无PCR扩增产物)的46份材料中有38份为低蛋白材料, 分子标记的检测结果与表型的对应度达到了82.61%。共116份后代材料的分子标记与蛋白含量表型鉴定的结果总体的对应度达到了90.51% (图4和表4)。将蛋白含量的测定结果与分子标记的鉴定结果进行SPSS双侧相关性分析, 相关系数(r)为0.794, 达到了极显著水平。
2.5 标记SCAR8-107在四倍体品种中的检测
在54个马铃薯品种中, 蛋白含量大于2.0%的高蛋白含量的品种有10个, 占总材料的18.51%; 蛋白含量小于1.5%的低蛋白含量品种有20个, 占总材料的37.03% (表1)。利用开发的分子标记SCAR8-107对54个马铃薯品种检测表明, 在标记为阳性的14个品种中, 有9个为高蛋白含量, 分子标记的检测结果与蛋白含量的对应度达到了71.42%; 在标记为阴性的23个品种中, 有17个为低蛋白含量, 分子标记的检测结果与蛋白含量的对应度达到了73.91% (图5和表5)。54个品种的标记检测结果和蛋白含量的测定结果的总体的对应度达到了 72.97%。将分子标记鉴定结果与蛋白含量测定结果进行SPSS双侧相关性分析, 相关系数(r)为0.694, 达到极显著水平。结果表明, 分子标记SCAR8-107能够很好地筛选不同马铃薯品种的蛋白含量, 此标记能应用于马铃薯蛋白含量的分子标记辅助育种。
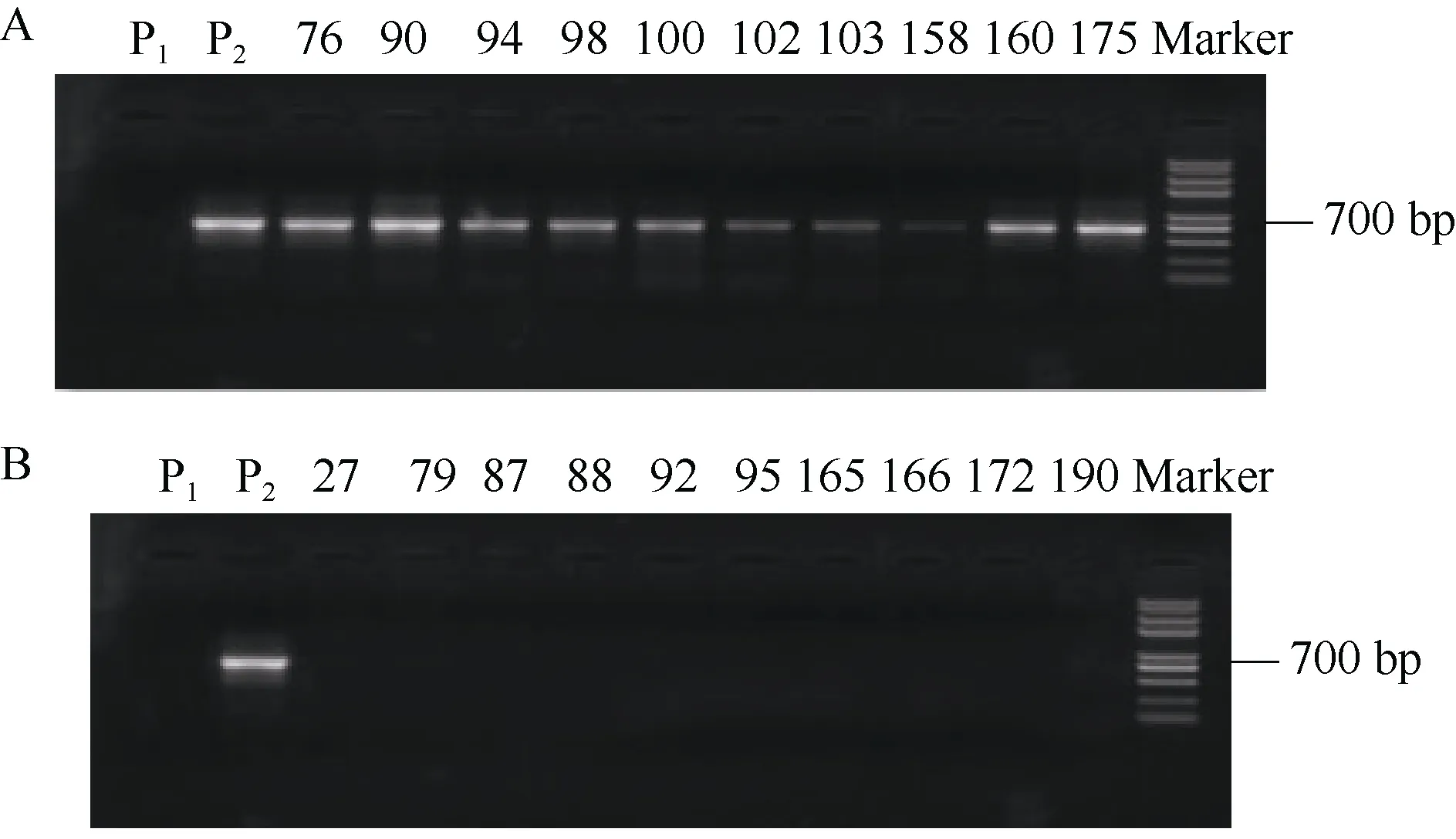
图4 SCAR8-107标记在部分高蛋白(A)与低蛋白(B)分离后代中的PCR扩增结果Fig. 4 PCR amplification results of SCAR8-107 marks in partial high protein (A) and low protein (B) progenies
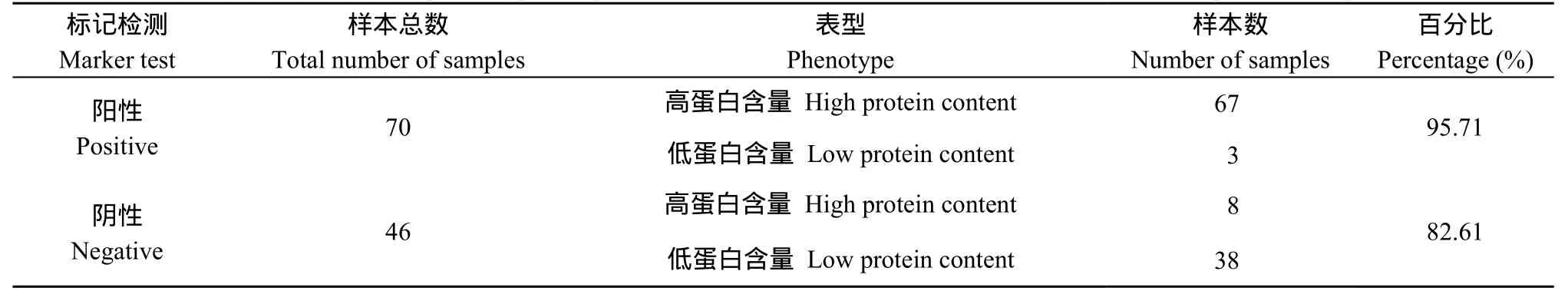
表4 F1群体部分样品的蛋白含量表型鉴定与标记检测结果统计Table 4 Identification of phenotype for protein content and statistics of marker test results in partial samples of F1
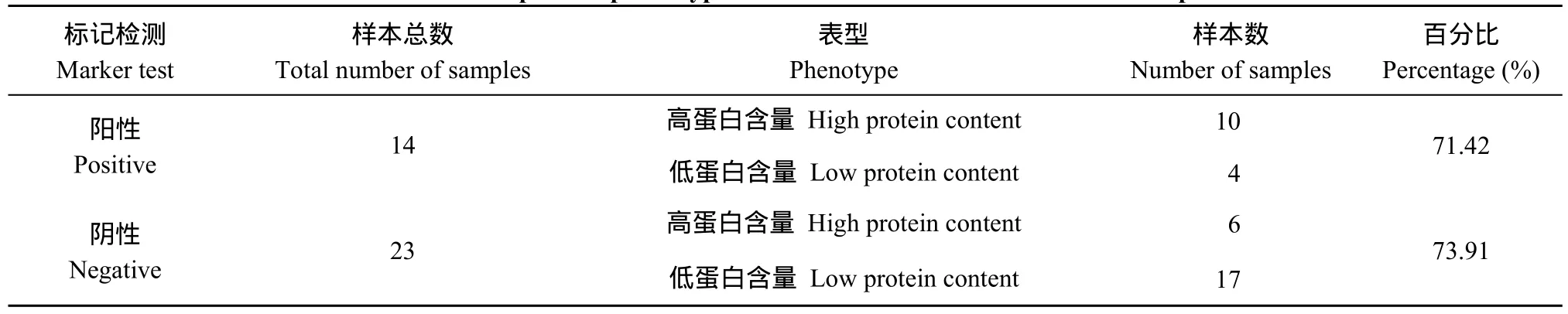
表5 部分品种蛋白含量表型鉴定与标记检测结果统计Table 5 Identification of protein phenotype and statistics of marker test results in partial varieties

图5 SCAR8-107标记在部分高蛋白(A)与低蛋白(B)品种中的PCR扩增结果Fig. 5 PCR amplification results of SCAR8-107 marks in partial high protein (A) and low protein (B) varieties
3 讨论
开发并获得与目的基因紧密连锁的分子标记是分子标记辅助育种的重要基础, 随着 AFLP、SSR、SRAP、RAPD等技术的发展, 分子标记辅助育种的研究进程也得到了极大的推动, Takagi等[15]采用当地品种“Hitomebore”进行 EMS诱变处理, 产生耐盐性的突变体(hst1), 运用BSA策略与野生亲本进行全基因组重测序, 结合Mutmap分析法, 找到了水稻耐盐基因(OSRR22), 仅用2年时间就培育出耐盐性的水稻新品种; 路洪凤等[16]采用 BSA混样策略, 通过全基因组扫描SNP, 分析差异频率, 检测F2群体早花性状的QTL, 找到了一个位于早花的QTL Ef1.1中的候选基因。由于四倍体马铃薯减数分裂的复杂性以及分子标记辅助育种复杂程度与通量的双重限制, 导致难以应用于规模较大的分子标记辅助育种。本研究利用 BSA混池测序的方法对四倍体马铃薯进行了 SCAR标记的开发与验证。该技术能够极大地避免片段大小选择的过程,使标签在基因组中的分布更加均匀, 适用于四倍体马铃薯等遗传性多样、基因组复杂的染色体片段的挖掘与分子标记的开发。BSA (Bluk Segregant Analysis)集群分离分析法是一种利用极端性状进行功能基因定位的方法, 比较群体在多态位点(SNP)的等位基因频率(AF)是否具有显著差异。因此, BSA混池测序的方法在技术层面上解决了四倍体马铃薯标记开发困难的问题, 实用性、筛选效率及准确性都极可靠, 对四倍体马铃薯遗传育种研究和品种选育都有着重大意义。
分子标记辅助育种技术能极大地缩短育种年限并且提高育种中目的性状的准确性[17]。迄今为止, 抗晚疫病、熟性、抗病毒病、抗青枯病、薯型、炸片颜色、薯肉颜色等十几个马铃薯重要性状相继被标记[9,18-23]。但关于马铃薯蛋白质含量紧密连锁的标记开发的报道极少, 因此, 四倍体马铃薯蛋白含量分子标记的开发对于四倍体马铃薯分子辅助育种有着重要的意义。本研究开发的分子标记SCAR8-107在四倍体马铃薯品种以及四倍体分离群体 F1代材料中 PCR检测结果与蛋白含量的表型鉴定结果对应度分别达到了72.97%和90.51%, 统计学上达到了极显著水平, 分子标记 SCAR8-107与马铃薯蛋白含量性状紧密相关, 可以很好地鉴别四倍体马铃薯分离群体子代及马铃薯品种的蛋白质含量, 对其进行蛋白含量的筛选与辅助选择。另外, SCAR标记在实际应用中更简单、有效、更稳定, 可以快速稳定的鉴定大量的马铃薯材料[23]。
分子标记的准确性是分子辅助选择的关键, 直接决定着育种的成败[24]。本研究中, 分子标记 SCAR8-107在四倍体分离群体与四倍体品种中有着极高的筛选率, 但是仍有小部分的分子标记检测结果与表型的鉴定结果不一致。存在少量的极端材料与对应的亲本扩增不一致, 推测这些极端单株为重组单株, 或因为参照二倍体马铃薯DM 序列而设计的引物, 存在检测不完全准确的问题; 其次由于马铃薯蛋白含量为数量性状, 受许多的微效基因控制, 而这些微效基因也会影响标记的关联度, 本研究尚处前期阶段, 只开发了一个准确的分子标记, 随着后续研究的开展, 更多相关分子标记的开发, 分子标记的检测将更为精准可靠。另外马铃薯蛋白质的含量受组合×地点互作影响显著[25], 地点的变化也可能导致马铃薯蛋白质含量细微变化, 不同品种不同耕作区域内在蛋白质含量上也会产生一定差异。本研究所开发出的SCAR8-107标记在用于检测的过程中, 所展现出的微小准确性的差异可能也受到此原因的影响。此外, 群体规模较小、气候原因及表型测定时蛋白质的损耗也有可能对结果产生影响,因此, 要继续利用多年多点田间种植马铃薯材料进行蛋白含量分子标记的开发, 在运用分子标记进行标记辅助选择时, 要同时选用多个与蛋白含量紧密连锁的分子标记同步选择, 结果将更为精确可靠。
更正:发表于本刊 2018, 44(6): 852–858,艾丽娟等 “大豆籽粒硬实加性和上位性 QTL定位”一文中的图 3更正为:
图3 检测到的加性QTL及上位性互作QTL在连锁群上的分布Fig. 3 Location of additive QTLs and epistatic effects QTLs on linkage groups

