玉米密植群体下部叶片衰老对植株碳氮分配与产量形成的影响
李荣发 刘 鹏 杨清龙 任 昊 董树亭 张吉旺 赵 斌
山东农业大学农学院 / 作物生物学国家重点实验室, 山东泰安 271018
玉米是我国第一大粮食作物, 在当前耕地面积有限的情况下提高单产是满足玉米需求持续增长的唯一途径[1]。当前, 提高玉米单产主要依赖于适当增加玉米种植密度, 而非单株产量[2-4]。叶片是玉米的主要光合器官, 灌浆期内保持较长的光合高值持续期是获得高产的必备条件[5-7]。随种植密度增加, 群体光温资源利用率提高[8], 但群体内通风透光条件变差, 中下部叶片相互遮阴易早衰[9]。林同保等[10]研究认为, 玉米冠层不同层次在可见光范围内的吸收率是上层>中层>下层, 整个冠层吸收的光合有效辐射(PAR)占总入射的87.7%, 其冠层的下层吸收比例达到25%。不同层位的叶片对籽粒产量的贡献率为中层>上层>下层,遮阴会显著降低玉米产量, 影响其生育进程[11-12]。
玉米生长发育是地上部光合作用和地下根系吸收水分、养分的统一过程[13-14]。玉米地上部生长发育状况和根系性能密切相关[15], 强大的根系是获得高产的重要基础[16]。根系活力高是维持玉米生育后期叶片高光合速率、获得较高生物量和籽粒产量的保证[14,17]。在高等植物中, 20%~60%的光合产物分配到了地下部[18]。玉米开花后, 籽粒作为生长中心需要大量的光合产物和矿质元素用以建成较大的籽粒库容, 并保证籽粒库容的充实。籽粒灌浆期, 增加根系的碳供应量可以提高氮摄取量[19]。籽粒发育与根系竞争碳水化合物, 如果向根系的碳供应量减少会加速根系衰老而影响氮素的吸收[20], 导致叶片衰老、光合速率下降[21]。
人们对玉米叶片衰老及其对籽粒产量的影响研究主要集中于对生育后期中上层叶片的衰老进程及其调控措施等方面[5,22-24], 而对花后下部叶片衰老对植株碳氮代谢、根系性能及产量形成的影响研究相对较少。本试验以登海661 (DH661)和郑单958(ZD958)为材料, 采用稳定性同位素标记的方法, 通过大田和土柱栽培试验, 研究密植群体下部叶片衰老对植株碳氮代谢及产量形成的影响, 为科学制定玉米高产栽培措施提供依据。
1 材料与方法
1.1 试验设计
试验于2015—2016年在山东农业大学黄淮海区域玉米技术创新中心(36°10′N, 117°9′E)进行。该区域属于半湿润暖温带大陆性季风气候区。土壤类型为棕壤土, 两年的基础地力见表1。试验材料为登海661 (DH661)和郑单958 (ZD958)。大田试验采用随机区组设计, 小区面积120 m2(长20 m ×宽6 m), 重复4次。种植密度分别为67 500株 hm–2和 90 000株 hm–2, 行距60 cm。

表1 播种前0~20 cm土层土壤养分含量Table 1 Soil nutrient content in 0-20 cm soil before sowing
土柱栽培以花后遮叶的方式模拟下部叶片早衰。采用直径30 cm, 高1 m的土柱, 按照行距30.7 cm (柱中心)、间距30.0 cm (柱中心)的方式排列, 种植密度为90 000株 hm–2, 每个处理 60株, 土柱周围种植保护行。将栽培基质沙子(40%)、表层土(30%)、蛭石(15%)、珍珠岩(15%)混匀装入土柱, 浇水使土柱中基质沉实后距表层10 cm处施10 g底肥(N, P2O5, K2O含量均为15%)。遮叶处理于开花期开始, 采用自制的铝箔袋(透气但不进光)遮住棒三叶以下所有叶片的1/2 (S-1/2), 以不遮叶作为对照。
遮叶处理当天, 施入15N标记的尿素(丰度值为11.6)每株 5 g。
开花期选择晴朗无云的天气, 取每个处理代表性植株 6株, 对其穗位叶分别用透明的聚乙烯袋(0.09 mm厚)套袋。于上午10:00, 使用注射器将50 mL13CO2(丰度值≥99.9%)注入袋中, 维持光合作用1 h后, 用KOH溶液吸收袋内剩余13CO2, 取下袋子。
1.2 测定项目与方法
1.2.1 干物质积累 分别于吐丝期(R1, 7月31日)和成熟期(R6, 10月7日)取样, 每处理6株, 将根系、茎(茎秆、叶鞘、雄穗、穗轴、苞叶)、叶片、籽粒分开, 置105℃烘箱杀青30 min, 80℃烘至恒重, 测定干物质积累量, 之后用粉碎机粉碎。
1.2.2 同位素和全氮的测定 于成熟期(R6)取13C和15N标记的植株样品, 将根系、茎(茎秆、叶鞘、雄穗、穗轴、苞叶)、叶片、籽粒分开, 105℃烘箱杀青30 min后80℃烘至恒重。样品经粉碎机粉碎后用MM400型高效生物样品制备仪(Retsch公司, 德国)再次研磨, 用Elementar vario MICRO cube元素分析仪(Elementar 公司, 德国)测定各器官氮素含量, 用Isoprime 100型质谱仪(Isoprime, 英国)测定各器官的13C和15N丰度值。
作物由肥料中得来的N, 即Ndff (%) = 植物样品中15N原子百分超(%)/肥料中15N原子百分超(%) × 100;
Ndff (mg) = 器官干重(g)×器官全 N 含量(%) × Ndff (%) × 1000 × 10–4;
13C分配率(%)=各器官 Ndff (mg)/植株 Ndff(mg) × 100
1.2.3 净光合速率 分别于吐丝期(R1)、乳熟期(R3)和蜡熟期(R5), 选择晴朗无云的天气, 于上午10:00至 12:00用 Ciras-III型便携式光合仪(PP-Systems, UK)测定穗位叶净光合速率(Pn), 测定时使用 LED 光源, PAR=1600 μmol m2s–1, 瞬时大气CO2浓度为(360±5) μmol mol–1。
1.2.4 单株叶面积 分别于吐丝期(R1)、乳熟期(R3)和蜡熟期(R5), 选取每处理4株长势一致的植株,测量植株的叶片长和宽, 计算单株叶面积=叶长×叶宽×0.75。
1.2.5 穗位叶叶绿素含量 于吐丝期(R1)、乳熟期(R3)和蜡熟期(R5), 每处理选取4株长势一致的植株, 取穗位叶鲜样, 用直径 0.7 cm打孔器打取叶圆片20个, 放入95%乙醇15 mL的提取液, 避光提取48 h至叶片全部变白, 之后于665、649和470 nm处测定吸光值, 计算叶绿素含量[25]。
1.2.6 根系形态指标 于吐丝期(R1)和成熟期(R6), 将土柱中完整的根系在低水压下冲洗干净,每个层次的根系分开保存, 之后将待测样品均匀平铺于长32 cm ×宽24 cm的储水玻璃槽中, 使样品漂浮在水面上, 用Epson Perection V700 Photo扫描仪(Epson, Perfection V700 Photo, Epson (China) Co.Ltd., China)扫描, 然后使用根系分析软件(Win Rhizo Pro, Régent Instruments, Québec, Canada), 测定根系长度(cm)和根系表面积(cm2), 根长密度(cm cm–3)=根系长度(cm)/取样土柱体积(cm3)。测定完各指标后将所有根系放入 80℃烘箱烘至恒重, 测定根系干重。
1.2.7 产量及产量构成因素 于成熟期(R6), 将大田试验小区中央长度为5 m的3行果穗全部收获、考种; 分别取土柱试验 10穗, 晒干, 室内考种, 调查穗行数、行粒数、千粒重。单株产量(g)=穗粒数×千粒重(g)/1000×[1-含水量(%)]/(1-14%)。
1.3 数据处理
采用 Microsoft Excel 2010软件处理数据, 以DPS16.05软件统计分析, 其中处理间差异显著性采用LSD法检验(P<0.05)。采用SigmaPlot 12.5软件作图。
2 结果与分析
2.1 土柱试验
2.1.1 不同处理对玉米籽粒产量及产量构成因素的影响 由表2可知, 年份、品种、处理、年份与品种互作对玉米单株籽粒产量、穗粒数的影响均达显著水平(P<0.01)。登海 661籽粒产量和收获指数均显著高于郑单 958 (P<0.05), 而单株生物量则低于郑单958。遮挡下部叶片均显著降低夏玉米的单株生物量及籽粒产量。2015年和 2016年 S-1/2处理, 登海661单株生物量较CK分别降低10.96%和7.45%, 单株籽粒产量分别低9.91%和5.30%; 郑单958的单株生物量较CK分别低9.15%和7.55%,单株籽粒产量分别低11.89%和5.38%。籽粒产量的降低主要源于穗粒数的降低, 登海 661和郑单 958两年较 CK分别降低 5.40%、5.41%和 14.02%、3.03%。
2.1.2 不同处理对夏玉米干物质积累量的影响
由图 1可知, S-1/2处理, 登海 661和郑单 958花后生物量两年平均值较 CK分别降低 15.49%和15.43%, 花后生物量所占百分比较 CK分别降低6.91%和7.47%。可见, 遮下部叶片会显著降低2个玉米品种花后干物质的积累量。花后干物质生产比例低对籽粒产量有重要影响(图1)。
2.1.3 不同处理对夏玉米花后叶面积的影响 由图2可知, 遮挡2个玉米品种下部叶片后, 单株叶面积显著降低。2015年和2016年登海661的S-1/2处理, R3期较CK分别低7.92%、17.80%, R5期分别低9.45%、15.39%; 郑单 958在 R3期较 CK分别低6.07%、17.57%, R5期分别低6.57%、17.57%。2016年 S-1/2处理, 登海 661和郑单958在R3期和 R5期分别较CK低3.43%、6.70%和3.33%、5.26%, R6期分别低6.09%、6.13%。
2.1.4 不同处理对夏玉米穗位叶叶绿素含量的影响
作物叶片叶绿素含量的消长规律是反映叶片生理活性变化的重要指标, 也是叶片衰老进程的重要指标。由图3可知, 2015年和2016年, 登海661的S-1/2处理, R3期较CK分别低8.15%、14.76%, R5期分别低9.49%、24.32%; 郑单958在R3期较CK分别低5.86%、9.71%, R5期分别低9.21%、12.10%。可见, 2个玉米品种遮挡下部叶片后, 花后穗位叶叶绿素含量与对照相比均显著降低, 叶片衰老加快,持绿时间和功能持续期缩短。
2.1.5 不同处理对夏玉米净光合速率的影响 遮挡2个玉米品种下部叶片后穗位叶净光合速率均显著降低(图4)。2015年和2016年, 登海661的S-1/2处理, R3期穗位叶较CK分别低18.70%、7.67%, R5期分别低26.10%、11.72%; 郑单958在R3期较CK分别低 14.17%、8.99%, R5期分别低 39.41%、15.68%。穗位叶光合速率下降会限制光合同化能力,进而影响产量。

表2 不同处理对玉米籽粒产量及产量构成因素的影响Table 2 Effect of different treatments on grain yields and yield components of maize

图1 不同处理对夏玉米干物质积累量的影响Fig. 1 Dry matter accumulation of DH661 and ZD958 under different treatments缩写同表2。Abbreviations are the same as those given in Table 2.

图2 不同处理对夏玉米花后叶面积的影响Fig. 2 Effect of different treatments on leaf area per plant

图3 不同处理对夏玉米花后叶绿素含量的影响Fig. 3 Effect of different treatments on content of Chl a+b

图4 不同处理对夏玉米花后净光合速率的影响Fig. 4 Effect of different treatments on net photosynthetic rate
2.1.6 不同处理对夏玉米花后13C分配的影响
由表3可知, 遮挡2个玉米品种下部叶片会显著降低花后13C向根系、叶片中的分配比例, 但向籽粒中的分配则显著增加。S-1/2处理, 登海661两年花后13C向根系、叶片中的分配较CK分别低8.85%和9.93%, 向籽粒的分配提高了 4.44%; 郑单 958花后13C向根系、叶片中的分配较 CK分别低12.70%和17.56%, 向籽粒的转运提高了3.69%。

表3 不同处理对夏玉米花后13C分配的影响Table 3 Distribution of 13C in different plant organs under different treatments after silking
2.1.7 不同处理对夏玉米根系生物量及形态特征的影响 由表4可知, 从R1至R6期, 不同处理的根系生物量、根长密度、根系表面积均显著降低, 其中遮挡下部叶片处理的降幅显著高于 CK。2015年和
2016年登海661的S-1/2处理, 根系生物量较CK分别低 17.14%、16.51%, 根长密度和根系表面积分别低10.64%、6.40%和30.03%、16.83%; 郑单958的根系生物量较CK低6.23%、12.90%, 根长密度和根系表面积分别低19.00%、13.00%和23.01%、11.08%。这说明遮叶显著加速了根系衰老, 降低了根系性能。

表4 不同处理对夏玉米根系生物量及形态的影响Table 4 Morphological and dry weight of roots at harvest under different treatments
2.1.8 不同处理对夏玉米各器官15N积累量的影响
由表5可知, 遮挡下部叶片会显著降低2个玉米品种完熟期各器官及整株的氮素积累量, 郑单958的降幅明显大于登海661。2015年和2016年登海661的S-1/2处理, 完熟期根系和茎中15N积累量较CK分别降低22.23%、17.37%和16.23%、16.31%, 叶片和籽粒较 CK分别低 22.52%、10.70%和 30.60%、4.82%; 郑单 958根系和茎中15N积累量较 CK分别低 55.04%、24.12%和13.35%、10.95%, 叶片和籽粒较 CK分别低24.79%、11.06% 和31.29%、11.78%。2015年和2016年, S-1/2处理, 登海661花后整株15N积累量较CK分别低26.75%和7.54%, 郑单958较CK分别低29.44%和9.42%。

表5 不同处理对夏玉米各器官15N积累量的影响Table 5 15N accumulation of different plant organs at harvest of DH661 and ZD958 under different treatments
综合两年数据, 花后根系生物量、根长密度、根系表面积之间呈极显著正相关, 且与叶绿素含量呈极显著正相关; 花后干物质与花后氮素积累量、叶面积呈极显著正相关, 与花后根系生物量、光合速率显著正相关(表6)。
2.2 大田试验
表 7表明, 品种和种植密度对干物质积累量、产量及各产量构成因素均存在显著的交互作用。同一处理, 登海 661的千粒重、产量、生物量显著高于郑单958。增加种植密度, 两品种穗粒数和千粒重显著降低。登海 661穗粒数的降幅显著高于郑单958, 而千粒重的降幅则相反。籽粒产量的显著增加主要是由于增加种植密度后单位面积有效穗数增加引起的。郑单958的增产效果要优于登海661。不同处理间收获指数无明显差异。

表6 花后根系指标与其他生理指标的相关系数Table 6 Correlation coefficients between root indexes and other indexes
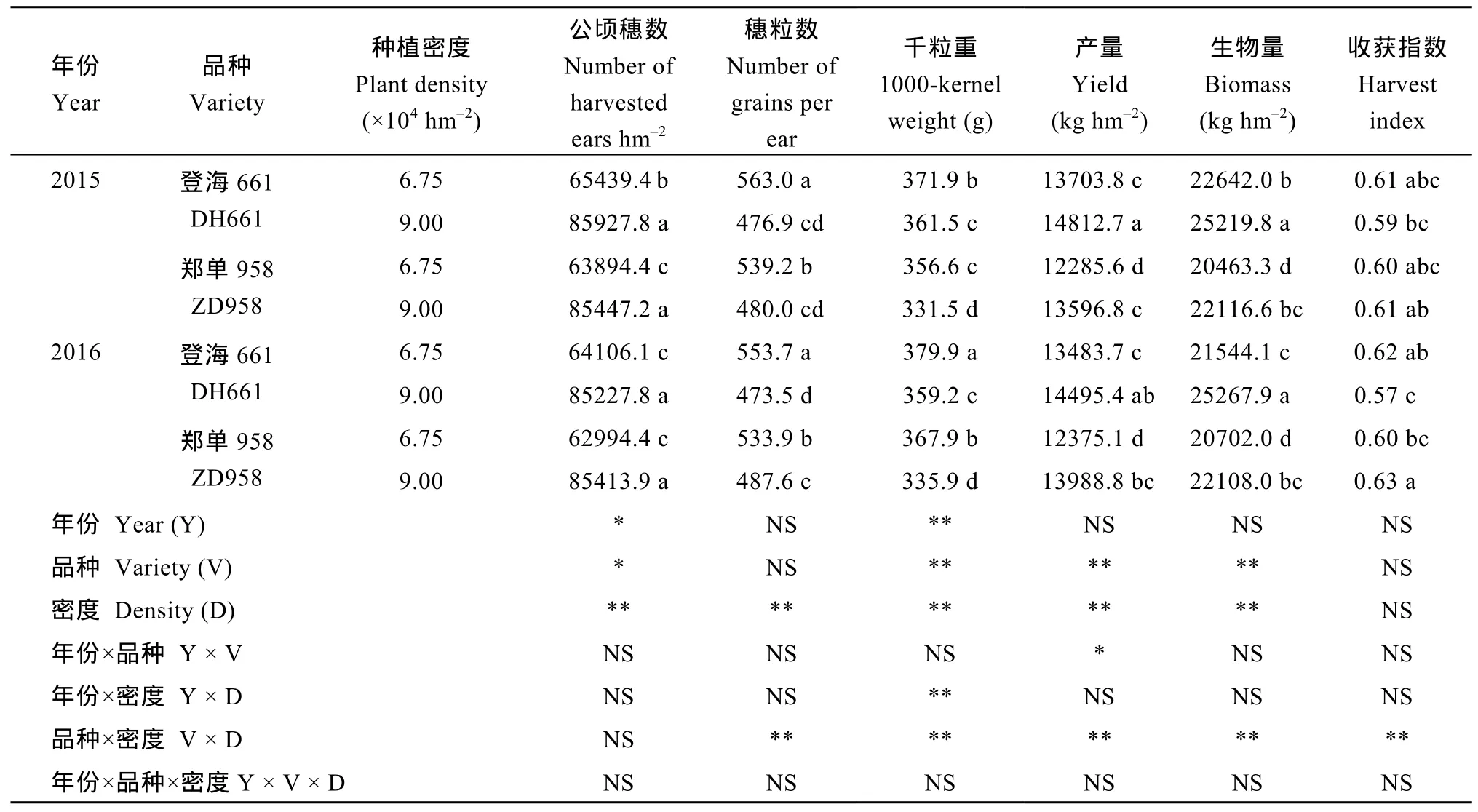
表7 密度对玉米籽粒产量及产量构成因素的影响Table 7 Effect of plant densities on grain yield and yield components of maize
3 讨论
干物质积累是玉米产量的物质基础, 增加干物质积累量, 尤其是花后干物质积累量对实现玉米高产具有重大意义[26]。叶片是玉米光合作用的主要器官, 叶面积和光合速率决定着同化物的生产能力。在籽粒灌浆中后期, 叶片衰老加速, 净光合速率降低, 干物质积累量及籽粒产量降低[27-30]。玉米产量主要来源于吐丝后叶片的光合同化物, 吐丝前同化物对籽粒产量的影响小于 10%[31], 花后的群体光合同化量直接决定着玉米籽粒的产量。玉米开花后叶片衰老和粒重增长是同步进行的, 因此在籽粒形成期保持较高的光合面积和光合速率有助于提高光合能力、增加花后干物质生产和积累[32]。干物质积累量与产量呈显著正相关, 籽粒产量随干物质增加而增加[33-35]。增加种植密度后的群体优势弥补了单株干物质积累量的减少, 群体干物质积累量随密度增大而增加, 即在高产田条件下通过适当增加种植密度增加干物质积累量, 进而获得高产(表7)。种植密度通过对叶面积、单株拦截光量和单株籽粒数来影响花后源库比, 所有这些特征值随着种植密度的增加而减少[5]。本试验表明, 加速下部叶片衰老使单株叶面积下降, 同时花后穗位叶叶绿素含量和净光合速率降低, 缩短花后功能叶的光合期, 致使单株生物量降低(图2、图3、图4和表2)。
玉米籽粒产量是由生育期内光合同化物及养分的积累、分配和转运特性所决定的, 尤其花后光合同化物的转运对籽粒增产的贡献较大[34]。茎、叶、鞘的干物质积累与再分配是玉米籽粒产量形成的重要因素[33-34], 苞叶和茎鞘中干物质向籽粒运转率较高, 对玉米籽粒的贡献率最大。加速下部叶片衰老,叶片中的13C分配显著降低, 籽粒中13C分配比例显著增加, 说明加大了花后叶片中的光合产物向籽粒中的转运比例(表3)。进入生殖生长阶段后, 玉米籽粒发育与根系生长竞争叶片的光合产物。由于籽粒成为开花后的生长中心, 光合同化物向根系转运减少, 导致根系碳供应不足、加速衰老。在籽粒灌浆期, 限制地上部的光合产物向根系的供应, 会降低玉米的根系长度和活力[35-38]。本试验表明, 增加种植密度加速下部叶片衰老, 光合产物向根系转运量降低, 导致2个玉米品种的根系生物量、根长密度和根表面积在花后显著降低, 而且郑单958的降幅显著大于登海661 (表3和表4)。氮吸收与叶片供给根系的光合产物密切相关[36]。籽粒发育与根系竞争碳水化合物, 会加速根系衰老而影响氮素的吸收, 而根系养分吸收减少, 又会加剧叶片中氮向外转移[20],从而影响叶面积和单位叶面积光合速率, 引起花后光合同化物减少, 籽粒库容缩小(表6)。
玉米籽粒中氮40%来自授粉后从土壤中的吸收,只有约 60%来自吐丝期营养体氮的转移, 花后氮素吸收量对于产量的形成具有重要意义[30,37-38]。本试验表明, 加速下部叶片衰老降低了玉米根长密度、根表面积, 根系吸氮能力(表4和表5)。下部叶片衰老降低地上部(尤其是籽粒库)的库容量, 降低对氮素的需求, 从而导致单株氮素积累量降低(表5)。与此同时, 还会加快营养器官中的氮素向籽粒中的转运,使完熟期叶片、茎、根系中氮含量显著降低(表5)。
延缓玉米密植群体下部叶片的衰老可以提高根系碳的分配, 延长根系功能期, 为地上部提供更多的氮素, 使植株晚熟, 导致籽粒成熟时含水量较高,不能满足机械收获的需求[39-41]。因此, 实际生产中应选耐密植、下部叶片功能期长、籽粒后期脱水快的品种。
4 结论
增加种植密度使下部叶片衰老加速, 降低光合碳向根系的转运量, 根系衰老加速、吸收性能下降,
减少对氮素的吸收和对地上部氮素的供给, 叶片中的氮素被迫向外转运, 加速整株叶片的衰老, 降低光合产物供应能力, 最终导致干物质积累量和籽粒产量显著降低。生产中如何延缓高密度种植条件下下部叶片的衰老需要进一步深入研究。

