玉米低磷胁迫诱导型强启动子P1502-ZmPHR1的克隆与表达分析
杨瑞娟 白建荣 闫 蕾 苏 亮 王秀红 李 锐 张丛卓山西大学生物工程学院, 山西太原 00006; 山西省农业科学院作物科学研究所, 山西太原 000; 山西省农业科学院现代农业研究中心, 山西太原 000
磷是植物生长和发育不可或缺的大量营养元素,它不仅是植物体内许多重要分子的组成成分, 而且在能量传递和许多代谢调控中发挥着不可替代的作用[1]。植物主要通过根系以磷酸根的形式吸收磷元素。虽然土壤中总磷含量很高, 但磷酸根很容易被土壤中的各种金属阳离子和矿物质吸附固定或转换成有机磷而不被吸收[2-3]。土壤中有效磷的缺乏和低效利用是限制植物生长的 2个重要因素, 施用无机磷肥是目前保障作物产量的普遍措施。然而, 磷肥的大量施用不仅加快了不可再生磷矿的耗竭, 而且土壤中磷的流失又会产生地下水、河流、湖泊的富营养化等环境问题, 同时加大了农业生产成本[4]。培育高效吸收和利用磷肥的作物新品种, 对于减少磷肥施用量、保护环境具有重要的意义。但是, 植物吸收利用磷是一个复杂的数量性状, 利用传统的育种方法难以达到预期目标。而利用植物基因工程技术培育新品种是一种行之有效的方法。
植物在长期的进化过程中, 形成了一系列的应答机制调节其生理生化反应[2,5], 从而减少缺磷对自身的伤害。大量低磷响应基因的分离鉴定及其对缺磷的调控越来越受到关注, 而相关转录因子能够调控代谢途径中下游一系列基因的表达。植物中转录因子对缺磷响应基因的调控作用最先是在拟南芥中发现和研究的, 该基因被命名为AtPHR1[6]。基于其氨基酸序列,OsPHR1[7]、OsPHR2[8]、TaPHR1[9]、BnPHR1[10]、ZmPHR1[11]等转录因子相继在水稻、小麦、玉米、油菜等作物中被克隆与鉴定。这些研究结果都表明, 这类基因能调节缺磷响应基因的表达,而且它们的超表达能促使磷转运子的表达量上升,进而增强植株对磷的吸收和转运能力, 最终导致地上部磷的累积[6-14]。因此, 转录因子基因工程将是目前及未来生物技术育种的主要途径。
在植物基因工程中, 广泛应用组成型启动子如35S启动子、Ubiquitin基因启动子。组成型启动子在不同组织和环境条件下都能驱动下游基因的表达和蛋白质合成, 产生的异源蛋白质或代谢产物在植物体内过量积累, 打破了植物原有的代谢平衡, 阻碍植物的生长发育, 甚至导致死亡。据报道, 在这些强组成型启动子控制下, 该类基因持续表达, 最终引起有效磷在植物体内过量积累导致磷中毒[7,13]。而胁迫诱导型启动子可以有效避免组成型启动子对转基因植物的副作用, 减少对转基因植物生长发育及产量的影响。但是, 到目前为止, 对低磷胁迫相关基因的诱导启动子研究甚少。
玉米作为我国及世界主要的粮食和饲料作物,在农业生产中占据重要地位。玉米是低磷敏感的作物, 为了保证和提高玉米产量, 每年都需要施大量的磷肥。获得玉米低磷胁迫诱导启动子并阐明它对低磷应答基因的调控机制, 对于通过基因工程培育磷高效吸收和利用的玉米新品种非常必要。本研究的前期工作克隆了玉米低磷应答转录因子ZmPHR1并分析了其在不同组织中的表达特性。玉米自交系478在低磷条件下,ZmPHR1在根中的表达在第3天有一个上调, 是未处理时的 1.84倍, 随着培养时间的延长又下降, 说明根中ZmPHR1对磷饥饿的反应不太敏感, 只是微弱的上调。在胁迫初期,ZmPHR1在茎中的表达较弱, 但在第 3天有一个急剧上升,达到了未处理表达的 108.86倍, 推测磷饥饿胁迫引起了茎部的一系列代谢活动,ZmPHR1的表达也增强。在叶中,ZmPHR1的表达则是未处理时最高, 随后下降, 在第 5天时才又上升, 但表达量也只有未处理时的一半, 说明叶对磷饥饿的反应要迟一些。对于不同的组织器官,ZmPHR1基因随着磷饥饿处理时间的延长, 它的表达处于动态变化中, 存在一个正负反馈调节。研究表明,ZmPHR1基因可以响应低磷胁迫, 其启动子很可能具有低磷逆境启动活性[11]。另外有研究报道, 用内源诱导型启动子的驱效率往往比外源诱导型启动子高[15-17]。为此, 在前期工作基础上, 本研究从该基因的上游序列获得了玉米内源性低磷胁迫诱导强启动子P1502-ZmPHR1,通过对转基因拟南芥的研究揭示了该启动子调控基因表达的机制和特点, 为培育磷高效吸收和利用的转基因玉米新品种提供重要的理论依据。
1 材料与方法
1.1 材料
利用本实验室保存的磷高效利用玉米自交系478克隆ZmPHR1基因的启动子。野生型拟南芥(Arabidopsis thaliana, Col-0)用于启动子重组载体质粒的转化与功能验证。将萌发的玉米 478种子置光照培养箱中, 25℃黑暗培养6 d, 利用CTAB法[18]从幼苗叶片中提取基因组DNA。
大肠杆菌DH5α菌株、根癌农杆菌GV3101菌株和植物表达载体pCAMBIA1305为本实验室保存,克隆载体pMD18-T和pESAY-blunt simple Cloning Kit分别购自宝生物工程(大连)有限公司和北京全式金生物技术有限公司, ExTaq、Premier STAR和 T4 DNA 连接酶购自宝生物工程(大连)有限公司; 限制性内切酶购自NEB公司; 凝胶回收试剂盒和质粒提取试剂盒购自天根生化科技有限公司。
1.2 方法
1.2.1ZmPHR1基因 5′上游序列的获得 以ZmPHR1编码区序列为探针, BLAST搜索玉米B73基因组序列数据库(http://ensembl.gramene.org/), 将同源基因上游2.0 kb左右序列作为目标区域, 以上述基因组DNA为模板, 利用引物SF1 (斜体为SalI酶切位点)和SR (斜体为BglII酶切位点, 下画线为表达载体补充序列)扩增得到的片段P2205-ZmPHR1连接到pMD18-T载体上。PCR程序为95℃ 5 min;95℃ 30 s, 55℃ 30 s, 72℃ 2 min, 30个循环。
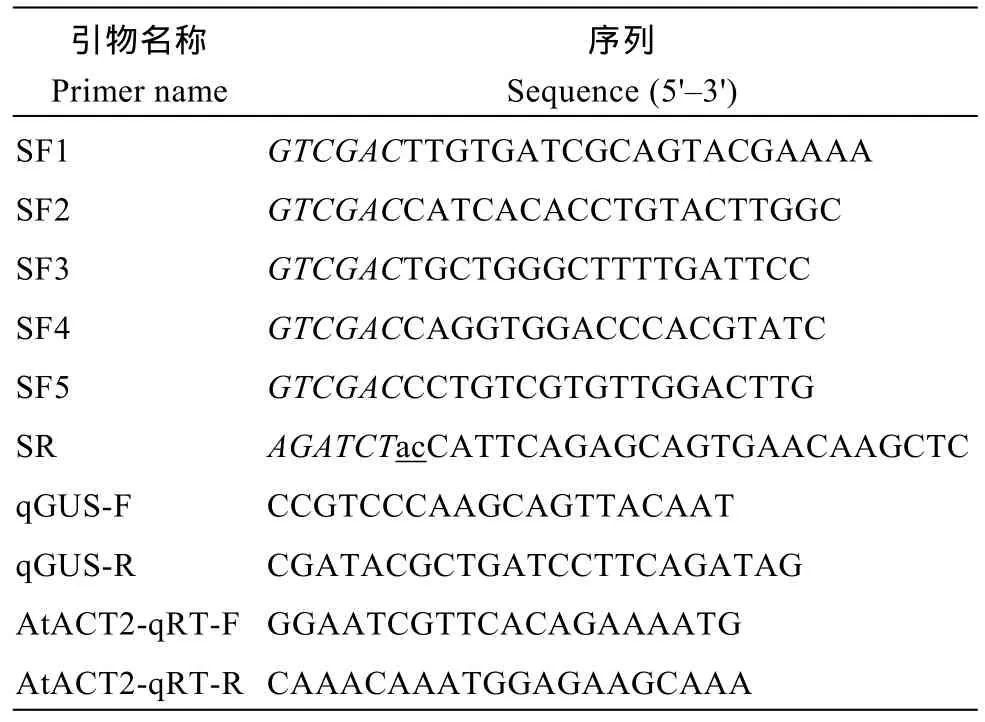
表1 PCR所用引物Table 1 Primers of PCR
1.2.2 生物信息学分析 利用启动子顺式作用元件在线分析网站 PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析ZmPHR1基因5′上游序列顺式作用元件。
1.2.3ZmPHR1基因5′上游序列缺失片段的克隆
根据启动子顺式元件的预测结果设计引物, 正向引物分别为 SF2、SF3、SF4和 SF5, 反向引物为SR, 正向引物加入SalI酶切位点, 反向引物加入BglII酶切位点, 引物序列见表1。以ZmPHR1基因5′上游序列为模板, 按上述扩增程序进行PCR。经一系列扩增反应分别得到不同长度的缺失体片段, 然后将片段连接到pESAY-blunt simple载体上。
1.2.4 植物表达载体的构建 将所有连接片段载体经SalI和BglII双酶切后, 连接到经SalI和BglII双酶切 pCAMBIA1305载体上, 经测序验证后电击转化到农杆菌GV3101中。
1.2.5 拟南芥的转化及抗性苗筛选 采用浸花法[19]将重组质粒和pCAMBIA1305载体分别转化到野生型拟南芥 Col-0中, 温室培养收种。得到的 T0种子经 MS 固体筛选培养基(含 25 μg mL–1潮霉素)筛选和PCR检测, 扩增所用引物为hyg-F和hyg-R, 序列见表1, 之后移栽温室生长, 自交得到T1, 再经自交和筛选后得到纯系T2用于后续试验。
1.2.6 用于功能分析的植物材料胁迫处理与取材
用于功能分析的转基因拟南芥和野生型 Col-0种子, 经10%的次氯酸钠表面消毒后, 于4℃冰箱低温处理3 d, 播种于MS固体筛选培养基, 然后置光照培养箱(23℃, 16 h光照/8 h黑暗)竖直生长4 d, 从MS培养基转至含高磷营养液[11][HP: 1 mmol L–1KH2PO4, 2 mmol L–1Ca(NO3)2, 0.65 mmol L–1MgSO4,25 μmol L–1Fe·EDTA, 5 μmol L–1MnSO4, 50 μmol L–1KCl, 2 μmol L–1ZnSO4, 0.5 μmol L–1CuSO4,0.005 μmol L–1(NH4)6Mo24·4H2O 和 25 μmol L–1H3BO4]的蛭石育苗盘中生长 10 d, 再将育苗盘转移至低磷营养液[11](LP: 10 μmol L–1KH2PO4, 0.99 μmol L–1KCl)进行胁迫处理并分别在处理 0、0.5、1、2、3和4 d时取样, 分别用于各种分析。选每种处理 3个转基因株系, 取每个转基因株系 3株用于GUS组织化学染色、15株用于GUS 荧光定量分析、15株用于转基因植株实时荧光定量PCR检测, 重复3次。
1.2.7 GUS组织化学染色 分别取不同胁迫时间段不同转基因株系的幼苗置装有适量 GUS染液(能够浸没植株)的1.5 mL离心管; 37℃染色过夜, 吸去染液; 加入 75%乙醇, 脱色 3~4次, 每次 4~6 h;至阴性对照(Col-0)为白色[20]。
1.2.8 GUS 荧光定量分析 将不同时间取的材料分别加入液氮迅速研磨成粉, 参照Jefferson等[20]报道的方法提取总蛋白, 使用 NanodropOne超微量分光光度计用Bradford 法[21]测定总蛋白含量, 使用多功能酶标仪(SpectraMaxM2)按照 Xu等[22]的方法测得GUS活性。
1.2.9 转基因植株实时荧光定量 PCR检测 依据生工生物工程柱式植物总 RNA抽提纯化试剂盒和M-MuLV第1链cDNA合成试剂盒的方法, 提取表达量最高的缺失体片段转基因植株的 RNA, 并进行反转录。参照TaRaKa SYBR Premix ExTaqII试剂说明书进行实时荧光定量 PCR检测(基因引物为qGUS-F/R, 内参引物为AtACT2-qRT-F/R, 表1), 反应程序为 95℃ 30 s; 95℃ 5 s, 60℃ 34 s, 40个循环;溶解曲线: 95℃ 15 s; 60℃ 1 min, 95℃ 1 s。之后用2–ΔΔCt法分析基因相对表达量[23]。
1.2.10 数据分析 用Microsoft Excel 2010整理数据, 用t检验对试验数据进行P<0.05和P<0.01水平的分析[24]。
2 结果与分析
2.1 ZmPHR1基因5'上游序列P2205-ZmPHR1的获得及顺式作用元件分析
根据 B73基因组序列数据库(http://ensembl.gramene.org/)公布的玉米 B73基因组序列设计ZmPHR1基因5′上游序列引物, 采用PCR的方法从玉米478叶片基因组DNA中扩增ZmPHR1基因5′上游序列。经3个不同批次PCR、每次5个克隆测序结果验证, 玉米 478中ZmPHR1基因5′上游序列确定为2205 bp (图1), 命名为P2205-ZmPHR1。序列比对结果表明, B73相应的片段为2068 bp。二者的相似度为85.6%, 且有多处不一样, 有3处缺失, 有3处插入(其中最长的一段在-1696 bp至-1850 bp),还有多处替换(附图1)。
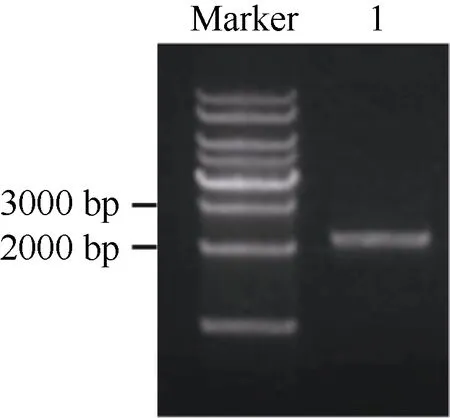
图1 P2205-ZmPHR1扩增片段Fig. 1 Amplified fragment of P2205-ZmPHR1
采用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)顺式作用元件对P2205-ZmPHR1的顺式作用元件分析表明, 全长序列包括 ABA、MeJA、水杨酸3种共6个激素响应位点、6种光调控元件、1个真菌激活响应元件、1个热胁迫响应元件、3个病原体响应元件及2个节律响应元件。TATA box 主要集中在-150 bp 处, CAAT box 主要集中在-200 bp处(图 2)。
2.2 P2205-ZmPHR1缺失片段的获得
根据对P2205-ZmPHR1的生物信息学分析结果,结合不同顺式作用元件在启动子区的分布情况和功能预测对P2205-ZmPHR1进行5′端缺失截段, 5个缺失启动子片段所含元件见图 3。其中-1763 bp至-2205 bp有胚乳发育、热胁迫(HSE)、ABA及光调控相关的顺式作用元件; -1502 bp至-1763 bp有生物节律、水杨酸及茉莉酸甲酯相关的顺式作用元件;-956 bp至 -1502 bp有光调控和生物节律相关调控元件、MYB 结合位点; -482 bp至-956 bp有MYB结合位点; 0至-482 bp有茉莉酸甲酯、光及真菌诱导子响应元件和蛋白结合位点。以含有P2205-ZmPHR1的重组质粒为模板, 通过设计对应PCR引物, 扩增得到长度分别为1763 bp、1502 bp、972 bp、482 bp的产物(图4)。将这些片段分别命名为P1763-ZmPHR1、P1502-ZmPHR1、P972-ZmPHR1和P482-ZmPHR1。
2.3 重组植物表达载体的构建
将所有重组质粒及植物表达载体 pCAMBIA1305分别用SalI和BglII双酶切后连接, 经酶切检测和测序验证获得正确的重组植物表达载体,重组植物表达载体带有GUS报告基因(图 3), 分别命名为P2205-ZmPHR1::GUS、P1763-ZmPHR1::GUS、P1502-ZmPHR1::GUS、P972-ZmPHR1::GUS和P482-ZmPHR1::GUS。将重组载体用电击转化法转入农杆菌GV3101。
2.4 农杆菌转化拟南芥获得转基因纯系
利用浸花法将重组植物表达载体P2205-ZmPHR1::GUS、P1763-ZmPHR1::GUS、P1502-ZmPHR1::GUS、P972-ZmPHR1::GUS和P482-ZmPHR1::GUS与pCAMBIA1305载体(35S::GUS)分别转化野生型拟南芥 Col-0, 温室培养收种。得到的 T0种子经含有25 μg mL–1的MS培养基筛选后, 经PCR检测产物大小为841 bp (图5)。随后移栽温室生长, 自交得到T1, 再经自交和潮霉素筛选后得到纯系 T3, 分别命名为 TP2205-ZmPHR1、TP1763-ZmPHR1、TP1502-ZmPHR1、TP972-ZmPHR1、TP482-ZmPHR1, 用于后续的功能分析。
2.5 转基因拟南芥GUS组织化学染色与GUS蛋白荧光定量分析
为了研究不同长度片段启动子在低磷胁迫诱导下的表达特性并确定该启动子的核心片段, 分别采用高磷(HP)、低磷(LP)两种磷条件处理各转基因株系(TP2205-ZmPHR1、TP1763-ZmPHR1、TP1502-ZmPHR1、TP972-ZmPHR1、TP482-ZmPHR1)并延长低磷胁迫时间, 用GUS染色处理拟南芥 T3植株并测定其 GUS表达活性。
GUS基因在 35S启动子的驱动下, 染色很深,并且不随胁迫时间的延长而变化, 表明这是一个组成型的强启动子。拟南芥Col-0野生型由于没有GUS基因转入, 在所有的处理中均不染色, 可作为阴性对照。在没有低磷胁迫条件下(0 d), 所有转基因植株都没有染色, 胁迫0.5 d, TP972-ZmPHR1植株上有个别染点, 但不明显; 转 TP1502-ZmPHR1植株茎上有染色。胁迫1 d, TP1502-ZmPHR1的植株茎、叶上有明显染色。胁迫2 d、3 d和4 d时, 只有TP972-ZmPHR1和转P1502-ZmPHR1的植株上有染色, 但TP1502-ZmPHR1的植株上比 TP972-ZmPHR1的植株的染色程度深。TP972-ZmPHR1的植株在胁迫2 d染色程度最深, 而 TP1502-ZmPHR1的植株在胁迫 1 d染色程度最深(图6)。

图3 P2205-ZmPHR1 5′端缺失片段顺式作用元件示意图Fig. 3 Schematic show of cis-acting elements in 5′ terminal deletion fragments of P2205-ZmPHR1
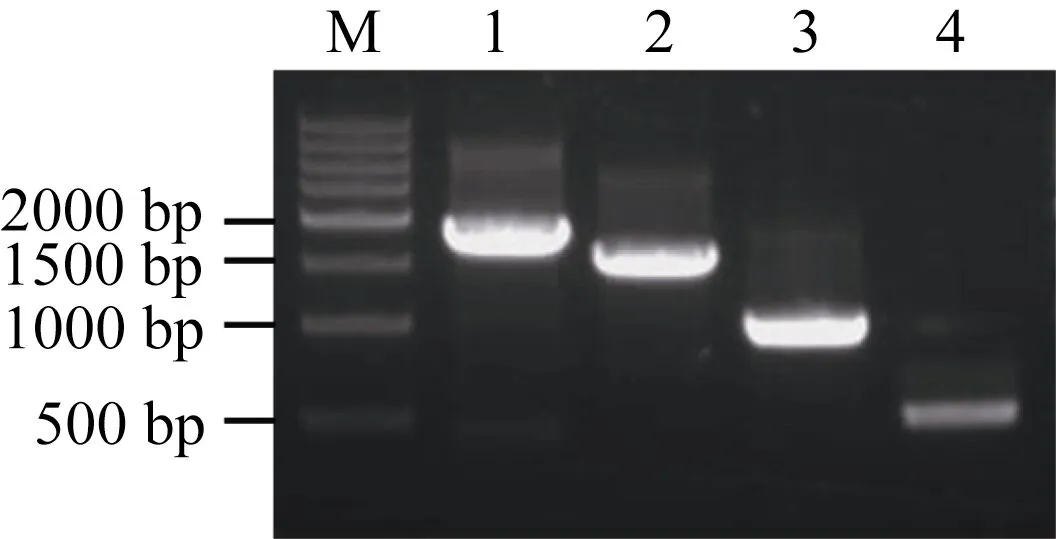
图4 P2205-ZmPHR1 5′端缺失片段扩增图Fig. 4 Amplified fragment in 5′ terminal deletion fragments of P2205-ZmPHR1
GUS蛋白荧光定量结果显示, 转基因拟南芥在低磷处理条件下GUS表达量差别比较大。随着低磷胁迫时间的增加, TP2205-ZmPHR1、TP1763-ZmPHR1和TP482-ZmPHR1株系GUS活性整体表达量变化不大; 在胁迫2 d、3 d和4 d, TP482-ZmPHR1比1 d活性降低。TP1502-ZmPHR1、TP972-ZmPHR1的GUS活性则随低磷胁迫时间出现先升后降, 但是表达时间和活性均不同。TP1502-ZmPHR1在0.5 d时的表达量已有显著增加, 且在1 d时达到顶峰并持续至第3天,第 4天恢复至胁迫前的表达水平; TP972- ZmPHR1胁迫 2 d时活性最高, 但在其余时间和胁迫前无显著变化(图7)。
GUS组织化学染色的定性分析和 GUS蛋白活性的定量分析结果表现一致。ZmPHR1基因的启动子对外界低磷环境的响应具有一定的片段范围, 超过1502 bp, 如1763 bp和2205 bp, 其活性不但没有增高, 反而变为下降或无变化。该基因启动子能够在 1502 bp的片段范围内随着片段长度的增加逐步响应外界低磷环境; 达到-1502 bp时, 响应时间短,表达活性高, 持续时间长。可以推测0至-972 bp为启动子核心区段, -972 bp至-1502 bp为启动功能增强区段。P972-ZmPHR1是基本功能启动子,P1502-ZmPHR1为强启动子。
2.6 转基因植株GUS实时荧光定量PCR分析
为了进一步阐明P1502-ZmPHR1启动子的功能,对TP1502-ZmPHR1幼苗进行了实时荧光定量PCR分析。结果显示, GUS基因的相对表达量确实有先增后降的趋势(图 8), 这与组织化学染色和 GUS蛋白活性分析结果一致。
3 讨论
与组成型启动子相比, 诱导型启动子可在植物受到生物或非生物胁迫时诱导基因表达, 是调控基因表达的“开关”; 而组成型的启动子将会持续表达外源基因, 过量的表达影响植物正常生长所需能量的生成并严重阻碍 RNA 或蛋白质的合成[15-17,25]。因此, 诱导型启动子的研究与利用成为基因工程领域的热点。然而, 多数集中于胁迫响应基因的诱导型启动子研究[26-33], 虽然也有一些调控这些响应基因的转录因子基因的诱导型启动子研究, 但报道数量较少[34-36]。转录因子对于调控这些响应基因的表达起着至关重要的作用, 它们的启动子接收的刺激信号更早, 它们的功能强弱直接影响转录因子的表达量,进而成倍地影响胁迫响应基因的表达。因此, 研究转录因子的诱导型启动子意义更大, 对于通过基因工程改良作物的作用也就更大。正是出于这个目的,本研究通过分析转录因子ZmPHR1启动子的功能成功地分离和鉴定了该启动子。
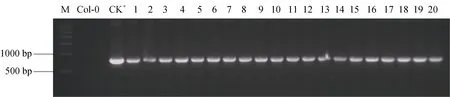
图5 T1转基因拟南芥的PCR检测Fig. 5 PCR analysis of T1 transgenic Arabidopsis plants

图6 低磷胁迫条件下转基因拟南芥GUS染色分析Fig. 6 GUS activity in transgenic Arabidopsis under low phosphorus stress
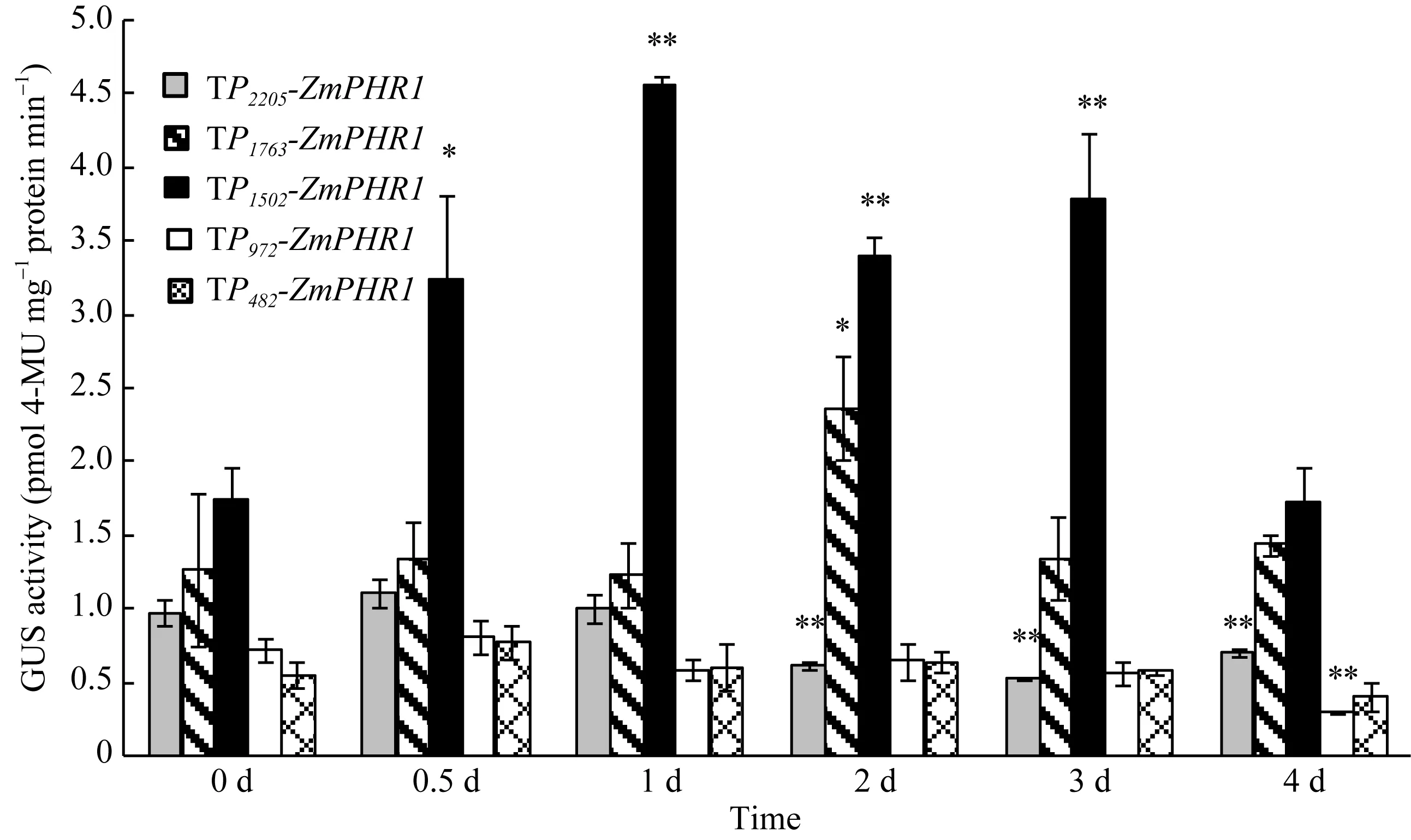
图7 低磷胁迫条件下转基因拟南芥GUS定量分析Fig. 7 Quantification of GUS activity in transgenic Arabidopsis under low phosphorus stress
本研究结果表明, 不同长度的启动子缺失体转基因拟南芥诱导基因表达的强弱不同, 这可能与序列中的作用元件的差异有关。P482-ZmPHR1具备启动基因的功能, 但能力很弱。P972-ZmPHR1比P482-ZmPHR1增加了 510 bp, 这段序列中有许多顺式作用元件增强了它的诱导能力。P1502-ZmPHR1比P972-ZmPHR1增加了530 bp, 但诱导能力成倍增加,可能与增加的作用元件有关。值得注意的是, 这段区间有大量的增强子, 这也许是导致诱导能力加速增加的原因之一。虽然P1763-ZmPHR1比P1502-ZmPHR1仅增加261 bp, 但诱导能力几乎完全停止。与B73序列比较显示, 在1650 bp前有一个近150 bp片段插入。我们暂时不清楚它的功能, 推测它起了抑制子的作用。许多胁迫诱导启动子的研究报道,获得了胁迫诱导条件下具有启动目标基因表达功能的启动子, 但没有说明该序列是否就是活性最强的启动子。本研究的结果建议, 最好进行基因上游较长序列的功能分析, 才能找到活性最强的序列, 这样对于该启动子的应用效果才最大。
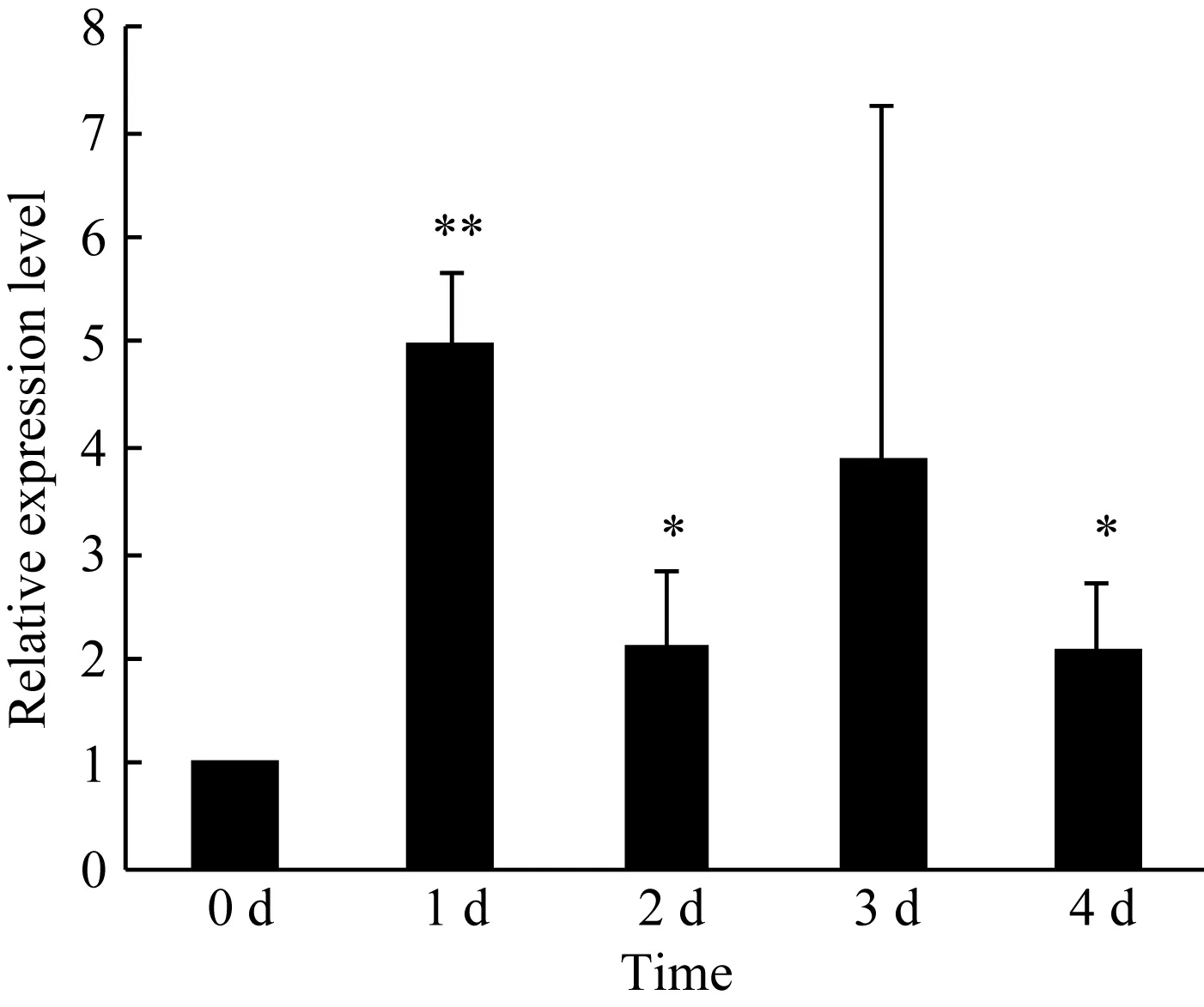
图8 低磷胁迫条件下转基因拟南芥TP1502-ZmPHR1表达量分析Fig. 8 Relative expression of GUS in TP1502-ZmPHR1 transgenic Arabidopsis under low phosphorus stress
在确定了具有最强启动基因功能的启动子后,本研究还探讨了随着胁迫时间的延长该启动子的功能, 这对于阐明和在基因工程中应用该启动子非常重要。非常遗憾的是, 很多胁迫诱导启动子的研究只是介绍了这些启动子在胁迫条件下可以诱导目的基因表达, 但没有涉及随着胁迫时间的延长这些启动子的功能表现。P1502-ZmPHR1在受到外界低磷胁迫的刺激信号后, 诱导基因的表达迅速增加, 随着胁迫时间的延长, 当基因表达量增加到一定程度后,反过来又减弱其功能; 当基因产物消耗到一个阈值后, 又增强了它的功能。研究结果显示, 植物对于胁迫的应答调节能力随条件的改变而改变。这个结果与玉米自交系478在低磷条件下ZmPHR1的表达分析结果类似, 存在一个正负反馈调节[11]。启动子是相同的, 但目的基因不同。
4 结论
从玉米磷高效利用型自交系 478中获得了ZmPHR1基因理想的启动子序列P1502-ZmPHR1。该启动子既受外界低磷胁迫信号的刺激, 也受体内基因产物的影响, 它的表达活性具有反馈调节的作用,是一个可用于植物基因工程的理想的启动子。本研究结果为合理选用启动子以培育磷高效吸收利用的作物品种提供了依据。

