循环肿瘤DNA在非小细胞肺癌疗效评估中的意义
孙云凤, 杨 欣, 方 成, 赵伟庆, 季 枚
(苏州大学第三附属医院 肿瘤内科, 江苏 常州, 213000)
由于人口的增长和老龄化,癌症的发生量也在不断增加。其中肺癌的发病率及死亡率逐年上升[1-2]。目前居中国癌症死亡原因首位的肺癌,已经占到全部恶肿瘤死亡总数的22.7%。目前,肺癌的治疗的疗效评估主要参照影像学RESIST 1.1标准。此外,肿瘤指标CEA、CA 9-9等传统肿瘤指标也作为一个参考指标,但其敏感性不高。循环肿瘤DNA是指肿瘤细胞体细胞DNA通过脱落或者细胞凋亡释放入循环系统,携带一定特征的DNA片段。ctDNA用于预后评估及疗效评估在乳腺癌[3]、结直肠癌[4]、淋巴瘤[5]等肿瘤中均有研究。本研究采用荧光PCR法检测样本总DNA量、完整DNA量及甲基化DNA拷贝数; 收集患者的影像学资料及临床资料,探讨ctDNA是否较传统肿瘤指标CEA、CA 9-9在非小细胞肺癌疗效评估具有更高的敏感性,现报告如下。
1 材料与方法
1.1 一般资料
选取2016年7月—2018年1月在苏州大学第三附属医院住院治疗(包括化疗、靶向治疗)的局部晚期及晚期非小细胞肺癌患者。纳入标准: ① 原发性非小细胞肺癌; ② 系经组织病理确诊; ③ PS评分为0或者1; ④ 实验室检查: 肝、肾功能正常; ⑤ 具有完善的治疗前后的各临床指标。排除标准: ① 患者患有严重的系统性疾病和/或急、慢性感染性疾病; ② 严重的心、肝、肾等脏器疾病; ③ 有精神系统疾病患者。分组情况: 按照影像学RECIST 1.1标准评估疗效,分为进展组和有效组(CR+PR+SD)。
1.2 主要试剂及仪器设备
QIAamp DNA Blood Mini kit试剂盒[凯杰企业管理(上海)有限公司(Qiagen)]; EZ DNA Methylation-Gold Kit试剂盒(北京天漠科技开发有限公司); 基因引物(金唯智生物科技有限公司); mastermix聚合酶(近岸蛋白质科技有限公司); 恒温水箱(常州朗越仪器制造有限公司); 恒温金属浴(朗越仪器制造有限公司); 4 ℃冰箱(青岛海尔股份有限公司); -20 ℃冰箱(青岛海尔股份有限公司); 台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司); 台式常温离心机(湖南湘仪实验室仪器开发有限公司); 振荡器(金坛市白塔新宝仪器厂); ABI荧光定量PCR仪-7500型[赛默飞世尔科技(中国)有限公司]; 生物安全柜(上海鼎科科学仪器有限公司); 超净工作台(上海鼎科科学仪器有限公司); 循环变温器(浙江新丰医疗器械有限公司)。
1.3 实验方法
1.3.1血液样本DNA提取: 采用QIAamp DNA Blood Mini kit法。取2 mL的离心管,加入20 μL的蛋白酶K; 再加入200 μL血浆后混匀; 再加200 μL Buffer AL 于上述离心管底,混匀,振荡15 s; 随后在56 ℃水箱中放置10 min; 取出离心管,短暂离心5 s; 加200 μL无水乙醇于上述混合液中,振荡15 s混匀,短暂离心; 完成后,在QIAamp柱子中加入上述混合液,然后将柱子放在2 mL收集管中,盖上盖子,将之放入离心机中以8 000 转/min离心1 min; 离心后,丢去原先的收集管,放入一个干净的收集管中,打开QIAamp柱子,加入500 μL Buffer AW1于柱子中,盖上盖子,将之放入离心机中,以8 000 转/min离心1 min; 然后丢去用过的收集管,放入一个新的干净的收集管中,打开QIAamp柱子,加500 μL Buffer AW2于柱子中,盖上盖子,将之放入离心机中,以14 000 转/min离心3 min; 丢去离心后的收集管,将柱子套在一个新的收集柱中,以14 000 转/min离心3 min后,将柱子取出,打开盖子,室温干燥; 待乙醇完全蒸发后,将柱子套在一个1.5 mL的干净的离心管中,加入40 μL Buffer AE 于柱子底部,静置5 min后放入离心机中,以10 000 转/min离心3 min。提取出的DNA备用。
1.3.2DNA甲基化处理: 采用EZ DNA Methylation-Gold Kit试剂盒法。在500 μL PCR管中添加130 μL的CT conversion Reagent,然后再加入提取备用的20 μL DNA样品,通过轻弹试管或移液器操作来混合样品; 将样品管放到循环变温器中, 98 ℃放置10 min, 64 ℃放置2.5 h, 在Zymo-Spin IC Column中加600 μL M-binding Buffer, 并将柱子放入试剂盒提供的收集管中; 添加PCR管中的混合液到上述加有M-binding Buffer的Zymo-Spin IC Column中,盖上盖子,反复颠倒柱子以充分混匀样品,然后将柱子放入离心机中,以10 000 转/min离心1 min; 弃除掉柱中的废液,添加100 μL M-Wash Buffer于柱子底部,以10 000 转/min全速离心1 min; 弃除掉柱中的废液,在柱子底部添加200 μL M-Desulphonation Buffer, 在室温(20~30 ℃) 下放置15~20 min, 随后以10 000 转/min全速离心1 min; 弃掉柱中的废液,添加200 μL M-Wash Buffer于柱子底部,以10 000 转/min全速离心1 min; 弃掉柱中的废液,再加200 μL M-Wash Buffer于柱子底部,以10 000 转/min全速离心1 min; 将柱子套在1.5 mL离心管中,添加30 μL M-Elution Buffer于柱子中,以10 000 转/min全速离心1 min来洗脱DNA,随后进行DNA分析。
1.3.3总DNA及完整DNA计算(PCR): 使用已知拷贝数为N1的DNA样本,经过Ct1个PCR扩增循环,到达设定阈值,然后使用同样的方法,处理需检测样本中的拷贝数N2, 经过Ct2个循环达到同样的阈值,根据下述公式,计算得出样本的总DNA及完整DNA的拷贝数。N2=N1×2Ct1-Ct2。
1.3.4甲基化DNA拷贝数计算(PCR): 计算方法及原理同总DNA、完整DNA。
1.4 统计学处理
统计学处理采用SPSS 22.0软件进行分析,计量资料采用均数±标准差表示,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。GraphPad Prism 5.0软件作图。
2 结 果
2.1 一般资料
48例非小细胞肺癌患者中女14例(29.17%), 男34例(70.83%), 年龄42~79岁,中位年龄63岁; 48例NSCLC患者中包含腺癌40例(83.33%), 鳞癌6例(12.50%), 细支气管肺泡癌1例(2.08%), 腺鳞癌1例(2.08%); Ⅳ期患者42例, Ⅲ期6例; CT评估OR 30例, PD 18例; CEA降低32例,升高16例; CA 19-9降低35例,升高13例; ctDNA评估治疗获益25例,评估为有进展可能23例。见表1。
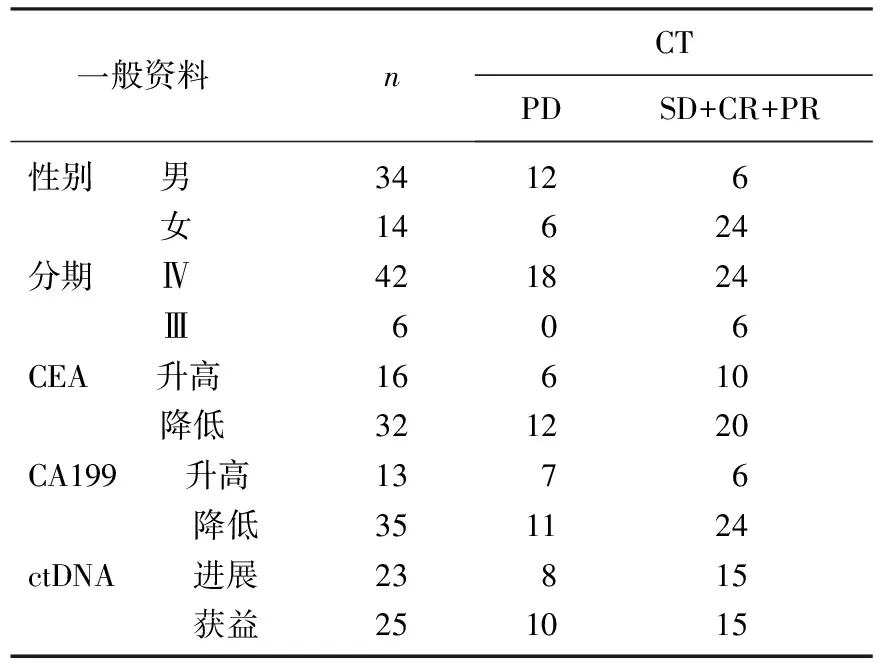
表1 患者一般资料
2.2 ctDNA、CEA与CA 19-9评估疗效的敏感性 比较
分别使用CT、ctDNA、CEA、CA 19-9评估疗效,若CEA数值较前降低,且CT评估为OR, 表示CEA与CT评估一致。若ctDNA评估进展, CT评估PD表示两者评估结果一致。
ctDNA与CT评估一致的患者23例(47.92%), CEA与CT评估一致的患者26例(54.17%), CEA与CT的一致率较ctDNA高,但二者无显著差异(P=0.540)。见图1。ctDNA与CT评估一致的患者23例(47.92%), CA 19-9与CT评估一致的患者31例(64.58%), CA 19-9与CT的一致率较ctDNA高,但二者无显著差异(P=0.100)。见图2。CEA与CT评估一致的患者26例(54.17%), CA 19-9与CT评估一致的患者31例(64.58%), CA 19-9与CT的一致率较CEA高,但二者无显著差异(P=0.299)。见图3。
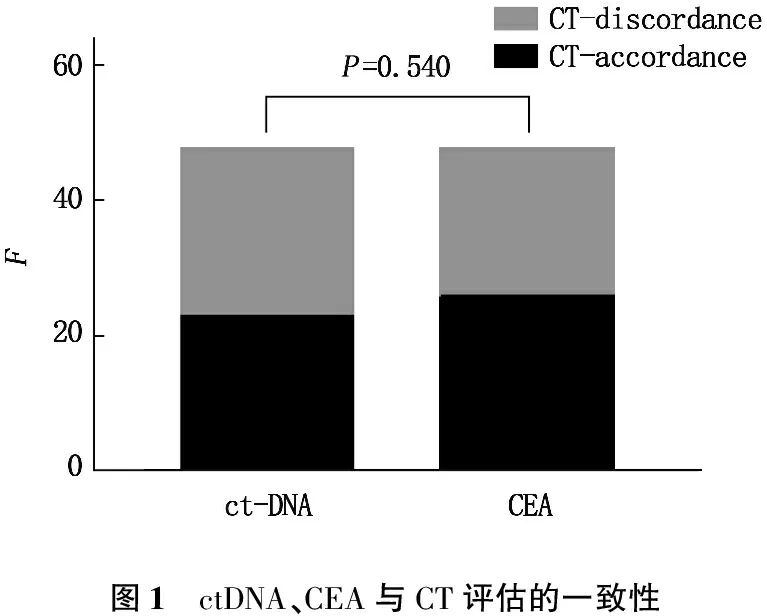
图1 ctDNA、CEA与CT评估的一致性
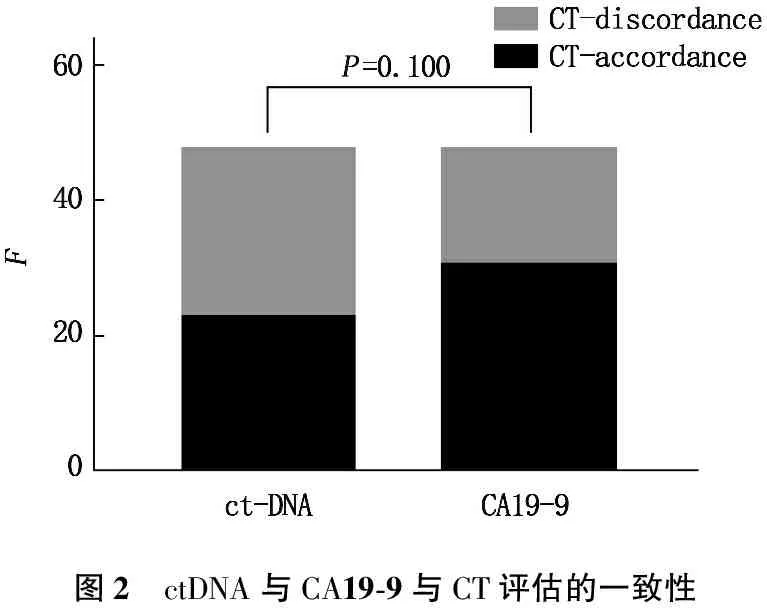
图2 ctDNA与CA19-9与CT评估的一致性
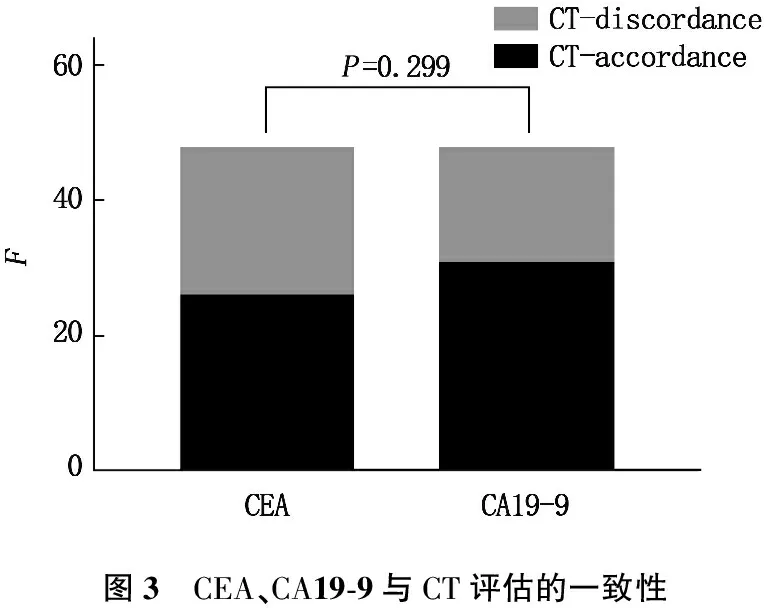
图3 CEA、CA19-9与CT评估的一致性
3 讨 论
肺癌的高发病率与高致死率已经严重威胁到人类的健康。由于早期肺癌患者临床症状特异性不强,大部分肺癌患者确诊时癌细胞已发生了转移,导致患者的总体生存期短。肺癌的转移过程相当复杂,其主要转移途径有种植性转移、直接浸润、淋巴道转移及血行转移。血行转移是肺癌转移的首要路径,然而其转移效率较低,在经过一系列转移过程后,最终只有约0.01%的肿瘤细胞在血液循环得以存活,最后形成转移灶。
随着对肺癌的不断研究,针对肺癌的治疗方法不断增多,抗血管生成药物、分子靶向药物、免疫治疗等方法的临床应用,使得肺癌患者无疾病进展期明显延长,但是患者的5年生存率仍然较低[6]。目前肿瘤的早期诊断及疗效评估主要依据影像学变化及肿瘤指标。血清肿瘤标志物是诊断肿瘤的无创性检测手段,广泛用于肿瘤的筛查、治疗效果及患者的预后评估。然而,其特异性及敏感性欠佳,不能满足临床要求。CEA诊断肺癌的敏感性仅有40%[7], 其在肺癌中的预测、预后价值仍有争议[8]。本研究通过荧光定量PCR法对NSCLC患者治疗前及治疗后的血浆中的ctDNA进行检测,以CT为参考标准,进一步与传统肺癌血清肿瘤标志物CEA、CA 19-9对NSCLC治疗疗效价值进行比较。
本研究结果显示, CEA、CA19-9、ctDNA均有一定的疗效预测作用,但敏感性不高,且ctDNA在评估治疗疗效上其并不优于CEA、CA 19-9, 与预期研究结果不一致。可能与下述原因有关: ① 在癌细胞侵袭入血的过程中,大部分的癌细胞被NK细胞吞噬,血液中残留的循环细胞及循环DNA含量均较低,因此对检测技术要求较高。循环中的肿瘤DNA在体内间断释放,且在体内不断的代谢,检测结果会因采血时间、饮食因素、个体差异及潜在的其他系统疾病影响。② 肺癌容易发生转移,如脑转移、骨转移、肾上腺转移、淋巴结转移等。研究[9-11]认为,肺癌的甲基化与肺癌的恶性程度及预后有关,本研究中, ctDNA的评估依据总DNA、DNA完整性、甲基化DNA三者综合评价疗效,其中检测结果中的甲基化DNA, 仅仅检测了WT1、CDKN2A、CDH 13、SLIT 2、HOXA 9、SFRP 2、SNCA、CST 6这8个常见的基因位点,以这8个位点的甲基化数量为甲基化DNA总量,而没有检测其他少见甲基化突变位点。③ 目前肺癌的治疗,仍然参考影像学评估,但是抗血管治疗及分子靶向治疗使得肿瘤发生空泡化、坏死、液化等变化,而在CT上表现为肿瘤病灶增大,依据影像学RECIST 1.1标准,疾病评估为进展(PD), 但实际上治疗是获益的。因此,单纯的以肿瘤直径变化来评估疗效的可靠性仍有待进一步考察。④ ctDNA检测过程复杂,步骤繁琐,一系列操作流程稍微的误差对最终的结果均可能有一定的影响。此外,本实验的纳入研究对象仅有48例,考虑样本量不足,需进一步扩大样本量。

