MiR-9对人胃癌细胞增殖和迁移的影响*
刘文明 范燕云 田钊旭 万 曼 周 飞 胡益群
厦门大学附属中山医院消化内科 厦门大学消化疾病研究所厦门市消化疾病诊治中心(361004)
背景:MicroRNA-9(miR-9)参与调控生长、发育、细胞自我更新和多向分化等多种生理过程,而且其表达异常与多种恶性肿瘤密切相关。目的:探讨miR-9对人胃癌细胞生物学行为的影响。方法:以real-time PCR检测人正常胃黏膜上皮细胞株GES-1和人胃癌细胞株BGC-823、SGC-7901中的miR-9表达。采用瞬时转染法将miR-9类似物、miR-9抑制物和空载体分别转染BGC-823、SGC-7901细胞,并以real-time PCR验证转染效率。CCK-8实验检测细胞增殖能力,Transwell细胞迁移实验和划痕实验检测细胞迁移能力。结果:与正常胃黏膜上皮细胞相比,胃癌细胞miR-9表达显著升高(P<0.05)。与空载体对照组相比,miR-9类似物组BGC-823、SGC-7901细胞miR-9表达上调,细胞增殖和迁移能力明显增强(P<0.05),miR-9抑制物则可显著抑制胃癌细胞的增殖和迁移能力(P<0.05)。结论:上调miR-9表达可促进胃癌细胞增殖和迁移,提示miR-9过表达可能与胃癌进展有关。
胃癌是消化系统最常见的恶性肿瘤之一,目前在全世界范围内,胃癌发病率居恶性肿瘤第四位,死亡率居第二位[1]。我国是胃癌高发地区,年新发病例占全球总数的40%[2],在我国恶性肿瘤发病率和死亡率中,胃癌均居第三位[3]。由于缺乏特异而有效的早期胃癌筛查指标,大多数胃癌患者就诊时已进入进展期,治疗效果欠佳,尤其是晚期胃癌患者预后极差[4]。因此,深入了解胃癌的分子遗传学机制,探索胃癌发生、发展相关基因,为胃癌的诊断和治疗提供理论依据成为目前的研究热点。
微RNA(microRNAs, miRNAs)是一组由基因组编码的长度约20~23 nt的非编码RNA,是广泛存在于真核生物中的一类重要的调控分子,通过与靶基因mRNA碱基配对引导RNA诱导沉默复合体(RISC)降解mRNA或阻碍其翻译,从而发挥对靶基因的转录后沉默作用[5-7]。目前研究认为,miRNAs在恶性肿瘤发生、发展中可能扮演癌基因或抑癌基因的角色[8],因此对miRNAs的深入研究对于探讨胃癌的浸润、转移机制具有重要意义。
MiR-9在体内发挥重要的生物学作用,参与调控生长、发育、细胞自我更新和多向分化等多种生理过程。既往研究发现miR-9表达异常与血液系统恶性肿瘤、卵巢癌、恶性黑色素瘤、肝细胞癌等密切相关[9-16]。本研究旨在探讨miR-9对人胃癌细胞生物学行为的影响,以期为寻找新的胃癌诊治靶点提供线索。
材料与方法
一、细胞株和主要试剂
人正常胃黏膜上皮细胞株GES-1、人胃癌细胞株BGC-823、SGC-7901(中国科学院上海生命科学研究院)。DMEM培养基、RPMI 1640培养基、OPTI-MEM减血清培养基、胰蛋白酶、小牛血清(FBS)(GibcoTM, Thermo Fisher Scientific);miR-9类似物、miR-9抑制物(广州市锐博生物科技有限公司);HiPerFect转染试剂、miScript Ⅱ逆转录试剂盒、miScript SYBR®Green PCR试剂盒(QIAGEN);TRIzol RNA分离试剂(InvitrogenTM, Thermo Fisher Scientific); CCK-8细胞增殖/毒性检测试剂盒(同仁化学研究所);Transwell小室(BD Biosciences)。
二、方法
1. 细胞培养:GES-1细胞培养液为含10% FBS、1%青霉素-链霉素双抗的DMEM培养基;BGC-823、SGC-7901细胞培养液为含10% FBS、1%青霉素-链霉素双抗的RPMI 1640培养基。三株细胞均置于37 ℃、5% CO2细胞培养箱内培养,每天换液,3~4 d进行一次传代。
2. 细胞转染和分组:转染实验设miR-9类似物组、miR-9抑制物组和空载体对照组。根据后续实验要求将细胞接种于细胞培养板,待细胞密度达到50%~80%时,采用瞬时转染法,参照HiPerFect转染试剂说明书,分别转染miR-9类似物、miR-9抑制物或空载体。转染后细胞置于37 ℃、5% CO2细胞培养箱内培养,用于后续实验。
3. Real-time PCR:取未予处理的GES-1、BGC-823、SGC-7901细胞和转染24 h后的各组细胞,以TRIzol RNA分离试剂提取总RNA,以miScript Ⅱ逆转录试剂盒合成cDNA,以之为模板,采用miScript SYBR®Green PCR试剂盒行PCR扩增。MiR-9引物序列:5’-UCU UUG GUU AUC UAG CUG UAU GA-3’;内参照U6引物序列:5’-CAA ATT CGT GAA GCG TTC CAT AT-3’。每组设3个复孔,实验至少重复3次。以2-ΔΔCt法计算miR-9相对表达量。
4. CCK-8实验:细胞转染24 h后,0.25%胰蛋白酶消化,计数细胞。将细胞接种于96孔板(8×103/孔),每组设3个复孔,置于37 ℃、5% CO2细胞培养箱内培养。分别于培养24 h、48 h和72 h后加入100 μL 新鲜培养基和10 μL CCK-8,培养1 h后于酶标 仪450 nm波长处读取吸光度(A)值。应用GraphPad Prism软件,根据各时间点A450绘制生长曲线。
5. Transwell细胞迁移实验:细胞转染24 h后,常规消化、计数。以无血清培养基重悬细胞,于Transwell小室上室接种1×105个细胞,下室加入500 μL含20% FBS的培养基。培养24 h后取出小室,温PBS清洗,加入-20 ℃预冷的4%多聚甲醛固定10 min,PBS清洗后以湿棉签去除上室内侧面细胞,PBS清洗,结晶紫染色。超纯水清洗、风干后于显微镜下拍照,随机选取5个高倍视野,计数穿膜细胞。
6. 划痕实验:细胞转染24 h后,各组细胞等量接种于6孔板(以第2 d细胞长满为标准)。培养24 h后,使用200 μL无菌枪头进行划痕,以PBS洗去脱落细胞,于显微镜下拍摄3个随机视野(0 h),记录拍摄位置。加入新鲜无血清培养基继续培养24 h,吸除培养基后再次拍照(24 h),观察划痕闭合情况,计算划痕闭合率[(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%]。实验至少重复3次。
三、统计学分析
结 果
一、胃癌细胞miR-9表达和转染效率验证
Real-time PCR检测显示,与人正常胃黏膜上皮细胞株GES-1相比,人胃癌细胞株BGC-823、SGC-7901中的miR-9相对表达量明显升高,差异有统计学意义(P<0.05)(图1)。
转染miR-9类似物后,BGC-823、SGC-7901细胞miR-9相对表达量较空载体对照组明显升高(图2A),转染miR-9抑制物后,两株胃癌细胞miR-9相对表达量较空载体对照组明显降低(图2B),差异均有统计学意义(P<0.05)。
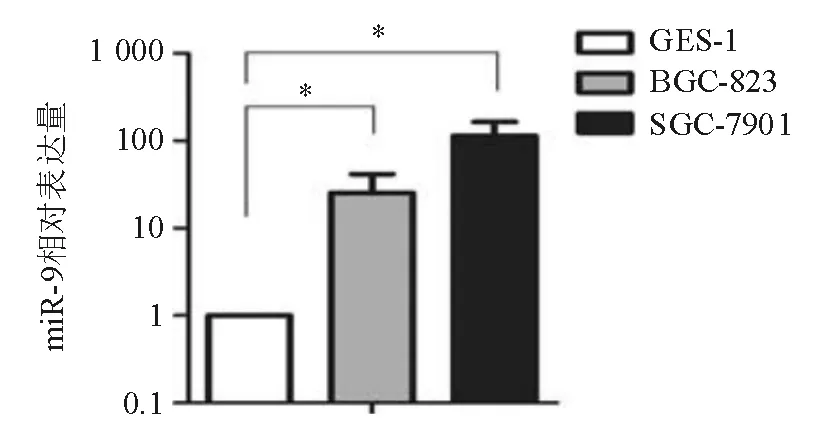
*两组间比较,P<0.05
图1人正常胃黏膜上皮细胞和胃癌细胞miR-9表达比较(real-timePCR)
二、MiR-9促进胃癌细胞增殖
细胞转染后分别培养24 h、48 h和72 h,CCK-8实验显示48 h和72 h时各组间A450差异显著(P<0.05);与空载体对照组相比,miR-9类似物组BGC-823、SGC-7901细胞增殖能力明显增强,miR-9抑制物组两株胃癌细胞生长则显著受抑(图3),提示miR-9可促进胃癌细胞增殖。
三、MiR-9提高胃癌细胞迁移能力
Transwell细胞迁移实验显示,细胞接种于小室上室24 h后,miR-9类似物组BGC-823、SGC-7901细胞穿膜细胞数均明显多于空载体对照组,差异有统计学意义(P<0.05);相反,miR-9抑制物组两株胃癌细胞穿膜细胞数均较空载体对照组减少(P<0.05)(图4)。上述结果表明miR-9能提高胃癌细胞的迁移能力。
选取SGC-7901细胞进行划痕实验,以进一步明确miR-9对胃癌细胞迁移能力的影响,结果显示24 h时miR-9抑制物组划痕最宽,空载体对照组次之,miR-9类似物组划痕最窄;miR-9类似物组划痕闭合率明显高于空载体对照组和miR-9抑制物组,miR-9抑制物组划痕闭合率明显低于空载体对照组,差异均有统计学意义(P<0.05)(表1)。
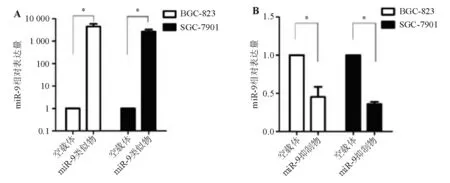
*两组间比较,P<0.05
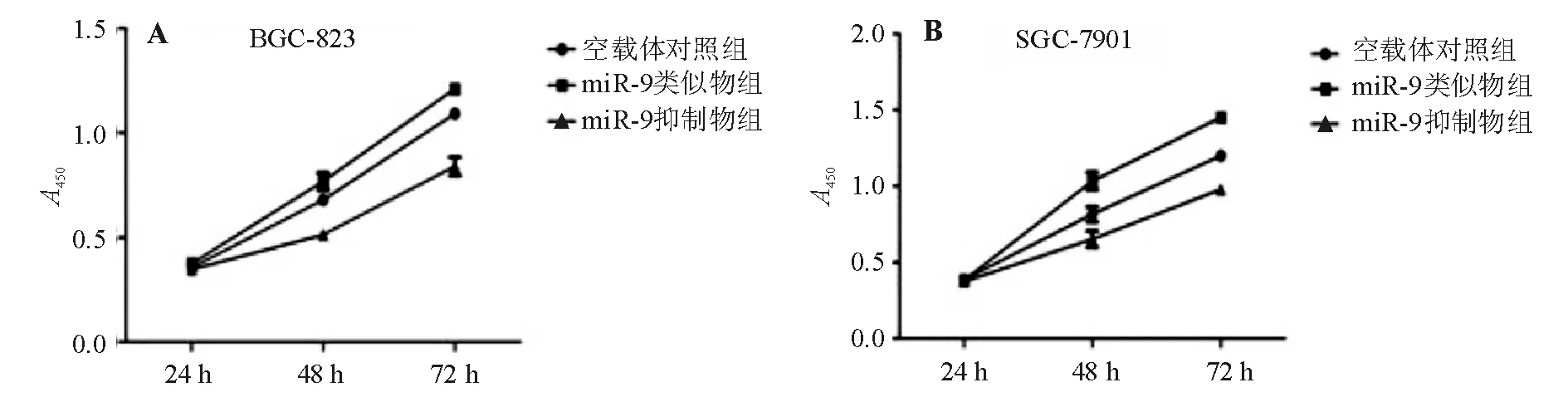
图3 各组胃癌细胞增殖能力比较(CCK-8实验)
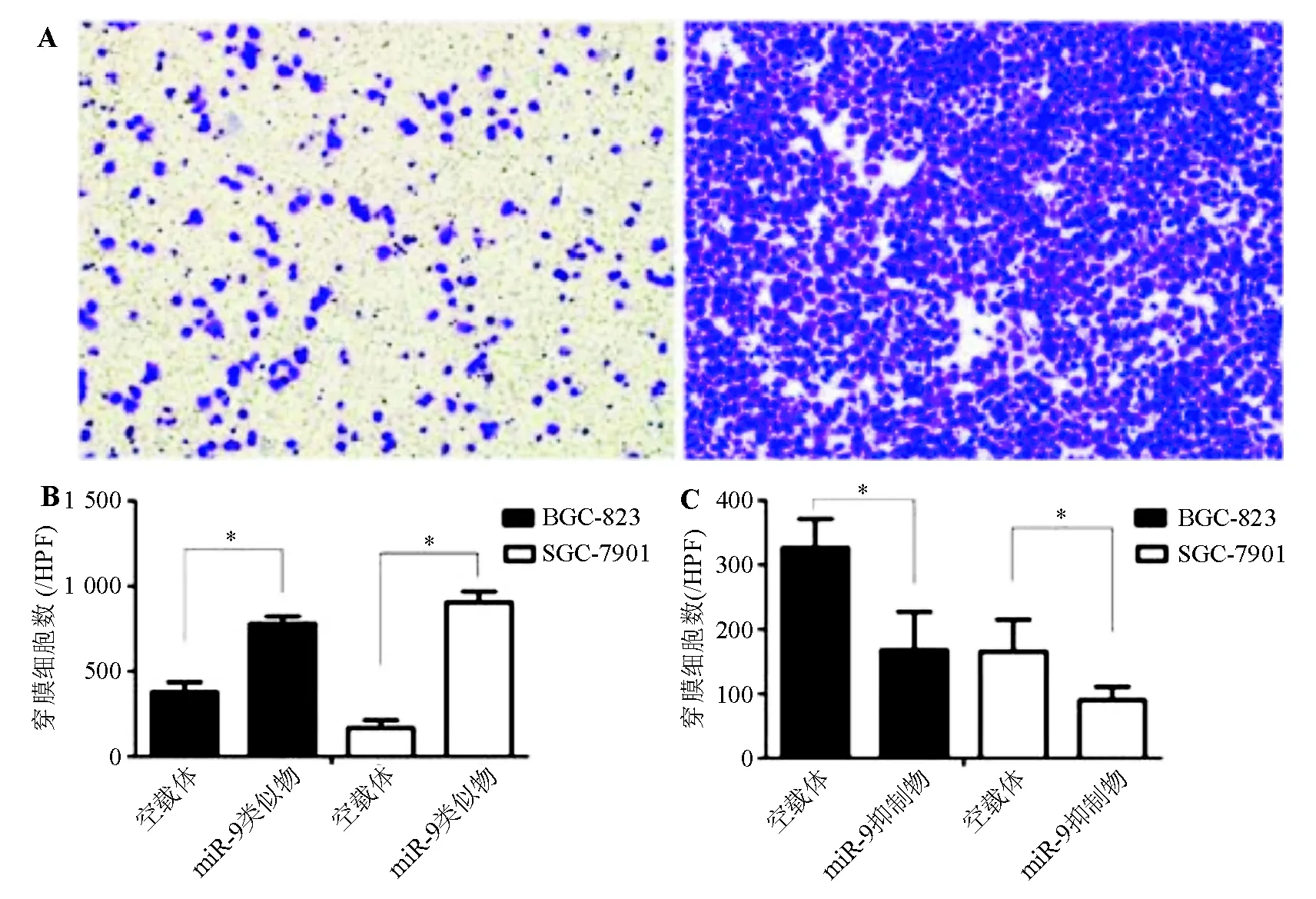
*两组间比较,P<0.05
A:空载体对照组(左)和miR-9类似物组(右)穿膜SGC-7901细胞(结晶紫染色,×200);B、C:miR-9类似物组和miR-9抑制物组胃癌细胞穿膜细胞数
图4各组胃癌细胞迁移能力比较(Transwell细胞迁移实验)
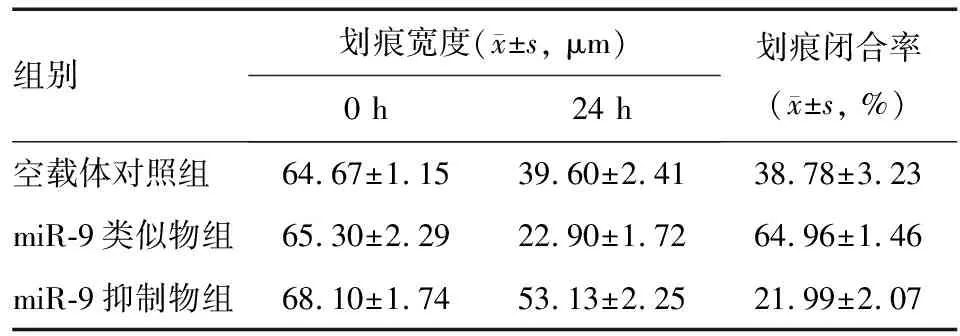
表1 各组SGC-7901细胞迁移能力比较(划痕实验)
讨 论
MiRNAs是一类内源性非编码小RNA分子,具有高度保守性、时序性和组织细胞特异性,能在转录后水平调控基因表达,主要作为基因表达的负性调控因子,在生物体的多种生理和病理过程中发挥重要调节作用[17]。研究显示miRNAs异常表达参与了包括胃癌在内的多种常见恶性肿瘤的发生、发展[7,18]。
与其他miRNAs一样,miR-9亦具有广泛的生物学效应。研究发现miR-9在多种类型的恶性肿瘤中存在异常表达,参与恶性肿瘤的发生、发展、侵袭、转移、耐药[9-16]。在人上皮性卵巢癌中,miR-9为独立预后预测因素,低表达患者无病生存期和总生存期明显缩短[14];而在肝细胞癌中,与早期患者相比,晚期患者肿瘤组织中miR-9表达水平升高,其高表达与肿瘤临床分期以及总生存期下降呈正相关[16]。研究[11]发现FoxO1、FoxO3是造血细胞中miR-9的直接作用靶点,上调FoxO3可抑制miR-9诱导的骨髓细胞生成。在Burkitt淋巴瘤细胞株EBV+Raji和EBV-Ramous 中,miR-9可通过BCL-6调控细胞凋亡[12]。SIRT1亦为miR-9的靶基因之一,miR-9可通过下调SIRT1抑制肿瘤细胞如急性髓性白血病细胞、恶性黑色素瘤细胞增殖、迁移[9,15]。在肝细胞癌中,miR-9通过抑制靶基因上皮细胞钙黏蛋白(E-cadherin)和过氧化物酶体增殖物激活受体-α(PPAR-α)参与调控肿瘤发生[16]。
为探讨miR-9在胃癌发生、发展中的作用,本研究将miR-9类似物和抑制物分别转染人胃癌细胞株BGC-823和SGC-7901(同时设立空载体对照组),通过上调或下调miR-9表达,观察其对胃癌细胞生物学行为的影响。结果显示上调miR-9对两种人胃癌细胞株的恶性增殖行为均具有明显促进作用,同时提高细胞迁移能力,而下调miR-9则可抑制胃癌细胞增殖、迁移,表明miR-9可能参与了胃癌细胞增殖、浸润和转移的调控,提示其可能在胃癌发生、发展过程中起癌基因的作用。
综上所述,上调miR-9表达可促进胃癌细胞增殖和迁移,提示miR-9过表达可能与胃癌进展有关,有成为胃癌生物学标记物和治疗靶点的潜在可能性。本研究发现为胃癌恶性进展的预测及其治疗相关研究提供了新的线索和依据。

