小脑顶核注射谷氨酸对慢性内脏高敏感大鼠的作用及其机制研究
甄玲玲 苗 蓓 陈影影 苏 贞 徐曼秋 费素娟 张建福
徐州医科大学附属医院消化内科(221002)
背景:小脑顶核(FN)参与对心血管、摄食、呼吸运动、急性胃黏膜损伤等内脏活动的调节,但对内脏高敏感的调节作用及其可能的机制目前尚未完全清楚。目的:探讨小脑FN注射谷氨酸(Glu)对慢性内脏高敏感大鼠的影响及其可能的机制。方法:采用新生期大鼠结直肠扩张(CRD)法制备慢性内脏高敏感模型。8周后,将大鼠分为CRD组、溶剂组(小脑FN注射0.2 μL 0.9% NaCl溶液)、高、中、低剂量Glu组(小脑FN分别注射12、6、3 μg Glu)、3-MPA+Glu组(小脑FN注射谷氨酸脱羧酶抑制剂3-MPA后注射12 μg Glu)、Bic+Glu组(下丘脑外侧区注射GABAA受体拮抗剂Bic后小脑FN注射12 μg Glu)。以痛阈、腹壁回撤反射(AWR)评分和腹外斜肌放电肌电图(EMG)幅度评估内脏敏感性,检测丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性。结果:成功制备慢性内脏高敏感大鼠模型。与CRD组相比,Glu可剂量依赖性地升高痛阈(P<0.05),降低AWR评分和EMG幅度(P<0.05),降低MDA含量(P<0.05),升高SOD活性(P<0.05)。与12 μg Glu组相比,3-MPA+Glu组、Bic+Glu组痛阈显著降低(P<0.05),AWR评分和EMG幅度显著升高(P<0.05),MDA含量显著升高(P<0.05),SOD活性显著降低(P<0.05)。结论:小脑FN注射Glu可明显降低大鼠内脏敏感性,其机制可能为FN的Glu在谷氨酸脱羧酶作用下生成GABA,与下丘脑外侧区GABAA受体结合,增强肠黏膜组织的抗氧化能力,从而降低内脏敏感性。
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的肠道功能性疾病,研究表明,IBS患者占消化科门诊患者的25%左右[1]。目前IBS的发病机制尚不明确,普遍认为内脏高敏感在其发生、发展中起有重要作用。研究表明,小脑不仅参与对躯体运动的调控,还参与调节非躯体性活动包括学习、记忆、认知、语言、内脏活动等[2-4]。小脑对胃肠道痛觉的调控作用尚未见报道。本研究通过小脑顶核(FN)注射化学药物,旨在探讨其对慢性内脏高敏感大鼠的影响及其可能的调控机制,从而为研究IBS的发病机制提供新的思路和治疗途径。
材料与方法
一、实验动物
新生Sprague-Dawley(SD)幼鼠34只(亲代大鼠购自徐州医科大学实验动物中心),雌雄不拘,每8只与母鼠同笼饲养,母乳喂养,至21 d后幼鼠与母鼠分笼,幼鼠每4只一笼,室温、昼夜节律条件下饲养,自由摄食饮水。
二、主要试剂
谷氨酸(Glu)、谷氨酸脱羧酶抑制剂3-MPA、GABAA受体拮抗剂荷包牡丹碱(Bic)均为Sigma公司产品。丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒为南京建成生物工程研究所产品。
三、研究方法
1. 实验分组:将新生幼鼠随机分为模型组(n=28)和假手术组(n=6),模型组幼鼠行结直肠扩张(colorectal distension, CRD)。第9周,将模型组大鼠随机分为七组,分别为CRD组、溶剂组[小脑FN微量注射0.2 μL 0.9% NaCl溶液(NS)]、Glu组(3、6、12 μg Glu分别溶于0.2 μL NS,小脑FN微量注射)、3-MPA+Glu组(20 μg 3-MPA溶于 0.2 μL NS,小脑FN微量注射,10 min后将12 μg Glu注射至小脑FN内)、Bic+Glu组[Bic 10 μg溶于 0.2 μL NS,下丘脑外侧区(LHA)微量注射,10 min后将 12 μg Glu注射至小脑FN内],每组各4只。
2. 慢性内脏高敏感大鼠模型的建立
①幼鼠慢性内脏高敏感模型的建立:参照Al-Chaer等[5]的方法并作相应改进来制备CRD大鼠,将出生后第8、10、12天的幼鼠,于上午9时和11时采用棉签沾湿温水擦拭肛门两圈,将直径 3 mm、长10 mm的经皮冠状动脉腔内成形术(PTCA)球囊从肛门完全插入结直肠中,然后行充气扩张(压力为60 mm Hg)(1 mm Hg=0.133 kPa),持续1 min后放气撤出,清洁肛门,放回母鼠身边。假手术组幼鼠仅用球囊刺激肛门,不插入直肠。
②成年大鼠CRD球囊的制作:球囊长度为4 cm,由输液延长管插入6号乳胶手套小指制成,用丝线结扎导管和指套根部,确保球囊与导管间不漏气,导管另一端通过三通管,一端连接充气注射器,另一端连血压计。球囊制备后充气,备用。
3. 大鼠内脏敏感性的测定:大鼠实验前18 h禁食不禁水,以10%水合氯醛麻醉。
①痛阈测量:将涂有石蜡油的球囊轻轻插入大鼠肛门内5~6 cm,肛门外导管固定于大鼠尾根部。缓慢向球囊注射空气,初始压力为10 mm Hg,其后依次递增10 mm Hg,维持10 s 后,抽出空气,间隔4 min,再次重复加压,直至大鼠AWR评分达3分,记录最小的压力值,实验重复5次,取均值。
②腹壁回撤反射(abdominal withdrawal reflex,AWR)评分:按前述方法将球囊插入大鼠肛门并固定,然后放入有机玻璃观察箱内(20 cm×12 cm×9 cm),待其苏醒并完全适应环境30 min后开始实验。通过注射器向球囊内注入空气,压力分别为20、40、60、80 mm Hg,每次持续20 s,间隔4 min,记录大鼠AWR评分。每个压力重复3次,取均值。
AWR评分标准:0分,大鼠无明显行为变化;1分,大鼠身体静止不动或仅有简单的头部运动;2分,大鼠腹部肌肉开始收缩,但腹壁未抬离桌面;3分,大鼠腹壁明显收缩变平或下腹壁抬离桌面;4分,大鼠腹壁拱起或伴身体、骨盆躬起。
③腹外斜肌放电肌电图(electromyography, EMG)幅度:将涂有石蜡油的球囊插入大鼠结直肠内,切开一侧腹部皮肤,暴露腹外斜肌,插入消毒银丝双电极。采用BL-420E生物信号采集处理系统记录腹外斜肌的基础放电(高频滤波2 kHz,时间常数0.001 s,采样频率40 Hz,灵敏度500 mV,走纸速度250 ms/div),然后CRD压力迅速达到20、40、60、80 mm Hg,每次加压记录10 s,间隔4 min,记录各个压力下腹外斜肌放电幅度。腹外斜肌EMG幅度为每个压力下腹外斜肌放电的幅度减去基础放电的幅度。
4. 组织学检查:行为学实验完毕后处死大鼠,快速取结直肠段,-80 ℃冰箱保存备用,并取部分肠段固定于4%甲醛溶液,石蜡切片,行HE染色。观察结直肠局部组织有无损伤、炎症等病理改变。
5. 核团微量注射:实验前大鼠禁食18 h,自由饮水。10%水合氯醛腹腔注射麻醉大鼠,按大鼠脑图谱,定位小脑FN(坐标:AP 11.64 mm, RL 1.20 mm, H 6.50 mm)和LHA(坐标:AP 2.12 mm, RL 1.50 mm, H 8.40 mm)[6]。采用微量进样器进行注射,10 min内注射完毕。退出微量进样器,滴加骨蜡封闭钻孔,缝合头皮切口。
注射4 h后检测各组大鼠痛阈、AWR评分(CRD压力为40 mm Hg)、EMG幅度(CRD压力为40 mm Hg)。检测完毕后,处死大鼠,取出大脑,-80 ℃ 保存,行脑定位鉴定。
6. 肠黏膜MOD含量和SOD活性的测定:将肠组织制成10%的组织匀浆,采用TBA法测定MDA含量(以nmol/100 mg组织干重表示)。取1/4稀释成1%的组织匀浆,用黄嘌呤氧化酶法测定SOD活性(以U/mg蛋白表示)。
四、统计学分析
结 果
一、慢性内脏高敏感大鼠模型的建立
与假手术组相比,模型组痛阈显著降低(P<0.01);扩张压力为20、40、60 mm Hg时,模型组大鼠AWR评分和EMG幅度均显著增高(P<0.01),而扩张压力为80 mm Hg时,两组AWR评分和EMG幅度均无明显差异(P>0.05)(图1)。表明新生幼鼠给予CRD,成年后内脏敏感性明显增强。
二、组织形态学
HE染色显示模型组和假手术组大鼠直肠黏膜均未见明显病理变化。黏膜下层结构完整,周围间质无明显水肿、无中性粒细胞、单核细胞等炎性细胞浸润,无纤维结缔组织增生(图2)。
三、小脑FN注射Glu对大鼠内脏敏感性的影响

*与假手术组比较,P<0.01
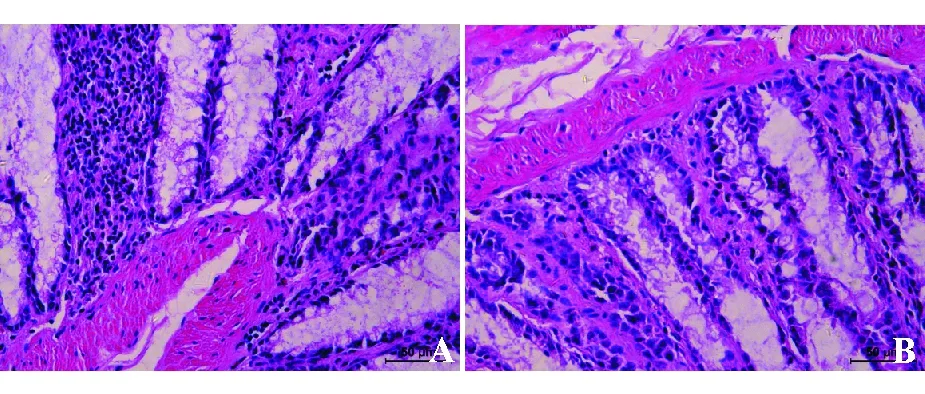
A:模型组;B:假手术组
图2模型组和假手术组大鼠组织形态学比较(HE染色,×400)
注射前,CRD组、溶剂组以及3、6、12 μg Glu组痛阈、AWR评分、EMG幅度相比均无明显差异(P>0.05)。注射后,3、6、12 μg Glu组痛阈较CRD组显著升高(P<0.05),AWR评分、EMG幅度显著降低(P<0.05)。与注射前相比,Glu可呈剂量依赖性地升高痛阈、降低AWR评分和EMG幅度(P<0.05)(图3)。
四、小脑FN注射3-MPA+Glu对大鼠内脏敏感性的影响
与12 μg Glu组相比,3-MPA+Glu组痛阈显著降低(P<0.05),AWR评分和EMG幅度显著升高(P<0.05)(图4)。
五、LHA注射Bic对大鼠内脏敏感性的影响
与12 μg Glu组相比,Bic+Glu组痛阈显著降低(P<0.05),AWR评分和EMG幅度显著升高(P<0.05)。Bic+Glu组痛阈、AWR评分、EMG幅度与CRD组相比均无明显差异(P>0.05)(图5)。
六、大鼠MDA含量和SOD活性
与CRD组相比,3、6、12 μg Glu组MDA含量显著降低(P<0.05),SOD活性显著升高(P<0.05),且呈剂量依赖性(P<0.05);而3-MPA+Glu组、Bic+Glu组与CRD组相比无明显差异。与12 μg Glu组相比,3-MPA+Glu组、Bic+Glu组MDA含量显著升高(P<0.05),SOD活性显著降低(P<0.05)(图6)。
*与注射前和CRD组比较,P<0.05;#与3 μg Glu组比较,P<0.05;△与6 μg Glu组比较,P<0.05

*与注射前和CRD组比较,P<0.05;#与12 μg Glu组比较,P<0.05
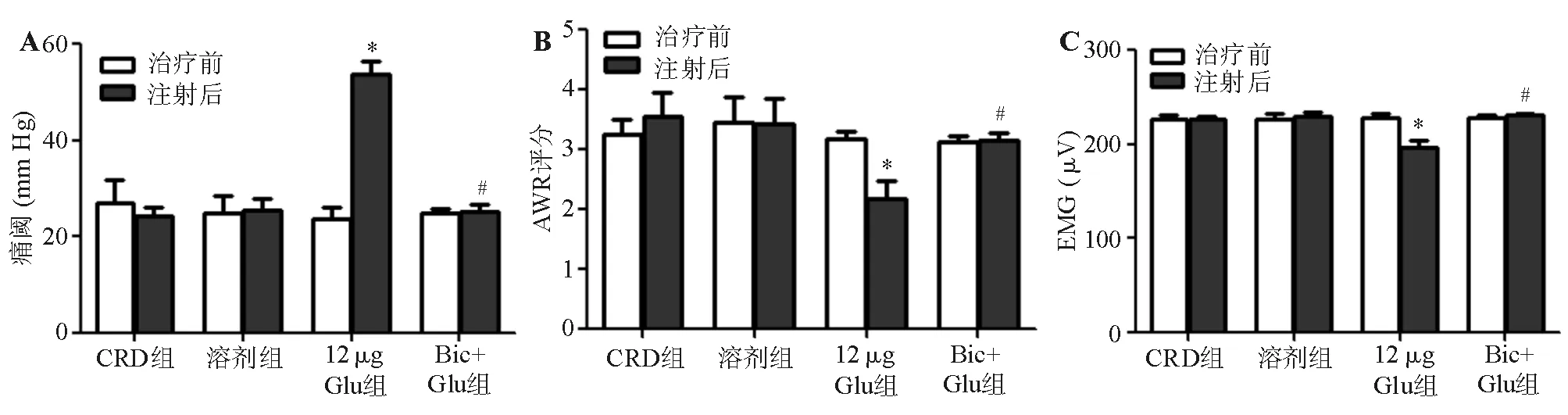
*与注射前和CRD组比较,P<0.05;#与12 μg Glu组比较,P<0.05
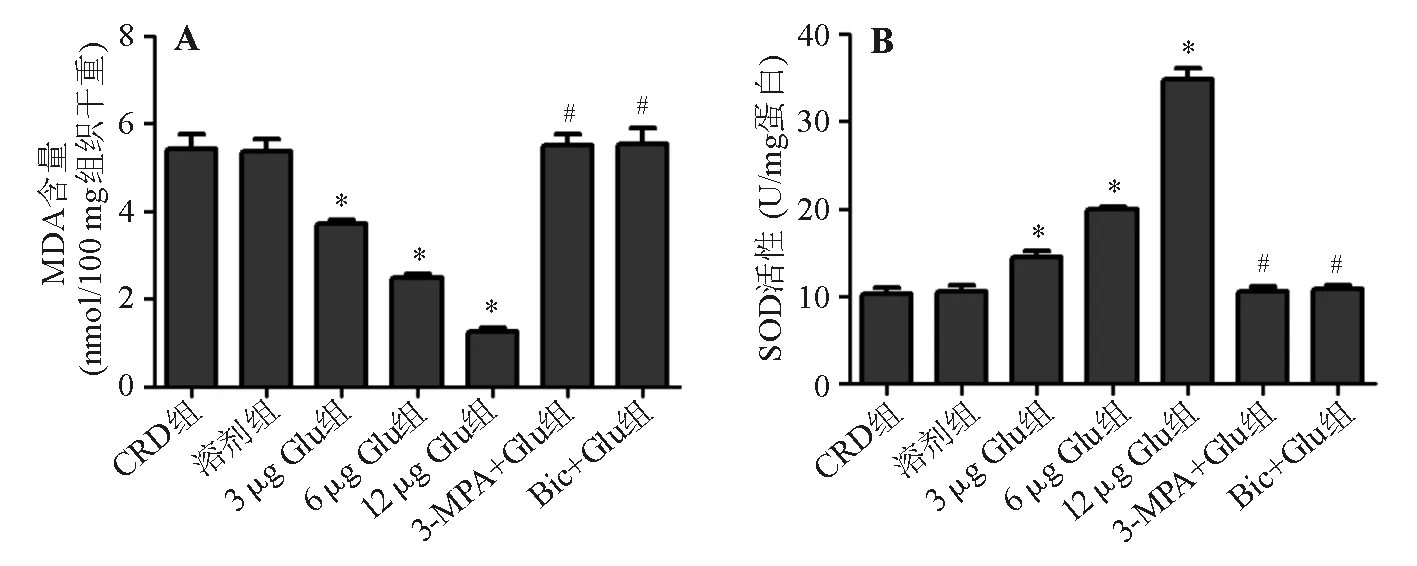
*与CRD组比较,P<0.05;#与12 μg Glu组比较,P<0.05
讨 论
IBS的发病率呈增高趋势,且发病机制复杂,其中慢性内脏高敏感作为IBS的特征性病理生理改变已被广泛认可。
研究表明,哺乳动物脑发育存在“脑生长发育突发期”[7],大鼠为出生后11 d左右。若在此时受到反复机械性或化学性刺激,容易对大鼠大脑产生永久的结构或功能变化[8]。本实验参照Al-Chaer等[5]的CRD制备慢性内脏高敏感大鼠模型的方法并作相应改进,选择在大鼠出生后第8、10和12天,在固定时间给予结直肠球囊扩张刺激1 min,每天2次,共6次。成年后发现,与假手术组相比,模型组大鼠痛阈降低,AWR评分和EMG幅度增高,且所有大鼠结肠组织未见明显病理变化。表明有效复制了IBS样内脏高敏感大鼠模型。
目前认为脑-肠轴与IBS的发病关系密切。研究发现,下丘脑室旁核、中脑腹侧被盖区等核团参与了大鼠慢性内脏痛的调节[9-10],而近年神经解剖学、行为学、功能性脑成像研究以及对小脑占位性病变患者的临床研究进一步加深了小脑在非躯体调节中作用的认识。本课题组以往研究[11-12]通过向小脑FN注射GABAA受体激动剂和拮抗剂,发现小脑FN通过GABAA受体参与了大鼠急性胃黏膜损伤。本研究中,CRD大鼠小脑FN注射不同剂量Glu,在一定刺激压力(40 mm Hg)下,可明显降低大鼠内脏敏感性,并呈剂量依赖性。说明FN可能通过Glu参与对慢性内脏高敏感的调节,起有一定的镇痛作用。
Glu在脑组织中的含量很高,属兴奋性神经递质。GABA则属于抑制性神经递质,因其不能透过血脑屏障,故脑组织中的GABA均由Glu经谷氨酸脱羧酶脱羧而生成。本实验中,在小脑FN注射Glu前先注射谷氨酸脱羧酶抑制剂3-MPA,可抑制Glu的镇痛作用。说明Glu并非直接调控痛觉的敏感性,而是通过谷氨酸脱羧酶生成的GABA来发挥调控内脏敏感性的作用。
然而迄今小脑参与非躯体性活动的机制尚未完全阐明。越来越多的证据表明,小脑-下丘脑之间存在双向、直接的神经纤维投射,即小脑-下丘脑投射(cerebellohypothalamic projection)和下丘脑-小脑投射(hypothalamocerebellar projection),两者构成了小脑-下丘脑神经环路。小脑-下丘脑的投射纤维起源于小脑的三个深部核团(FN、间位核和齿状核)的神经元,经小脑上脚上行投射至LHA、背内侧核、腹内侧核、室旁核等重要核团[13]。近年神经解剖学研究证明了小脑FN神经元的轴突主要投射至LHA,进一步证明了其投射路径和部位[14]。推测可能是小脑参与内脏活动调节的解剖学基础。
小脑FN内存在大量GABA能神经元[15]。资料表明,LHA和室旁核神经元胞膜上同时存在GABAA和GABAB受体及其亚型[16-17]。鉴于上述研究,本实验通过LHA注射GABAA受体拮抗剂Bic后再向小脑FN注射Glu,结果显示痛阈、AWR评分、EMG幅度与CRD组均无明显差异,说明Glu未能发挥对内脏敏感性的调控作用。由此可见,小脑FN注射Glu后,慢性内脏高敏感大鼠敏感性的改善可能是主要由小脑FN的Glu在谷氨酸脱羧酶作用下转化为GABA,然后通过小脑-下丘脑神经环路,与LHA的GABAA受体结合来发挥镇痛作用的。
MDA是反映氧自由基介导的脂质过氧化的间接指标。SOD是生物体内重要的抗氧化酶,是生物体内清除自由基的首要物质,其活性被认为是一种评估抗氧化能力直接的指标。本实验中,Glu组SOD活性较CRD组升高、MDA含量降低,表明小脑FN注射Glu可增强结直肠组织的抗氧化能力和组织抗损伤的效应。
综上所述,小脑FN参与了对大鼠内脏痛觉的调控,注射Glu可明显减轻大鼠内脏敏感性,其机制可能是通过化学刺激小脑FN,使FN神经元兴奋,神经元合成和释放抑制性神经递质GABA增多,GABA通过小脑-下丘脑神经环路作用于LHA神经元胞膜上的GABAA受体,使LHA神经元发生抑制性效应,导致下传神经冲动减少,自主神经兴奋性减低,使肠黏膜细胞分泌的保护性物质增多,损伤因素减少,增强了肠黏膜组织的抗损伤能力,从而起镇痛的作用。但结论仍需行进一步研究证实。

