高压氧预处理对大鼠脑出血后炎症反应的影响
施振华, 裘五四,程 军, 姜启周, 秦智勇
(1.杭州师范大学附属医院 神经外科,浙江 杭州310015;2. 复旦大学附属华山医院 神经外科,上海210040)
高压氧预处理(hyperbaric oxygen preconditioning, HBOP)是指在机体受到损伤前预先给予高压氧处理。HBOP与其他预处理方式如缺血、缺氧等预适应相仿,能诱导对心脏、肝脏、脑、脊髓等器官的缺血再灌注损伤耐受[1]。研究发现[2-3],HBOP同样能减轻大鼠脑出血(intracranial hemorrhage, ICH)后脑水肿,对诱导ICH后的脑损伤耐受,但其机理未完全阐明。ICH 后脑水肿形成早期主要与凝血酶相关,后期(ICH 72 h后)主要与血红蛋白及其降解产物(如铁离子等毒性产物)对周围组织的继发性损伤(如炎症反应)相关[4-5]。本研究通过观察HBOP对大鼠ICH后血清白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(interleukin-6, IL-6)含量及血肿周围炎症细胞浸润的影响,进一步探讨HBOP诱导脑损伤耐受的机理。
1 材料与方法
1.1实验动物及分组选用雄性Spradgue-Dawley大鼠72 只,体重280~320 g,由杭州师范大学实验动物中心提供。将大鼠随机分为HBOP组和对照组各36 只,HBOP组给予高压氧预处理,对照组给予假预处理。最后一次预处理结束24 h后,采用自体动脉血脑内注射法[3]建立ICH模型。
1.2主要试剂与仪器DWC150/300型动物实验用高压氧舱购自上海七零一所杨园高压氧舱有限公司,ALC-H型实验动物立体定向仪购自上海奥尔科特生物技术有限公司, ALC-H型微量注射泵购自上海奥尔科特生物技术有限公司,Finesse ME+型石蜡切片机购自赛默飞世尔 ,TD-5型离心沉淀机购自成都一科仪器设备有限公司,AMR-100型全自动酶标仪购自杭州奥盛;IL-1β、IL-6检测试剂盒购自武汉博士德生物,医用氧气购自海天气体,1%戊巴比妥钠、1%PBS液、4 %多聚甲醛溶液购自上海国药集团化学试剂公司。
1.3高压氧预处理与假预处理 HBOP组大鼠连续5 d每日置入高压氧舱内,以医用纯氧作气源(通过调节进出口气流量维持实验舱内氧体积分数99%以上)匀速缓慢加压至3个绝对大气压后维持氧舱内压力平稳,持续1 h后均匀缓慢降压至1个绝对大气压。对照组大鼠连续5 d每日置入高压氧舱内,但只暴露于1个绝对大气压的空气中,每次暴露时间同HBOP组。
1.4ICH模型建立1%戊巴比妥钠腹腔注射麻醉大鼠(40 mg/kg)后,大鼠头部固定于动物立体定向仪上。头部及股部常规备皮、消毒,切开皮肤后局部分离直至暴露右侧股动脉,置入静脉留置针以备用。头皮正中切开以暴露大鼠右侧冠状缝,使用针头钻孔备用,位置为距中线旁开约3.5 mm处的冠状缝上。用微量注射器在大鼠股动脉留置针处快速取自体动脉血100 μL,连接针头后自颅骨钻孔处垂直进针,深度为自硬脑膜起5.5 mm,用微量注射泵在10 min内匀速注入。注射结束后稍留针头片刻后小心缓慢退针,随后封闭颅骨孔,缝合头皮。
1.5神经功能评分在ICH模型建立后24 h、48 h、72 h各时间点,采用前肢放置试验[2]判断大鼠神经功能缺损的程度,每次正确放置记1分,放置试验共观察10次。
1.6IL-1β、IL-6含量测定ICH模型建立后72 h,大鼠尾取血,采用双抗体酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)测定血清IL-1β、IL-6含量,具体步骤按照试剂盒说明书进行。
1.7HE染色及病理学观察ICH模型建立后72 h,大鼠腹腔注射1%戊巴比妥钠麻醉(55 mg/kg),常规开胸后自大鼠左心室灌注1 %PBS缓冲液直至右心房流出清亮液体,再灌注4 %多聚甲醛,灌注完毕后断头,使用咬骨钳小心剥离大鼠颅骨后取脑,使用4 %多聚甲醛溶液固定脑组织,常规脱水后石蜡包埋,4 μm层厚切片,常规HE染色后400倍光学显微镜下观察病理改变。
1.8统计学分析采用Stata 7.0统计软件,计量数据以均数±标准差表示,组间比较采用成组设计资料的t检验,P<0.05为差异有统计学意义。
2 结果
2.1神经功能评分大鼠ICH模型建立24 h后两组神经功能评分比较差异无统计学意义(P>0.05);建模48 h、72 h后的HBOP组大鼠神经功能评分均高于对照组,差异有统计学意义(P<0.05),见图1。
2.2IL-1β、IL-6含量ICH建模后72 h,HBOP组大鼠尾静脉血清IL-1β含量(7.59±1.96 pg/mL)低于对照组(13.38±3.87 pg/mL),差异有统计学意义(P<0.05);HBOP组大鼠尾静脉血清IL-6含量(75.78±6.4 pg/mL)低于对照组(148.69±26.8 pg/mL),差异有统计学意义(P<0.05)。
2.3HE染色结果HE染色结果显示,对照组大鼠ICH建模后72 h血肿周围细胞肿胀肥大,其周围边界模糊,HBOP组大鼠ICH建模后72 h后血肿周围细胞肿胀轻,边界相对较清晰,炎症细胞浸润范围轻于对照组,见图2。
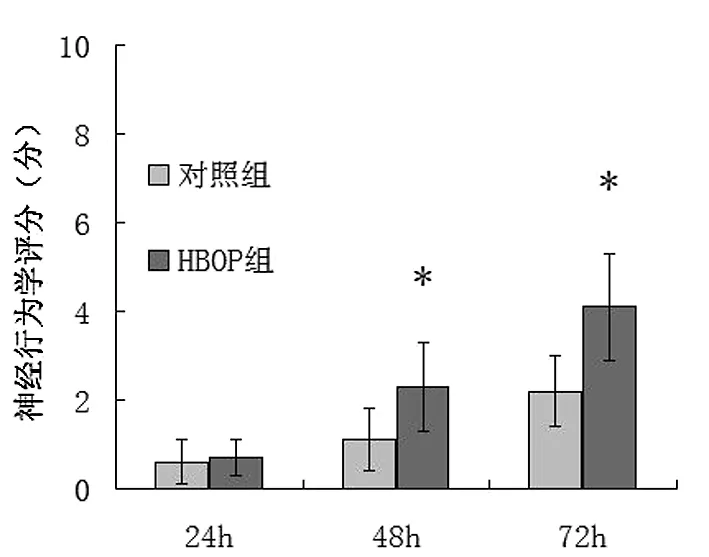
与对照组比较,*P<0.05。图1 两组大鼠前肢放置试验评分
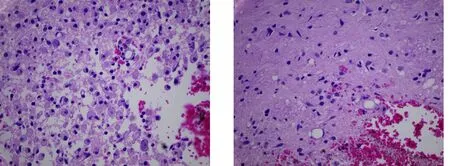
对照组 HBOP组图2 大鼠右侧基底血肿周围脑组织HE染色图(×400)
3 讨论
Wada等[6]首先报道了HBOP诱导的缺血损伤耐受现象,连续5次高压氧预处理(2个绝对大气压,100%氧气,每天1次,连续5 d)能显著减轻沙鼠脑缺血后的脑损伤效应。此后多位学者研究表明HBOP能显著减轻大鼠脑缺血后损伤灶周围的炎症反应及细胞凋亡[1,7-8]。为明确在HBOP诱导的缺血损伤耐受效应中起关键作用的是高压还是高氧亦或是两者均有作用,Dong等[9]比较了HBOP及单纯高压预处理对家兔脊髓缺血损伤的作用,发现HBOP(即高压及氧联合)而并非单纯高压诱导了缺血损伤耐受效应。Qin等[2]研究发现,HBOP同样能诱导对大鼠ICH后的脑损伤耐受。课题组前期研究也发现HBOP能显著减轻大鼠ICH后脑水肿及血脑屏障破坏,但其机理仍未完全阐明[10]。本研究通过建立大鼠基底节ICH模型观察HBOP对大鼠ICH后炎症反应的影响,探讨HBOP诱导ICH后对神经保护的机制。
ICH的死亡率及致残率极高[11],ICH后的继发性脑损害如脑水肿是影响其预后的重要因素[12]。ICH后的炎症反应显著加重了ICH后的继发性脑损害效应[5]。ICH后炎症反应过程是一个复杂的病理生理过程,ICH后期(72 h以后),血红蛋白及其降解产物(如铁离子等)的毒性作用以及其诱导的炎症反应是脑水肿形成过程的重要因素[4],IL-1β是IL-1的一种存在形式,它在炎症反应中起着多重作用[5,13-14]。研究表明[5],IL-1β能刺激粘附分子的表达,增加白细胞在内皮细胞的粘附,使白细胞聚集在出血灶周围,并促使内皮细胞激活血液中的凝血酶原的毒性作用,增加白细胞的聚集,从而加重继发性脑损伤及神经细胞凋亡,同时IL-1β又能激活巨噬细胞和星形细胞诱导神经细胞凋亡。Holmin等[15]发现大鼠脑内注入微量的IL-1β即可诱导短暂的炎症反应并出现神经凋亡细胞。IL-6是由单核巨噬细胞产生的一种具有多种生物学效应的重要致炎细胞因子,对中枢神经系统发挥多重作用[5,16]。IL-6既有促炎又有抗炎作用,高浓度的IL-6增加粘附分子在内皮细胞的表达,促使白细胞在血管内皮细胞粘附,加重ICH后的脑损伤[5]。本研究结果显示,HBOP明显下调了大鼠ICH建模后72 h血清IL-1β及IL-6的含量,减少了血肿周围炎症细胞浸润程度,推测ICH后单核-巨噬细胞的浸润、小胶质细胞的激活,诱导分泌多种细胞因子如IL-1β及IL-6,引起神经炎症反应,从而加重了继发性脑损伤;HBOP能减轻炎症细胞的浸润,下调炎症因子的表达,减轻ICH后继发性脑损伤,改善神经功能缺损。另外,本研究并未就血肿周围的炎症细胞种类进行对比,还有待于进一步研究。
综上,HBOP可改善大鼠ICH后神经炎症反应,可能是HBOP减轻大鼠ICH后继发性脑损伤的机制之一。HBOP预处理方式相对安全、无创,给神经外科病人如何预防及减少术后继发性脑损伤提供了新的思路。

