基于不同剂量工具实施患者个体化调强验证的评价研究*
杨 涛 曲宝林 徐寿平* 戴相昆 解传滨 丛小虎 王小深 王金媛 龚 璇
调强放射治疗(intensity modulated radiation therapy,IMRT)现已广泛地应用于临床,其在提高靶区剂量的同时更好地保护了危及器官,极大地降低了放射治疗不良反应。然而,由于调强技术复杂程度的增加,先进放射治疗设备的涌现,计划难度的加大,高适形度剂量分布的要求及剂量模式的改变等,都增加了放射治疗继发效应所带来的风险。因此,必须要对患者行个体化调强验证,提前监测和纠正计划执行过程中可能出现的错误,确保剂量传递的精确性。
美国放射学院(The American College of Radiology,ACR)-美国放射肿瘤学会(American Society for Radiation Oncology,ASTRO)实践指南中规定:“剂量传递的精确性应该通过在模体上照射被记录,同时经标准的剂量系统来验证传递剂量与计划剂量的一致性”[1]。患者个体化质量控制是临床治疗中的重要组成部分,同设备质量控制是两个相互平行的过程,包括治疗前计划验证和治疗中在体剂量验证[2-4]。治疗前计划验证一般采用患者计划束流射野信息创建患者模体计划,通过点剂量、平面剂量或合成剂量验证技术对患者计划实施验证;治疗中在体剂量验证包括体表或者腔内的探测器验证,加速器机头出射线的验证,基于加速器日志文件以及基于电子射野影像装置(electronic portal imaging device,EPID)患者出射线的剂量验证等,可以发现由患者摆位、剂量传递、机器故障及患者解剖结构改变等方面原因导致的剂量偏差,来避免一些重大的医疗过失[5-6]。目前可用来实施患者个体化质量控制剂量工具很多,包括电离室、胶片、矩阵探测器、EPID和加速器日志文件等,然而,在测量方式、分析方法、接受标准以及感兴趣区的选择上各不相同[7-10]。本研究旨在通过3种不同的硬件及软件工具对患者实施个体化调强验证,分析评价其初步的临床结果,对治疗中在体剂量验证进行初步探讨,为临床工作提供一定的依据和选择。
1 材料与方法
1.1 硬件工具
(1)Cheese模体和A1SL型电离室。Cheese模体(Standard Imaging,U.S)是Tomotherapy自带的验证模体,圆柱形材质均匀的等效水模体,直径为30 cm,长度为18 cm。模体上有32个电离室空腔和20个密度棒插孔,均匀的分布在6.5 cm到11 cm的半径区域。A1SL型电离室(Standard Imaging,U.S)灵敏体积为0.056 cm3,内径为2 mm,外径为4 mm,采用TomoElectrometer剂量仪进行剂量测量。
(2)电子射野影像装置(electronic portal imaging device,EPID)。Varian aS1000 EPID非晶硅平板探测器有效探测面积为40 cm(Xaxis)×30 cm(Yaxis),有效探测像素点为1024×768,分辨率为0.392 mm;移动范围在源到探测器平面距离(source detector distance,SDD)95~180 cm高度;每个探测像素点包含一个非晶硅二极管和一个薄膜晶体管转换器,这种探测器提供了更大面积,更高分辨率的影像测量工具。图像采集过程通过Varian自带特定软件成像采集系统3(imaging acquisition system 3,IAS3)进行数据管理,并连入Varian ARIA放射治疗网络系统进行图像的存储和传输。为了使EPID对照射剂量的反应性一致,必须消除本底噪声的影响,需要对EPID进行暗野(dark field,DF)校准、泛野(flood field,FF)校准以及绝对剂量标定。绝对剂量标定要求在不同的剂量率条件下,6 MV的X射线,源到探测器SDD为100 cm,设置标准射野10 cm×10 cm,出束100 MU,把EPID的校准信号转化为计数单位(count unit,CU)的EPID校准单位,标定1 MU=1 CU。
(3)ArcCheck探测器(Sun Nuclear Corp.,Melbourne,U.S)。该探测工具为圆柱形模体,直径21 cm,长21 cm,包含1386个半导体探头探测器,呈螺旋排列,探测器深度为2.9 cm,探测器间距为10 mm,每个探测器的有效测量面积为0.64 mm。ArcCheck是通过圆柱形模体内的多个半导体进行射野剂量测量,其测量得到的是二维曲面的剂量分布。在执行患者剂量验证之前,根据厂家提供的校准方法和步骤,对ArcCheck进行本底、矩阵以及绝对剂量的校准。
1.2 软件工具
(1)EPIbeam/EPIgray(DOSIsoft S.A.,France)。EPIbeam和EPIgray都是基于EPID的放射治疗质量控制系统,前者用于治疗前患者计划验证;后者用于治疗中患者剂量验证。EPIbeam原则上是比较两幅绝对剂量分布图像,一幅图像SDD为100 cm时,执行患者治疗计划空照EPID得到的实际电子射野影像(electronic portal image,EPI);另一幅图像是通过计算接受到的放射治疗计划(radiotherapy plan,RT-plan)得到同等条件下的理论射野影像,将两幅EPI转换成水下5 cm深度处的二维平面剂量后比较两者的剂量差异。EPIgray是通过接收治疗过程中EPID实时采集的透射过患者的射野影像,采用基于限定组织最大比(finite tissue maximum ratio,FTMR)的方法重建患者体内感兴趣点的剂量,与计划剂量进行比较后得到相对偏差,默认的阈值为±6.7%[11]。在VMAT治疗技术中采用连续的图像采集模式,SDD等于150 cm。
(2)MobuisFX(Mobius Medical Systems,U.S)。MobuisFX主要通过提取加速器执行计划产生的日志文件(logfiles),基于原始CT影像,利用倒锥卷积/叠加算法(CCC/S)进行反推计算,重建出患者体内3D剂量分布,从而得到剂量体积直方图(dose-volume histogram,DVH)、剂量分布和3D Gamma通过率,其采样频率达100次/s。对于Varian直线加速器,在执行计划时产生的参数都会被写入多叶准直器(multi-leaf collimator,MLC)的日志文件,每50 ms记录1次,包含出束状态、准直器和机架角度、铅门的位置、叶片位置等信息。
(3)SNCPatient/3DVH(Sun Nuclear Corp.Melbourne,U.S)。SNCPatient和3D VH均为基于ArcCheck进行患者个体化质量控制的软件工具,分别用于治疗前的二维剂量验证和三维剂量验证。SNCPatient软件通过将同一患者的计划剂量与测量剂量进行Gamma比对分析,得到2D Gamma通过率;3DVH软件利用计划剂量扰动算法(planned dose perturbation,PDP)将计算得到的计划剂量与测量剂量之间偏差量反投影到原始的治疗计划中,从而得到一个校正过的、新的三维剂量分布、DVH以及3D Gamma通过率。
1.3 计划设计与施照方式
随机选取12例即将在解放军总医院放射治疗科行放射治疗的胸腹部肿瘤患者影像,均采用Varian Eclipse(Ver10.0)治疗计划系统(treatment planning system,TPS),严格按照医生的剂量要求设计容积旋转调强放射治疗(volumetric modulated arc therapy,VMAT)计划,并经主管物理师与医生审核,可用于患者治疗。然后将患者VMAT计划分别移植到ArcCheck和Cheese模体的CT影像上,生成验证计划,前者用于治疗前计划验证,后者用于射野中心点剂量测量。其中,Cheese模体中心插有A1SL型电离室,并在CT影像上勾画出电离室灵敏体积区域,命名“chamber”。
所有计划采用Varian Clinac iX加速器实施RapidArc技术的照射,该设备配备aS1000 EPID,Millennium 120片MLC,6 MV的X射线,标定最大剂量率600 MU/min,机架角度控制均利用每2°控制点模式,最大控制点数177个。Eclipse计划系统剂量计算采用各向异性解析算法(analytical anisotropic algorithm,AAA),计算网格为2 mm。
1.4 质量控制方式与数据采集
(1)射野中心绝对剂量验证。执行移植在Cheese模体上的验证计划,用电离室测量出数过程中射野中心点的剂量;用EPID实时采集出束过程中透过Cheese模体的射野影像,并传至EPIgray,然后自动重建出计划射野中心点的剂量;用MobiusFX采集计划执行过程中产生的日志文件,重建三维剂量,读取“chamber”区域的平均剂量,将其视为射野中心点的剂量。比较以上3种验证方式与在TPS中读取的射野中心点剂量的差异。
(2)治疗前患者计划验证。在QA模式下执行患者计划,先后利用EPID和ArcCheck进行数据的采集,分别相应地使用EPIbeam和SNCPatient软件对采集的数据给予2D Gamma分析,与此同时用MobiusFX分析实时的日志文件,并与3DVH分别进行3D Gamma分析。所有Gamma分析均选择剂量误差(dose difference,DD)为3%,吻合协议距离(distance to agreement,DTA)为3 mm,阈值为10%的剂量标准。
(3)治疗中在体剂量验证。在患者初次治疗过程中,应用EPID采集射野剂量信息,并同时记录治疗的日志文件,分别相应地运用EPIgray和MobiusFX进行患者感兴趣点剂量与3D剂量的重建,分析其剂量偏差与3D Gamma通过率。EPIgray设定的剂量相对偏差阈值为±6.7%。Gamma通过率均采用3 mm/3%,阈值为10%的标准进行定量的比对分析。
1.5 统计学方法
采用SPSS19.0统计软件进行分析,数据结果以均值±标准差表示,组间比较采用配对t检验,以P<0.05为差异有统计学意义。
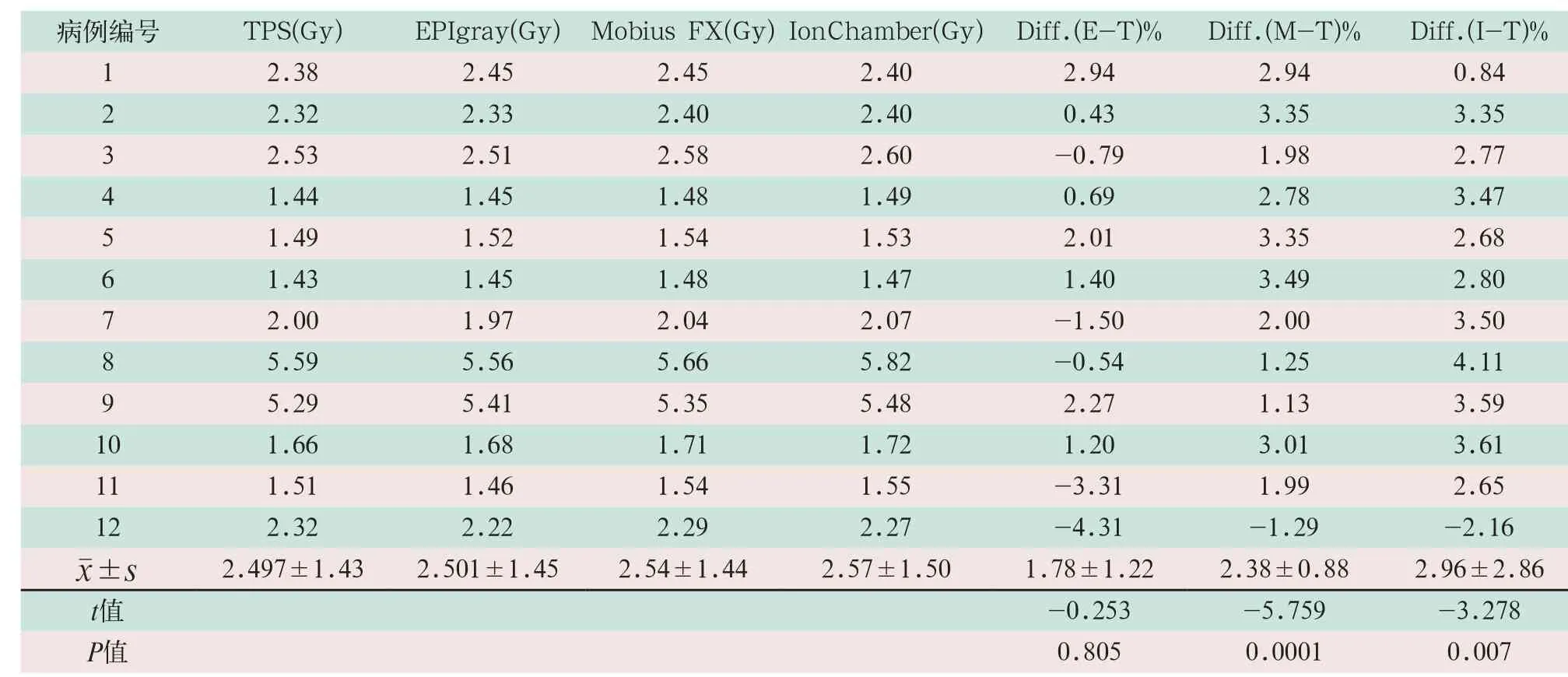
表1 三种不同验证工具所测的射野中心点剂量与计划剂量比较
2 结果
2.1 绝对剂量验证结果比较
对12例胸腹部肿瘤患者行VMAT计划,基于EPID-EPIgray、logfiles-MobiusFX和A1SL型电离室3种不同验证工具所测的射野中心点剂量结果显示:TPS中读取的射野中心点剂量的平均值为(2.497±1.43)Gy;EPIgray、MobiusFX和A1SL型电离室所测量的射野中心点剂量的平均值分别为(2.501±1.45)Gy、(2.54±1.44)Gy和(2.57±1.50)Gy;3种不同的验证工具所测的射野中心点剂量与TPS的平均相对偏差分别为(1.78±1.22)%、(2.38±0.88)%和(2.96±0.86)%,且MobiusFX与TPS相比,差异有统计学意义(t=-5.759,P<0.05);电离室与TPS相比,差异有统计学意义(t=-3.278,P<0.05),但偏差均在5%的标准范围内。其中相对偏差Diff.%=(测量剂量-计划剂量)÷计划剂量×100%,见表1。
2.2 治疗前患者计划验证结果比较
基于ArcCheck-SNCPatient、EPID-EPIbeam所测的12例患者VMAT计划平均的2D Gamma通过率分别为(98.15±1.73)%和(98.20±2.16)%,EPIbeam略优于SNCPatient,但差异无统计学意义(t=-0.078,P>0.05);基于logfiles-MobiusFX、ArcCheck-3DVH所测的3D Gamma通过率分别为(98.12±1.36)%和(99.16±1.81)%,3DVH略优于MobuisFX,但差异无统计学意义,见表2。
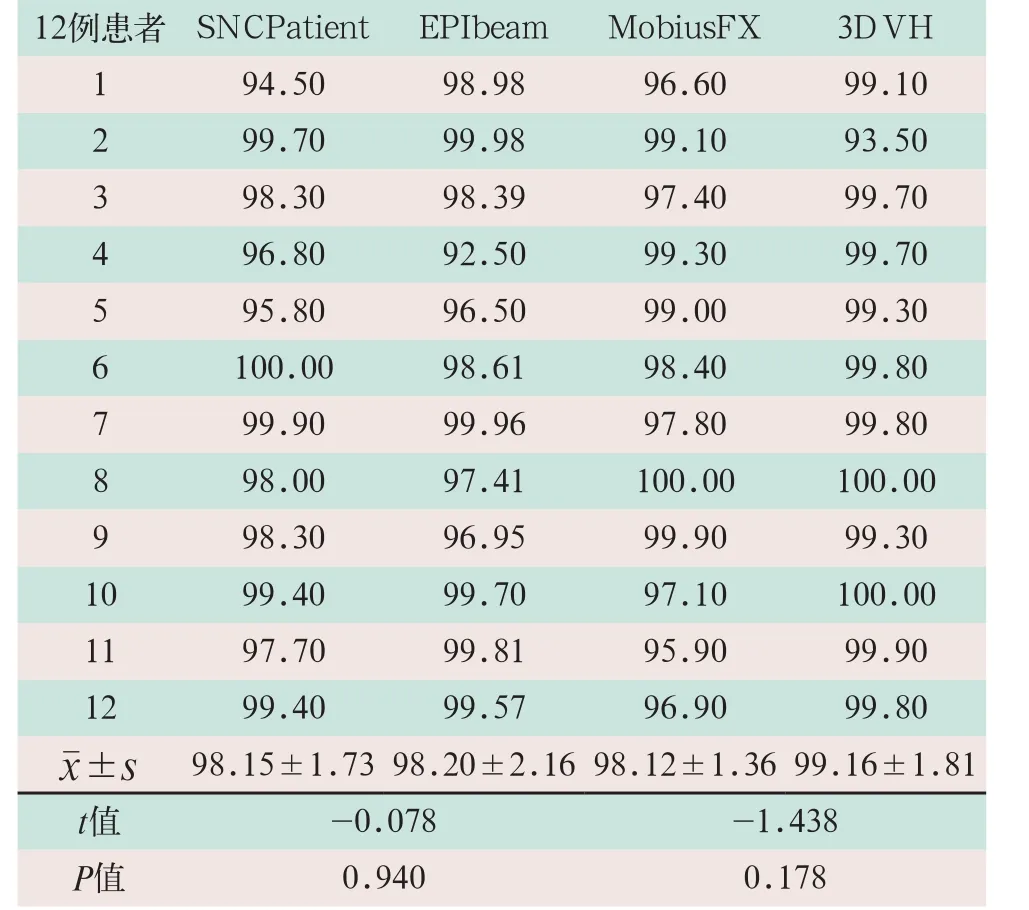
表2 治疗前计划验证中不同验证工具Gamma通过率结果比较(%)
2.3 治疗中在体剂量验证结果比较
通过EPIgray所测的首次治疗过程中射野中心点剂量的平均偏差为(-2.4±1.48)%;MobiusFX所测在体的3D Gamma通过率为(97.73±1.95)%,见表3。
3 讨论
从绝对剂量验证结果可以看出,基于EPIDEPIgray、logfiles-MobiusFX以及A1SL型电离室3种验证方式所测的射野中心点剂量总体略高于TPS中读取的剂量,3种验证方式与TPS所读射野中心点剂量的相对偏差均≤5%,其中EPIgray重建的射野中心剂量更接近于TPS,一致性较好,与TPS之间平均相对偏差要略小于MobiusFX和A1SL型电离室。电离室与MobiusFX相对TPS所体现的较高差异,一致性较差,可能与测量点的位置或测量区域剂量的均匀性有关。由于电离室灵敏体积的平均效应,电离室受到空间响应体积的限制只能得到测量点的平均剂量,当测量点周围剂量不均匀时,测量结果可能与测量点的实际剂量有显著差别。同样,由于MobiusFX是读取的“chamber”区域的平均剂量作为射野中心的点剂量,因此MobiusFX与电离室的测量结果相差不大。

表3 患者首次治疗中在体剂量验证EPIgray和 MobiusFX的测量结果(%)
采用ArcCheck、EPID、logfiles及其配套的软件均能很好地实现治疗前患者的计划验证,满足临床的实际需求。治疗前患者计划验证结果显示,2D和3D的平均Gamma通过率均在98%以上,体现了较好的一致性,但Gamma通过率与临床剂量指标相关性较低[12]。基于EPID和ArcCheck的2D Gamma通过率分析预测能力不足,缺少空间信息,不能测量和分析患者靶区或危及器官实际剂量差异,不便于查找和分析造成剂量差异的具体原因。ArcCheck是临床最常用的一种患者个体化剂量验证工具,简单且易操作,是IMRT、VMAT和Tomotherapy等技术较为理想的验证工具之一,更为重要的是可实现2D和(或)3D患者计划的验证。然而,对于小靶区而言不能提供足够的精度,浅表肿瘤无法直接测量。3DVH软件使得ArcCheck进行离线的3D剂量验证成为了可能,Olch等[13]应用电离室和EBT2胶片,Watanabe等[14]应用BANG3聚合体凝胶剂量计均对其精确性做了验证。本研究应用ArcCheck-3DVH系统对患者的3D Gamma通过率进行了验证分析,得到了与其他验证工具相似的结果,同样具有较高的Gamma通过率。
相比3DVH,MobiusFX具有更高的灵活性,既能进行治疗前离线的患者剂量验证也能实现治疗中在体的剂量验证,自动调取执行计划的日志文件进行剂量的重建及验证。基于加速器logfiles进行体内三维剂量重建的剂量验证方法,是对加速器执行结果的反馈实施剂量重建,无需胶片、电离室等剂量接收装置。日志文件记录信息的准确与否对结果也会有较大的影响。Li等[15]验证了加速器logfiles的准确性,在不考虑加速器校准误差情况下,利用logfiles重建的计划与原计划相差很小,表明了加速器执行计划的精准性。但实际治疗中计划执行结果的好坏不但取决于加速器实施过程的准确性,还取决于加速器各项参数校准的准确性,如机架角度、MLC叶片位置及到位精度、剂量校准的准确性,只有将这些因素都合适的考虑进去,得出的重建剂量才能更接近实际剂量。本研究表2和表3显示,同一患者利用MobiusFX离线与在体的剂量验证通过率差别不大,表明加速器在2次执行计划时的状态及精确性较好。第10例患者离线(97.10%)和在体(93.50%)的Gamma通过率偏差比较大,主要是因为在治疗过程中MLC的叶片出现了卡位所造成。MobiusFX可实时监测治疗过程机器的状态,并重建患者体内三维剂量分布,但无法监测患者实际受量,对因摆位误差、体轮廓和(或)解剖结构变化、空腔存在等所致剂量分布的变化无能为力。因为logfiles只反映MLC叶片到位精度、机架角度、准直器角度等信息,不能反映加速器剂量输出以及射线透射过模体的衰减和散射过程,所以在加速器状态稳定的情况下,利用MobiusFX所测得的在体和离线的Gamma通过率应该偏差不大。
EPID因其成像速度快、探测面积大、使用简单便捷、重复性好、分辨率高以及无角度响应等良好的剂量特性[16-18]逐步地应用于MLC质量保证、IMRT以及VMAT的剂量验证等方面,而且逐步地用于在线和实时剂量监测[19-23]。Winkler等[24]和徐寿平等[25]研究结果表明,EPID具有良好的线性和稳定性;且更多的研究结果进一步表明EPID是一种准确而有效的剂量验证工具[26-29]。表2显示,基于EPID-EPIbeam测得Gamma通过率与ArcCheck-SNCPatient之间无统计学差异,且具有较好的一致性,但与ArcCheck-SNCPatient相比,无需摆模体和做验证计划,提高了工作效率。基于EPID和logfiles两种在体三维剂量验证的方式,均可准确地监测到计划执行过程中一些主要的错误,并及时给予警告。与MobiusFX相比,EPIgray在体剂量验证能够重建人体受量,实现对患者实时体位的检测,能较好反映治疗过程中因摆位误差及器官变化等造成的患者受量的影响。Sofia等[30]研究结果表明,EPIgray是一种有效的在体剂量验证工具,能很好地应用于不同放射治疗技术及病种的在体剂量验证。Ricketts等[31]研究发现,EPIgray可以有效地监测因患者摆位所造成的偏差,而且对患者体厚的改变具有适度的敏感性,但是不能可靠地监测<1 cm的体厚变化。
本研究应用EPID-EPIgray系统对12例患者首次治疗进行了在线的剂量监测与射野等中心剂量偏差评估,首次治疗的射野等中心剂量偏差均在预设的±6.7%阈值范围内,且大多数的偏差值都很小,表明计划执行的准确性,以及摆位误差和患者首次治疗时内在器官的位置变化较小。对于治疗中在体的剂量监测,体内感兴趣点的剂量重建受多重因素的影响,包括EPID的校准与机械精度、患者的摆位以及患者在等待治疗及治疗过程中体型、器官及肿瘤大小和位置的变化,默认的阈值可能并不适用患者整个治疗过程,还有待在日后的临床应用及研究中对患者治疗过程中不同时段的剂量偏差或不同的治疗技术和部位的剂量偏差进行分析,从而更合理地确定在线剂量监测的剂量偏差阈值,更好地保证放射治疗的精确性,从而为自适应放射治疗的实施提供剂量层面的指导。
4 结论
无论是治疗前离线还是治疗中在体的患者剂量验证,其在临床上都是一项非常繁重的工作,因此,寻求一种简单、快捷而有效的QA工具是QA发展的趋势。基于不同剂量工具实施患者个体化调强验证的方法已经广泛地用于放射治疗中,本研究所探讨的几种不同的剂量验证工具均能切实有效地实施患者个体化质量控制,提高了患者治疗的安全性。个体化患者调强验证中基于测量验证工具(如ArcCheck等)仍然是高度可靠而有效的手段和方法。此外,软件QA技术将极大地节省临床上QA时间,然而,QA质量及精确性依赖于其功能、算法和软件的成熟度;无论基于硬件还是软件的剂量验证工具,治疗前离线还是治疗中在体的患者剂量验证都将会是互为补充的关系,从而为全面保证患者放射治疗过程中剂量的安全性和准确性提供有力的保障。

