宁波市生猪感染猪链球菌2型的检测和分析
徐 峰,凌淑萍,王全胜,付 岩,吴银良,叶子弘
(1.中国计量大学 生命科学学院 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018; 2.宁波市农业科学研究院,浙江 宁波 315040)
猪链球菌是一种具有严重危害性质的人兽共患病病原体,其中以猪链球菌2型(Streptococcussuistype 2, SS2)的致病性最大,我国把它列为二类动物疫病,严重影响我国养猪业的发展和人及其他动物的健康.研究表明,SS2可引发猪的脑膜炎、心内膜炎、关节炎、肺炎、败血症等,各年龄段的猪均可感染猪链球菌.同时,该菌还可感染养猪相关的从业人员,引起细菌性败血症、休克、脑膜炎、永久性的听力丧失,严重者甚至死亡[1].1968年丹麦学者首次报道了3例感染导致脑膜炎并发败血症病例;1975年荷兰也出现了散发病例;在我国,人感染猪链球菌曾经在江苏省和四川省发生,1998年江苏省发病25例,死亡14例;2005年6月至8月,四川省爆发疫情,发病204例,死亡38例,为国内外迄今为止见于报道的最大规模人感染猪链球菌病疫情[2].截至2000年,全球已报道了200多例,且多发的国家和地区普遍养殖业发达.人感染SS2主要是以猪传染人的方式传播,还未见人传染人的报道.SS2在很多国家受到广泛重视,其研究集中在毒力相关因子(virulence correlated facters, VAFs),研究表明VAFs与猪链球菌引起的病症密切相关[3-4].荚膜多糖(CPS)是目前已确定的猪链球菌2型主要的毒力相关因子,具有抗吞噬的作用[5-6],因其具有很高的种特异性,因此csp2j常被作为检测猪链球菌2型的靶基因[7].研究认为,较为重要的猪链球菌毒力因子还有溶菌酶释放相关蛋白(muramidase-released protein, MRP)和胞外因子(extracellular protein factor, EF).CPS、MRP和EF常用于评价猪链球菌毒力大小.目前检测猪链球菌2型的方法有生化试验、细菌培养、乳胶凝集试验和qPCR等,相比于传统的方法,qPCR方法能够快速、准确、灵敏地检测目的基因,已被广泛的应用于猪链球菌病的检测与诊断[5].
为了解宁波市养猪场、屠宰场和市场上的猪肉携带猪链球菌2型及相关毒力基因的情况,我们对该市的病猪咽喉拭子、死猪扁桃体、屠宰场和鲜肉市场上的样本进行系统检测和分析,以期为有效开展防疫工作提供基础数据和实践支撑.
1 材料与方法
1.1 材料
1.1.1样品来源
2016年3月—12月分别从宁波海曙区一生猪养殖基地采集62份病猪咽喉拭子(有各种病症反应的猪)和65份死猪扁桃体.2015年12月到2016年11月在宁波宁海、北仑、慈溪等地采集屠宰场样品100份(70份猪肉和30份猪肝),在宁波市各超市和菜场采集猪肉样品24份.
1.1.2主要试剂
脑心浸液肉汤、萘啶酮酸、多粘菌素购自青岛海博生物技术有限公司.Ezup柱式细菌基因组DNA提取试剂盒和蛋白酶K购自上海生工,Premix Ex TaqTM试剂盒购自TaKaRa,溶菌酶购自BIOSHARP.猪链球菌2型选择性培养基以心脑浸液为基础,灭菌后冷却到室温并添加萘啶酮酸和多粘菌素至质量浓度分别为30 μg/mL和15 μg/mL.
1.1.3主要仪器
SteponeplusTM定量PCR仪(ABI).
1.2 引物和TaqMan探针
根据GenBank公布的猪链球菌2型菌种鉴定基因cps2j(Accession Number: JX986792.1)、毒力因子基因mrp(Accession Number: X64450.1)、ef(Accession Number: JF813371.1)的参考序列设计引物和探针.探针的5′端分别标记FAM,FAM,HEX;3′端标记BHQ1.使用Beacon Designer 7设计引物,引物和探针均交由Life公司合成.表1为引物和探针序列.

表1 引物和探针序列
1.3 方法
1.3.1样品采集与增菌
将拭子伸入病猪咽喉部涂抹,立即放入注有选择性培养基的无菌拭子管子中,带回实验室并于37 ℃培养过夜.采集猪扁桃体、鲜肉、肝脏等放入无菌样品袋中带回实验室,取一个扁桃体,或10 g其他组织,加入100 mL选择性培养基,拍打均质1 min后,37 ℃培养过夜.
1.3.2模板DNA的制备
吸取经培养的菌液2 mL,按照细菌基因组DNA提取试剂盒所列方法和步骤提取基因组DNA.制备好的模板经过琼脂糖凝胶电泳鉴定后,置于-20 ℃存放备用.
1.3.3荧光定量PCR扩增
PCR扩增反应在Stepone Plus(ABI)上进行,单荧光反应体系(20 μL):Premix Ex TaqTM10 μL,10 μmol/L引物各0.4 μL,probe 0.8 μL,ROX Reference Dye(50×)0.4 μL,DNA模板2 μL,超纯水6.0 μL;双重荧光反应体系(20 μL):Premix Ex TaqTM10 μL,10 μmol/L引物1、引物2各0.4 μl,mrpprobe、efprobe各0.8 μL,ROX Reference Dye(50×)0.4 μL,DNA模板2 μL,超纯水4.4 μL.反应条件:95 ℃ 20 s;95 ℃ 1 s,60 ℃ 20 s,40个循环,在每个循环的60 ℃收集荧光信号.
1.3.4结果判定
阴性对照无Ct值且无扩增曲线,阳性对照的Ct≤30且有特定的扩增曲线,如果阴性对照和阳性对照不满足以上条件则此次实验无效.无Ct值且无扩增曲线判定为阴性;Ct<35且有特定的扩增曲线判定为阳性;35≤Ct≤40判定为疑似,需要复检,复检结果无Ct值且无扩增曲线判定为阴性,Ct≤40且有特定的扩增曲线判定为阳性.
1.3.5统计学分析
统计各个样本毒力因子基因的检出情况,计算检出率.不同来源,不同季度的样本单一毒力因子检出率进行卡方检验,以P<0.05作为有统计学意义的判断标准.
2 结果与分析
2.1 不同样本来源的猪链球菌2型毒力因子调查分析
通过荧光定量PCR技术对采集到的251份宁波市病死猪和健康猪样本进行检测,结果见表2.从表中可知,猪链球菌2型广泛存在于病死猪中.三种毒力因子cps2j、mrp、ef在病猪咽喉拭子中的检出率最高,其次是死猪扁桃体.进入市场销售的屠宰场样品、市场猪肉样品中三种毒力因子的检出率明显低于前两组,市场猪肉样品中的检出率最低.
病猪咽喉拭子样本与死猪扁桃体样本的三个毒力因子cps2j、mrp、ef、高致病性基因型cps2j+mrp+ef+的检出率相关系数高达0.97,说明病猪感染猪链球菌2型和所携带的毒力情况可能是引起生猪死亡的一个重要的因素.同时携带cps2j+mrp+ef+三种毒力因子的高致病性菌株对人畜危害较大,致病风险较大.病猪中携带的猪链球菌2型不仅比例高而且毒性大.高致病性菌株在病猪咽喉拭子的检出率高达40.3%.
病猪样品三种毒力因子的检出率高于死猪样品,可能是样品的新鲜程度影响了检测结果.病猪咽喉拭子样本比死猪扁桃体样本新鲜,菌量比死猪扁桃体高,活性也好,更容易增菌培养.同时,死猪样品放置时间较久,受其他腐生菌的影响,使得目标菌量降低.但也有可能是病猪携带的毒力因子确实比死猪高,这批样品猪的死亡还可能由于其他方面的疾病、暴力因素导致.
在屠宰场和鲜肉市场样品中虽然有检出了猪链球菌2型,但多数不含mrp和ef两个毒力因子,是低风险的菌株.屠宰场样品中仅检出一例cps2j+mrp+ef+高致病性菌株,所占比例为0.8%(1/124).菜市场和超市样品中未检出高毒性菌株.因此市民通过市场途径感染高致病性猪链球菌2型的风险比较小,但也不忽视相关从业人员在生猪屠宰运输销售过程中可能感染的风险.

表2 不同样本来源的猪链球菌2型毒力因子检测结果
2.2 不同采集时间病、死猪样本的猪链球菌2型及毒力因子调查分析
调查发现,猪感染猪链球菌2型具有时节性.cps2j在病、死猪中的检出情况大致相同,在各季度样品中的检出率均表现为第二季度>第一季度>第四季度>第三季度.但高致病性菌株检出率在病、死猪中情况不同.病猪咽喉拭子中,各季度检出率表现为第二季度与第三季度、第三季度与第四季度都有显著性差异;在死猪扁桃体中猪链球菌2型的检出率表现为第一季度与第三季度、第二季度与第三季度有显著性差异(表3、表4).综合病、死猪样品中猪链球菌2型的检出率与毒性大小表现可知,第二季度最容易感染猪链球菌2型,并且毒性较高,而第三季度感染率最低,而且所携带的多数是低毒性菌株.

表3 不同采集时间病猪咽喉拭子样本的猪链球菌2型及毒力因子检测结果

表4 不同采集时间死猪扁桃体样本的猪链球菌2型及毒力因子检测结果
由此可见,春末夏初和冬季是高毒性猪链球菌2型的高发期.春末夏初时节,天气湿热,冷热交替,猪更容易受到各种病毒与细菌的侵害.秋冬季天气寒冷,猪舍温度过低,猪不能有效抵御寒冷,抵抗力降低,寒冷的气候可以一定程度上杀死各种细菌和病毒.
2.3 不同猪龄样本的猪链球菌2型及毒力因子调查分析
日龄≤65 d的猪通常被归为乳猪和保育猪,日龄>65 d为育肥猪.调查发现,保育猪更容易受到高致病性猪链球菌2型的感染而致死.因为猪幼崽在此阶段刚断奶,各项机能尚未完善,自身主动免疫系统还未发育完全,对各种应激的抵抗能力差,极易受到病源微生物的侵袭.
本实验采集了不同日龄的猪样本,结果表明生猪在任何阶段都可能受到猪链球菌2型的感染,但不同日龄之间猪链球菌2型检出率不同(表5).数据表明,在病、死猪样品中,猪链球菌2型在保育猪的样本中检出率略高于育肥猪样本的检出率.毒力分析表明,mrp、ef两个毒力因子在病猪中差异不大,但是在死猪样品中,携带的毒力大小差异较大.mrp+在保育猪中的检出率与育肥猪相比,差异显著,说明死猪中保育猪感染高致病性菌株的情况比育肥猪更为严重.
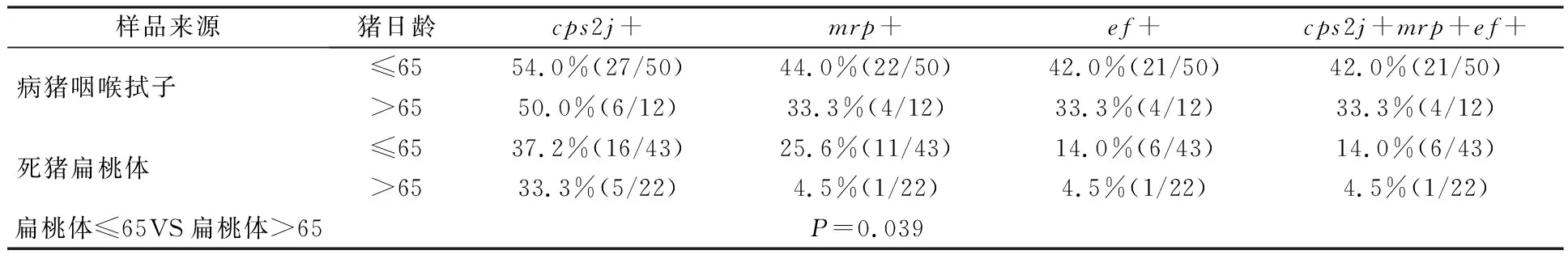
表5 不同猪龄样本的猪链球菌2型及毒力因子检测结果
2.4 屠宰场和市场中猪链球菌2型及毒力因子的调查分析
124份宁波市各地区屠宰场和市场猪组织样本中共检出SS2阳性样本11例,比例为8.9%,cps2j+mrp+ef+高致病性SS2阳性样本1例,比例为0.8%.其他两个毒力因子mrp、ef检出率总计为2.4%、0.8%.在100份屠宰场样品中,除宁海、北仑和慈溪的屠宰场有SS2的检出外,其他地区均未检出.24份鲜肉市场样品中仅鄞州检出2例SS2,但无高致病性基因型的SS2检出.结果表明,进入消费市场的猪携带高毒性SS2的概率很小,市民因购买和食用猪肉而感染高毒性SS2引起严重疾病的风险很低.但一例高毒性阳性样本的检出提示着,不同产地的生猪在长途运输中可能造成细菌的传播和感染,且屠宰场的环境和刀具清洁不够及时也容易造成猪肉的接触污染.

