黑色素抗原C1、C2在乳腺癌组织中的表达及其与临床病理特征和预后的关系
杨淑改,李晓燕,周勇
(1 平顶山学院,河南平顶山 467000;2平顶山市第二人民医院;3新乡市中心医院)
目前,临床上对于乳腺癌的致病原因及具体发病机制尚未完全阐明,但关于其治疗仍是当前肿瘤免疫学研究的热点之一[1]。随着医学技术的不断进步和发展,多种乳腺癌的治疗方案逐渐被人们所认识。研究[2,3]发现,不同临床特征的乳腺癌患者采取相应的治疗后可出现不同的预后。黑色素抗原基因(MAGE)多存在于正常人群的睾丸组织中[4]。有研究[5,6]发现,MAGE在多种恶性肿瘤组织中高表达。MAGE-C1与MAGE-C2是MAGE家族中常见的两种类型,与多种恶性肿瘤的发生和进展有关,但关于其与乳腺癌的关系尚未见明确报道。本研究回顾性分析84例乳腺癌患者的临床及随访资料,旨在探讨MAGE-C1与MAGE-C2在乳腺癌组织中的表达及其与临床病理特征和预后的关系。现将结果报告如下。
1 资料与方法
1.1临床资料选取我院2008年5月~2012年5月收治的84例乳腺癌患者作为研究对象,患者均为女性,年龄35~70(52.36±9.42)岁。患者均接受手术治疗,术中收集切取的乳腺癌癌变组织84例作为观察组,并在手术过程中收集相应距离癌组织边缘5 cm以上且外观正常的组织为对照组。按照1997年国际抗癌联盟(UICC)中乳腺癌TNM分期标准[7],Ⅰ期14例、Ⅱ期48例、Ⅲ期22例。按照全国乳腺癌专业会议制定的病理分类方案[8],浸润性导管癌46例、浸润性小叶癌22例、乳腺髓样癌16例。雌激素受体(ER)表达阴性52例、阳性32例,孕激素受体(PR)表达阴性58例、阳性26例,人类表皮生长因子受体2(HER2)表达阴性60例、阳性24例。纳入标准:符合2004年世界卫生组织(WHO)制定的乳腺癌明确诊断标准[9];在完善术前准备后行手术治疗且术后均经病理学检查证实;本研究经医院伦理委员会批准;所有患者知情同意本研究并签署知情同意书。排除标准:存在严重肝肾功能不全者;除去乳腺癌外存在其他乳腺疾病及其他恶性肿瘤者;临床及随访资料不完整者。
1.2MAGE-C1、MAGE-C2检测方法①MAGE-C1、MAGE-C2蛋白检测。将所有组织标本制成石蜡切片,按SP免疫组化试剂盒(北京中杉金桥生物技术有限公司)说明书所述的操作方法检测MAGE-C1和MAGE-C2蛋白的表达。显微镜下观察细胞染色棕黄色者为阳性,呈颗粒状或片状,位于胞质与胞膜[12,13]。参考Thaker依照细胞着色密度和着色强度建立以下半定量评分方法。计数5个高倍视野,每例切片至少评价1 000个肿瘤细胞。依阳性细胞着色密度:阳性细胞百分数为0~5%时为0分,>5%~50%为2分,>50%为3分。依阳性细胞着色强度:阴性为0分,轻度着色为1分,中度着色为2分,强染色为3分。将两者相加,0分及着色细胞百分数≤5%为阴性,1~6分为阳性。②MAGE-C1、MAGE-C2 mRNA检测[11]。取2组组织,提取总RNA,合成cDNA,采用文献[10]设计引物序列扩增PCR。取RT-PCR扩增产物5 μL和溴酚蓝上样缓冲液2 μL,混合后上样于2%的琼脂糖凝胶(0.5 μg/mL溴化乙锭染色)加样孔中,80 V电泳30 min,紫外透射反射仪下观察条带,凝胶图像分析仪对目的基因(MAGE-C1与MAGE-C2)及内参照基因(GAPDH)进行积分吸光度分析并摄像。对比DNA Marker,扩增出221 bp和325 bp的条带为阳性表达,内参照基因为101 bp条带。MAGE-C1/GAPDH和MAGE-C2/GAPDH分别代表MAGE-C1和MAGE-C2 mRNA的相对表达量。
1.3预后随访方法所有患者出院后通过门诊或电话等随访5年,随访终点为2017年5月30日或患者死亡。
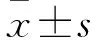
2 结果
2.12组MAGE-C1、MAGE-C2表达比较观察组、对照组MAGE-C1 mRNA相对表达量分别为3.64±1.34、0.14±0.02,蛋白表达阳性分别为54、8例,两组相比P均<0.01。观察组、对照组MAGE-C2 mRNA相对表达量分别为3.50±1.30、0.10±0.01,蛋白表达阳性分别为50、6例,两组相比P均<0.01。
2.2不同临床病理特征乳腺癌患者MAGE-C1、MAGE-C2蛋白表达比较见表1。
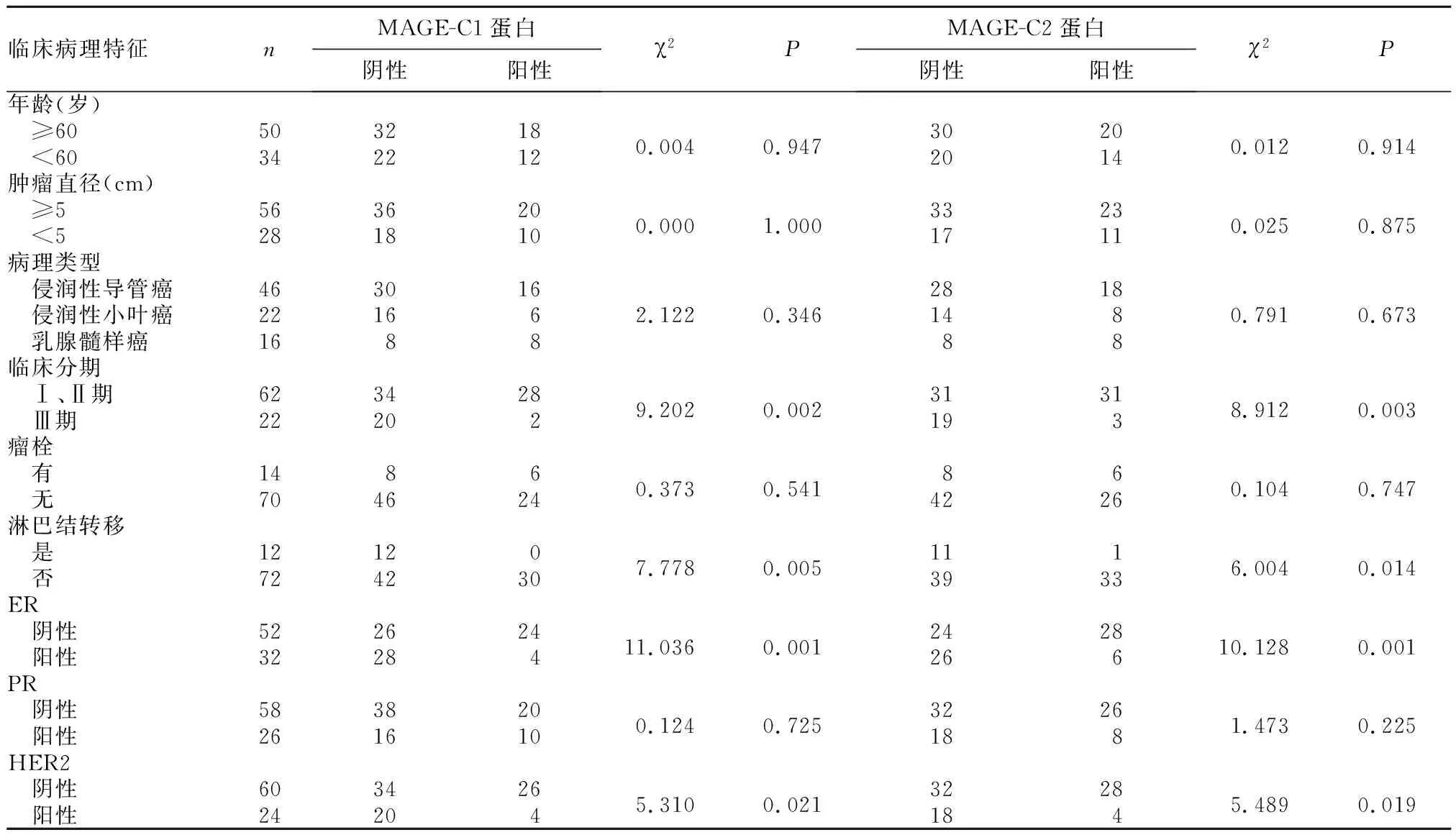
表1 不同临床病理特征的乳腺癌患者MAGE-C1、MAGE-C2蛋白表达比较(例)
2.3乳腺癌患者预后生存情况84例乳腺癌患者中,自出院至随访结束生存时间为1~54个月,中位生存时间为48.68个月,出院后1年生存率为94.05%(79/84),3年生存率为89.29%(75/84),5年生存率为78.57%(66/84)。
2.4MAGE-C1、MAGE-C2与乳腺癌患者预后的关系MAGE-C1阴性和阳性患者5年总生存率分别为93.33%(28/30)、70.37%(38/54),MAGE-C2阴性和阳性患者5年总生存率分别为88.24%(30/34)、72.00%(36/50),两者相比P均<0.05。非条件单因素Cox比例风险回归模型分析结果显示,临床分期为Ⅲ期、出现淋巴结转移、MAGE-C1阳性、MAGE-C2阳性的乳腺癌患者生存时间短(P均<0.05),见表2。多因素Cox比例风险回归模型分析结果显示,临床分期为Ⅲ期、出现淋巴结转移、MAGE-C1阳性、MAGE-C2阳性为影响乳腺癌患者预后的独立危险因素(P均<0.05),见表3。

表2 不同临床病理特征乳腺癌患者生存时间比较(月)
3 讨论
相关调查研究显示,乳腺癌在女性人群发病率高,且好发于绝经期前后妇女,预后较差,严重影响患者的身体健康和生活质量[14,15]。目前,临床上治疗乳腺癌的主要有效手段为手术切除治疗,但有研究发现,单纯手术治疗难以解决患者术后的复发、转移等问题[16]。而除去治疗方案外,有学者认为机体相关细胞因子和基因的表达与术后治疗效果及预后有着密不可分的关系,故寻找影响乳腺癌患者病情进展和预后的相关因素并及时予以干预是改善乳腺癌患者预后的关键[17,18]。
MAGE-C1与MAGE-C2均属于肿瘤睾丸抗原(CTA)中的成员,属于两种较为新型的肿瘤标志物,其在正常人体仅存在于睾丸和胎盘组织中[19]。有文献报道,MAGE-C1与MAGE-C2最初被发现在黑色素瘤细胞中,后不少国内外研究证实其在多种肿瘤细胞中均呈较高水平表达[20]。本研究结果显示,观察组MAGE-C1、MAGE-C2 mRNA表达水平及蛋白阳性表达例数均高于对照组,结果符合既往报道。本研究结果还显示,临床分期为Ⅲ期、出现淋巴结转移以及ER和HER2为阳性的乳腺癌患者MAGE-C1与MAGE-C2的阳性表达率高。提示MAGE-C1与MAGE-C2在机体中的表达水平与乳腺癌发生和疾病进展有着密切联系。目前,临床上对于MAGE-C1与MAGE-C2在肿瘤细胞中表达的确切机制尚未完全阐明,但有研究表明,人类体细胞中MAGE基因高度甲基化,而在胚胎细胞和恶性肿瘤细胞中则可能发生去甲基化而获得表达[21];除此之外,MAGE-C1与MAGE-C2在瘤细胞的胞质内被降解成九肽或十肽,然后作为抗原表位,与细胞内HLA分子结合后呈递到细胞膜,从而诱导机体免疫系统产生相应抗体。Zhang等[22]给黑色素瘤患者接种MAGE抗原肽和Sadanaga等[23]采用MAGE抗原肽刺激DCs治疗胃肠癌均具有一定的临床效果。有研究[24]显示,当MAGE-A11在机体中呈现高水平表达时,可一定程度促进前列腺癌的发生,更进一步提示MAGE与肿瘤有相关性。有研究发现,HER2与乳腺癌的发生和疾病进展及预后有一定的联系,HER2阳性表达提示乳腺癌患者预后不良[25]。本研究发现,临床分期为Ⅲ期、出现淋巴结转移、MAGE-C1阳性、MAGE-C2阳性患者生存时间短,表明MAGE-C1与MAGE-C2阳性与乳腺癌患者预后有着一定的联系。进一步多因素Cox比例风险回归模型分析发现,临床分期为Ⅲ期、出现淋巴结转移及MAGE-C1阳性、MAGE-C2阳性均为影响乳腺癌患者预后的独

表3 影响乳腺癌患者预后的多因素分析
立危险因素。可见,MAGE-C1与MAGE-C2在乳腺癌的发生、进展以及预后中起着重要的作用,可作为临床上评估乳腺癌患者预后的有效指标。
综上所述,MAGE-C1与MAGE-C2在乳腺癌组织中高表达,临床分期为Ⅲ期、出现淋巴结转移以及ER和HER2为阳性时其均高表达,表达阳性者预后均不良。但本组研究所选样本含量过小及研究时间过短,对于MAGE-C1与MAGE-C2的表达是否受其他因素影响尚未明确,可加大样本量和延长研究时间进一步深入探讨。

