大鼠门静脉系统血栓形成模型的建立和观察
张津瑜,陈文显,沈华,王雁,张国雷,慎华平,吴万波,魏云海
(湖州市中心医院 1. 普通外科 2. 超声科,浙江 湖州 313000)
门静脉血栓(portal vein thrombosis,PVT)是指门静脉主干及其左右分支或肠系膜上静脉、脾静脉、肠系膜下静脉形成的血栓,是一种深部血管阻塞性病变[1]。PVT在健康人群中的发病率很低,被认为是一种少见疾病,然而其在肝硬化患者中的发病率则高达10%~26%[2-4]。PVT的存在严重威胁着肝硬化患者的生命,如胃食管静脉曲张破裂出血和急性肠缺血,或可加重门静脉高压导致反复的上消化道出血、顽固性腹水,甚至肝肾综合征,进而影响患者的生存率[5-7]。而且有研究[8-10]表明PVT的存在还会增加肝移植手术的难度及移植后患者的病死率。动物模型是研究人体内PVT形成的发病机制、病程进展和评价治疗方法等的重要平台,门静脉血栓动物模型的建立由于过程比较复杂,建模成功率较低等因素,国内外对于PVT动物模型建立的研究相对较少,笔者通过间断结扎阻断门静脉的方法成功地建立了稳定的PVT大鼠模型,同时对建模前后血栓形成相关指标进行观察研究,现报告如下。
1 材料与方法
1.1 实验动物及分组
清洁级SD大鼠90只,雄性;体质量300~400 g,平均(350±27)g;鼠龄6~8个月。大鼠饲养于湖州市中心医院中心实验室动物房,室温22~25 ℃,动物房通风良好,每天给予标准化饲料喂养,大鼠自由饮食,90只大鼠适应性喂养1周后随机分为实验组和对照组,每组各45只,两组大鼠分别按以下操作步骤建立模型。
1.2 PVT模型的建立
实验组:⑴ 术前禁食12 h,使用5%水合氯醛麻醉(0.7 mL/100 g),取仰卧位固定于手术台上,备皮,常规碘伏消毒,酒精脱碘。⑵ 沿腹前正中线做纵行切口,长度约5 cm,逐层打开腹腔,首先寻找肠系膜上静脉,循肠系膜上静脉向上,可见门静脉。⑶ 分离门静脉,取4-0号缝合线分别于门静脉远近两端穿过,将硬膜外导管与静脉平行放置,结扎远近两端(静脉和硬膜外导管一起结扎),结扎的间距始终为1.5 cm,每隔5 min将结扎线打开1次,恢复门静脉的血流,共反复操作5次。如此造成该段门静脉血流滞缓及静脉壁的损伤,然后关闭腹腔并逐层缝合腹壁(图1)。对照组:手术步骤同实验组前两个步骤,即仅做门静脉的游离,不做门静脉的反复结扎。
1.3 标本的获取及观察
于术前30 min、手术后30 min及3、6、12、24 h各时间段先由1名经验丰富的B超科医生利用血管超声多普勒观察两组门静脉血栓形成情况,并测量门静脉血栓的长度,然后分别采集各时间段两组大鼠的静脉血,并测量静脉血中P-选择素、D-二聚体及纤维蛋白原含量。血管超声仪器采用Philips lu-22,探头型号为L12-5,超声频率设置为11 M,血流夹角<60°。P-选择素含量测定采用美国Coulter流式细胞仪(试剂盒购于美国Beckman Coulter公司)进行测定,D-二聚体含量测定采用免疫比浊法(试剂盒购于上海希森美康医用电子有限公司),采用凝固法检测标本中纤维蛋白原的含量,上述指标测定均按试剂盒要求操作。于手术24 h后处死两组所有大鼠,肉眼观察两组大鼠门静脉血栓形成情况,将血栓标本用10%甲醛溶液固定,制成石蜡切片,行苏木素-伊红(HE)染色,显微镜下观察组织病理学改变。
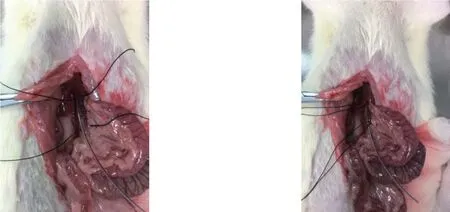
图1 实验组大鼠门静脉的游离及间断结扎阻断情况Figure 1 The isolation and repeated interruption of the portal vein in rats in experimental group
1.4 统计学处理
数据采用SPSS 19.0统计学软件进行统计分析,计量资料采用均数±标准差(±s),两组间比较采用两独立样本t检验,计数资料以率或构成比较[n(%)]表示,采用χ2检验比较两组间的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 两组大鼠PVT建模成功率的比较
实验组大鼠在建模过程中死亡5只,其中1只死于DIC,2只死于肝衰竭,2只死于急性肠坏死,6只大鼠24 h后未形成门静脉血栓,34只大鼠在术后24 h后形成稳定的PVT,建模成功率为75.56%,对照组大鼠死亡2只,1只死于门静脉损伤出血,1只死于麻醉过量,3只大鼠手术24 h后仅形成少量附壁血栓,余大鼠未见门静脉血栓形成,两组比较差异有统计学意义(P<0.05)(表1)。
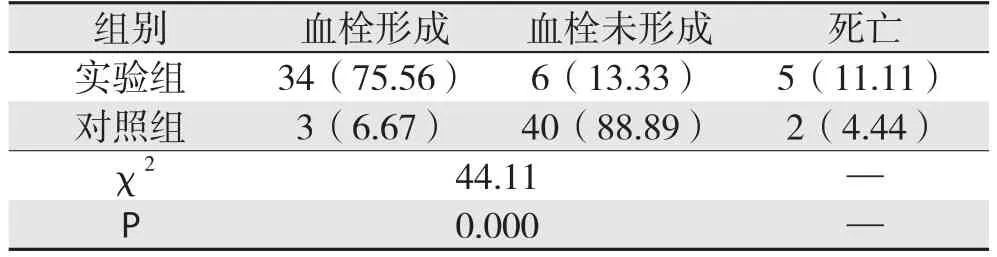
表1 实验组与对照组血栓形成情况比较[n=45,n(%)]Table 1 Comparison of the thrombosis formations between experimental group and control group [n=45, n (%)]
2.2 实验组大鼠在建模过程中PVT形成的具体情况
实验组大鼠术前30 min、术后30 min及3 h血管超声均未见门静脉血栓形成,CDFI血流充盈良好,流速正常(图2A-C);10只大鼠建模6 h后血管超声可见PVT开始形成,CDFI血流充盈缺损,流速增大(图2D);18只大鼠建模12 h后血管超声可见PVT,部分大鼠PVT较前增大,CDFI血流充盈缺损,流速增大(图2E);34只大鼠术后24 h后血管超声可见PVT形成,部分大鼠PVT进一步增大,CDFI血流充盈缺损较前明显,血流速度进一步增大(图2F)。
术后24 h处死大鼠,肉眼可见形成血栓的大鼠门静脉有稳定黑色血栓形成,门静脉可允许部分血流通过,呈半狭窄状态,测量血栓的长度与血管彩超测量的血栓长度基本一致,使用注射器针头轻轻穿刺可见血栓的血管壁,血管壁变硬,无出血,提示血栓为稳定的黑色血栓(图3)。
病理学检查在显微镜下可见门静脉血栓机化伴新生血管形成及炎症细胞浸润,并可见多核巨噬细胞(图4)。
2.3 两组大鼠各时间段血栓形成相关指标的比较
两组大鼠P-选择素、D-二聚体及纤维蛋白原含量在术前与术后30 min及术后3 h差异均无统计学意义(均P>0.05),但在术后6 h后各时间段差异均有统计学意义(均P<0.05)(图5)。
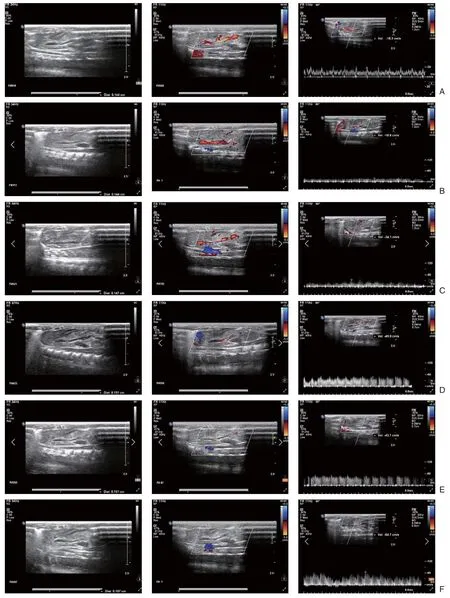
图2 实验组大鼠建模前后各时间段门静脉系统血管超声表现 A:术前30 min;B:术后30 min;C:术后3 h;D:术后6 h;E:术后 12 h;F:术后 24 hFigure 2 Vascular ultrasonography of portal vein system of rats in the experimental group at various time points A: Preoperative 30 min; B: Postoperative 30 min; C: Postoperative 3 h; D: Postoperative 6 h; E: Postoperative 12 h; F: Postoperative 24 h

图3 实验组大鼠术后24 h后PVT形成情况Figure 3 The PVT formation in rats in experimental group 24 h after operation
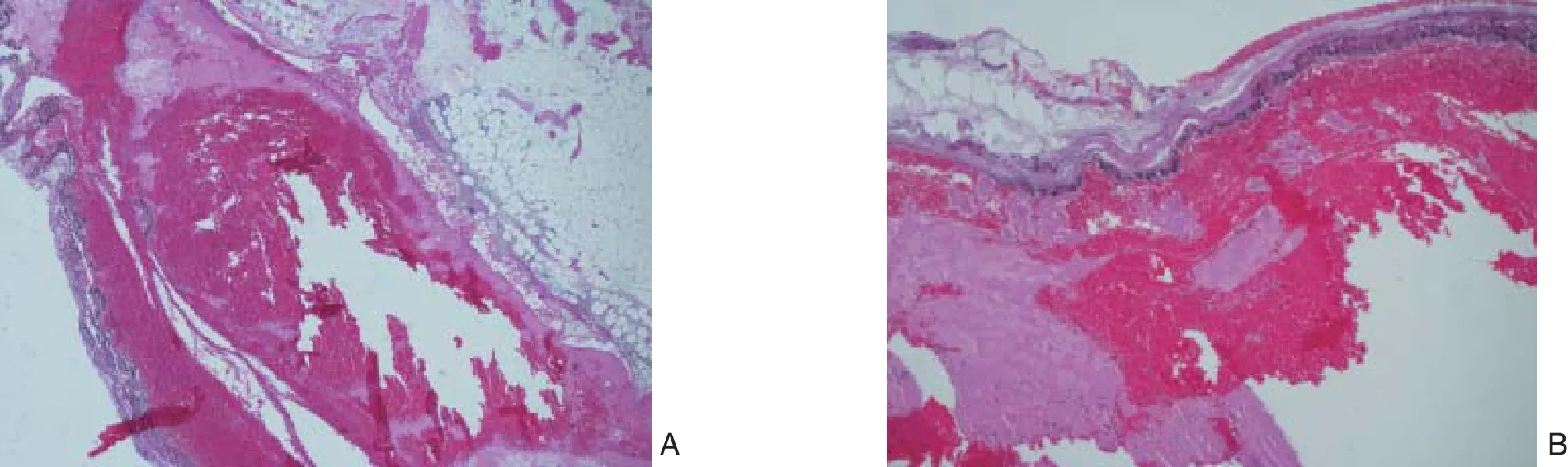
图4 实验组大鼠门静脉系统血栓形成的病理学表现 A:HE×40;B:HE×100Figure 4 The pathological fi ndings of portal vein thrombosis of rats in experimental group A: HE×40; B: HE×100
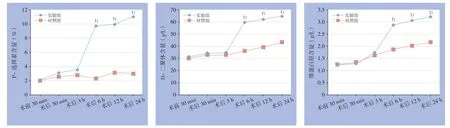
图5 不同时间点两组血栓形成相关指标含量变化 注:1)与对照组比较,P<0.05 Figure 5 Changes in the thrombosis-associated variables in the two groups at diあ erent time points Note: 1) P<0.05 vs. control group
2.4 实验组大鼠各时间段血栓长度变化情况
实验组大鼠在手术前、后30 min及手术后3 h未见明显门静脉血栓形成,手术后6 h超声可见门静脉系统血栓形成,长度为(5.25±1.33)mm,术后12 h门静脉血栓长度为(9.21±1.07)mm,术后24 h门静脉血栓长度为(13.76±1.02)mm,且术后24 h超声测量的血栓长度基本与处死大鼠后肉眼测量的血栓长度一致。
3 讨 论
PVT是在1868年被Balfour首次发现并报道的,虽然目前的研究表明,其在正常健康人群当中的发病率极低[2],但其在肝硬化患者尤其是肝硬化失代偿期患者中较常发生,同时PVT也是肝硬化门静脉高压患者针对脾功能亢进及食管胃底静脉曲张破裂出血行脾脏切除联合血管断流术后最严重的并发症之一,严重威胁着患者的生命[11-12]。评估PVT的严重程度主要包括血栓的程度(部分血栓、完全血栓和纤维条索形成),血栓的分期(急性、慢性和门静脉海绵样变)和血栓的范围[13-14]。PVT的病情越严重,则患者的预后就会越差。动物模型是用来研究各种疾病发生、发展、治疗效果、疾病结局等方面的常用手段,但由于门静脉系统解剖的特殊性,给成功建立门静脉血栓动物模型造成了很大的困难,因此,寻找一种可行的且符合临床要求的门静脉血栓动物模型的建立方法至关重要。
根据Virchow提出的静脉血栓形成的三因素,即静脉血流滞缓、静脉壁损伤、以及局部凝血功能增高,制备静脉血栓的动物模型至少需要满足上述条件之一,诱发血栓形成的方法主要有阻断法、结扎法、异物法、内膜损伤法及血栓诱导剂法等多种方法。制备静脉血栓常用的动物有大鼠、小鼠、兔、猪、犬、猴等[15]。Wei等[16]采用注入氯化铁及凝血酶的方法成功制备了鼠的颅内静脉窦血栓模型。Kai等[17]采用经皮经肝穿刺损伤静脉壁的方法成功制备了猪肠系膜血管的静脉血栓模型。虽然像兔、猪、猴等大动物的生理结构可能更加接近人类的生理特点,但使用大动物制备动物模型费用颇高,而且常受伦理方面的约束,其应用受到了一定的限制。而像大鼠、小鼠等小型动物则可以很好的解决上述的问题[18]。国内外虽有采用大小鼠制备深静脉血栓动物模型的报道,但其主要以下肢深静脉为主,门静脉血栓模型报道较少,造模成功率较低。
本研究通过间断结扎阻断门静脉使结扎段门静脉局部血流滞缓,同时可以造成结扎处门静脉壁的损伤,从而诱发门静脉血栓的形成。本文笔者认为,采用这种方法制作动物模型具有以下特点:一是在造模过程中,结扎门静脉时将门静脉与硬膜外导管同时结扎,既可以确保结扎段的门静脉的长度始终保持一致及每次结扎门静脉的力度基本相同,排除了因结扎力度及结扎段长度不同对实验结果造成的干扰,同时此方法不仅可以造成门静脉局部血流瘀滞,还可以造成结扎处门静脉壁的损伤,造模成功率高,本研究达75.56%,此外该方法操作简单,可重复性较高;二是采用此方法制备血栓模型比较接近人体内血栓形成的生理特点,同时动物模型形成的血栓其形态学与人体内血栓相似,更具有研究价值。但制备该模型同时需要注意几个方面,首先分离门静脉及其周围组织时,动作一定要轻柔,避免损伤甚至离断门静脉,造成建模的失败;其次要严格控制麻醉剂的用量,以免麻醉过量造成大鼠死亡,采血时动作要轻柔,避免大鼠窒息;最重要的是要掌握好结扎门静脉时的力度及打开结扎线的时间,避免造成门静脉的阻断时间过长及静脉壁损伤过度。
近年来,有研究发现深静脉血栓患者体内存在血小板激活。研究认为,P-选择素是血小板活化标志物之一,其可通过介导血小板、内皮细胞黏附及白细胞的相互作用,参与启动血栓形成的病理生理起始过程,是血栓形成的重要介质及靶分子[19-20]。D-二聚体是已交联纤维蛋白的降解产物之一,其在血浆中的水平代表了体内凝血酶原的活性及纤维蛋白原的生成情况,是人体内血栓形成的重要指标之一[21-22]。纤维蛋白原是血浆中含量最高的凝血因子,一直以来被当做预测血栓和血栓形成的独立危险因素,其在血浆中的含量增高,可以改变血液粘度及血液流变学指标,而后两者的改变又与血管内皮细胞损伤及血栓形成等多种效应有关[23-24]。本研究结果显示,实验组与对照组大鼠在术前、术后30 min及术后3 h,P-选择素、D-二聚体及纤维蛋白原水平差异无统计学意义,但在术后6 h后各时间段上述指标差异有统计学意义,说明P-选择素、D-二聚体及纤维蛋白原水平在血栓形成后均有所增高,且与未形成血栓时的含量有明显差异,其可作为是否有血栓形成的重要参考指标,这与某些研究的结论相似[25]。
综上所述,采用间断结扎阻断门静脉的方法建立门静脉血栓大鼠模型是可行的,且建模成功率较高,P-选择素含量、D-二聚体含量及纤维蛋白原含量可以作为是否有血栓形成的重要参考指标。当然,本研究也存在一些不足,实验者只研究了从建模开始到形成稳定的门静脉血栓这个过程,对于之后门静脉血栓是否可能再通及血栓相关指标进一步的变化情况,并未做进一步的研究,期望在接下来的研究中可以进一步去探索。
[1] Fujiyama S, Saitoh S, Kawamura Y, et al. Portal vein thrombosis in liver cirrhosis: incidence, management, and outcome[J]. BMC Gastroenterology, 2017, 17(1):112. doi: 10.1186/s12876–017–0668–8.
[2] Abu El-Makarem MA, El-Akad AF, Elian MM, et al. Nonneoplastic Portal Vein Thrombosis in HCV Cirrhosis Patients:Is it an Immuno-Inflammatory Disorder?[J]. Ann Hepatol, 2017,16(4):574–583. doi: 10.5604/01.3001.0010.0296.
[3] Manzano-Robleda Mdel C, Barranco-Fragoso B, Uribe M, et al. Portal vein thrombosis: what is new? [J]. Ann Hepatol, 2015,14(1):20–27.
[4] Al Hashmi K, Al Aamri L, Al Lamki S, et al. Portal Vein Thrombosis in Adult Omani Patients: A Retrospective Cohort Study[J]. Oman Med J, 2017, 32(6):522–527. doi: 10.5001/omj.2017.100.
[5] Das SK, Ray A, Jana CK, et al. Chronic portal vein thrombosis due to combined defi ciency of protein C and protein S[J]. J Indian Med Assoc, 2011, 109(10):753–754.
[6] 陈小刚, 张培瑞, 李志伟, 等. 肝硬化门静脉高压脾切断流术后影响门静脉系统血栓形成的因素[J]. 中国普通外科杂志, 2013,22(1):67–70. doi:10.7659/j.issn.1005–6947.2013.01.016.Chen XG, Zhang PR, Li ZW, et al. Influential factors for portal venous thrombosis after splenectomy and gastric pericardial devascularization for cirrhotic portal hypertension[J]. Chinese Journal of General Surgery, 2013, 22(1):67–70. doi:10.7659/j.issn.1005–6947.2013.01.016.
[7] 汤雯, 王宇, 赵新颜, 等. 门静脉血栓对肝硬化患者预后的影响[J]. 临床肝胆病杂志, 2017, 33(3):466–471. doi:10.3969/j.issn.1001–5256.2017.03.014.Tang W, Wang Y, Zhao XY, et al. Impact of portal vein thrombosis on prognosis of patients with liver cirrhosis[J]. Journal of Clinical Hepatology, 2017, 33(3):466–471. doi:10.3969/j.issn.1001–5256.2017.03.014.
[8] Magistri P, Tarantino G, Olivieri T, et al. Extra-Anatomic Jump Graft from the Right Colic Vein: A Novel Technique to Manage Portal Vein Thrombosis in Liver Transplantation[J]. Case Rep Surg,2018, 2018:4671828. doi: 10.1155/2018/4671828.
[9] Karvellas CJ, Cardoso FS, Senzolo M, et al. Clinical Impact of Portal Vein Thrombosis Prior to Liver Transplantation: A Retrospective Cohort Study[J]. Ann Hepatol, 2017, 16(2):236–436.doi: 10.5604/16652681.1231582.
[10] Hernández Conde M, Llop Herrera E, de la Revilla Negro J, et al.Prevalence and outcome of portal thrombosis in a cohort of cirrhotic patients undergoing liver transplantation[J]. Rev Esp Enferm Dig,2016, 108(11):716–720. DOI: 10.17235/reed.2016.4211/2016.
[11] Zhang Y, Wen TF, Yan LN, et al. Preoperative predictors of portal vein thrombosis after splenectomy with periesophagogastric devascularization[J]. World J Gastroenterol, 2012, 18(15):1834–1839. doi: 10.3748/wjg.v18.i15.1834.
[12] 贺莎莎, 范晓棠, 石绣江, 等. 肝硬化门静脉高压症脾切除术后发生门静脉血栓的风险因素及其预测模型的建立[J].中国普通外科杂志, 2016, 25(12):1766–1772. doi:10.3978/j.issn.1005–6947.2016.12.016.He SS, Fan XT, Shi XJ, et al. Risk factors for portal vein thrombosis after splenectomy for portal hypertension due to liver cirrhosis and establishment of its prediction model[J]. Chinese Journal of General Surgery, 2016, 25(12):1766–1772. doi:10.3978/j.issn.1005–6947.2016.12.016.
[13] 陈辉, 何创业, 韩国宏. 肝硬化门静脉血栓预防和治疗进展[J]. 中华消化杂志, 2014, 34(1):7–10. doi:10.3760/cma.j.issn.0254–1432.2014.01.004.Chen H, He CY, Han GH. Progress in prevention and treatment of portal venous thrombosis caused by hepatic cirrhosis[J].Chinese Journal of Digestion, 2014, 34(1):7–10. doi:10.3760/cma.j.issn.0254–1432.2014.01.004.
[14] von Köckritz L, De Gottardi A, Trebicka J, et al. Portal vein thrombosis in patients with cirrhosis[J]. Gastroenterol Rep (Oxf),2017, 5(2):148–156. doi: 10.1093/gastro/gox014.
[15] 金浪, 李勃, 杨光. 深静脉血栓形成动物模型的制备方法研究进展[J]. 中国骨伤, 2015, 28(8):775–779. doi:10.3969/j.issn.1003–0034.2015.08.023.Jin L, Li B, Yang G. Progress on preparation methods of animal model of deep venous thrombosis[J]. China Journal of Orthopaedics and Traumatology, 2015, 28(8):775–779. doi:10.3969/j.issn.1003–0034.2015.08.023.
[16] Wei Y, Deng X, Sheng G, et al. A rabbit model of cerebral venous sinus thrombosis established by ferric chloride and thrombin injection[J]. Neuroscience Letters, 2018, 662:205–212. doi:10.1016/j.neulet.2017.10.041.
[17] Kai L, Jiaxiang M, Xinxin F, et al. Establishment of mesenteric venous thrombosis in a porcine model using a transhepatic endovascular approach[J]. Thromb Res, 2015, 136(6):1179–1184.doi: 10.1016/j.thromres.2015.10.028.
[18] 邓素雄, 刘龙山, 马毅, 等. 小鼠深静脉血栓形成及再通模型的建立和评价[J]. 中华实验外科杂志, 2008, 25(9):1206–1208.doi:10.3321/j.issn:1001–9030.2008.09.044.Deng SX, Liu LS, Ma Y, et al. Establishment and evaluation of deep venous thrombosis and recanalization model in mice[J].Chinese Journal of Experimental Surgery, 2008, 25(9):1206–1208.doi:10.3321/j.issn:1001–9030.2008.09.044.
[19] 魏云海, 慎华平, 王大禹, 等. P-选择素对脾切除术后门静脉血栓形成的早期预测价值[J]. 中华普通外科杂志, 2014, 29(5):366–369. doi:10.3760/cma.j.issn.1007–631X.2014.05.012.Wei YH, Shen HP, Wang DY, et al. The early predictive value of P-sel in portal vein thrombosis after splenectomy[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2014, 29(5):366–369. doi:10.3760/cma.j.issn.1007–631X.2014.05.012.
[20] Fernandes LFB, Fregnani JHTG, Strunz CMC, et al. Role of P-selectin in thromboembolic events in patients with cancer[J]. Mol Clin Oncol, 2018, 8(1):188–196. doi: 10.3892/mco.2017.1482.
[21] Prochaska JH, Frank B, Nagler M, et al. Age-related diagnostic value of D-dimer testing and the role of inflammation in patients with suspected deep vein thrombosis[J]. Sci Rep, 2017, 7(1):4591.doi: 10.1038/s41598–017–04843-x.
[22] Bjøri E, Johnsen HS, Hansen JB, et al. D-dimer at venous thrombosis diagnosis is associated with risk of recurrence[J]. J Thromb Haemost, 2017, 15(5):917–924. doi: 10.1111/jth.13648.
[23] Mackman N. New insights into the mechanisms of venous thrombosis[J]. J Clin Invest, 2012, 122(7):2331–2336. doi: 10.1172/JCI60229.
[24] 黄子健, 霍景山. 深静脉血栓形成早期试验指标的研究进展[J].中国普通外科杂志, 2016, 25(6):913–918.Huang ZJ, Huo JS. Research progress in early test indexes of deep venous thrombosis[J]. Chinese Journal of General Surgery, 2016,25(6):913–918.
[25] 吴鹏, 黄晨, 冯惠岗, 等. 大鼠深静脉血栓形成模型建立及观察[J].中华介入放射学电子杂志, 2015, 3(2):91–94. doi:10.3877/cma.j.issn.2095–5782.2015.02.009.Wu P, Huang C, Feng HG, et al. Establishment and observational studies of deep venous thrombosis in rats model[J]. Chinese Journal of Interventional Radiology: Electronic Edition, 2015, 3(2):91–94.doi:10.3877/cma.j.issn.2095–5782.2015.02.009.

