肿瘤相关巨噬细胞(TAMs)作为膀胱癌的潜在免疫治疗靶点
陈 禾,戴可帆,毕嘉洋,赵 凯,王华超,贾 乾,刘 伟
(河北医科大学:1基础医学院,2药学院,3基础医学院免疫学教研室,河北省重大疾病的免疫机制及干预重点实验室,河北石家庄050017)
0 引言
膀胱癌是泌尿系统最常见的恶性肿瘤,也是癌症相关死亡的常见原因之一,全球范围内因膀胱癌死亡的病例约有150 000例[1]。目前膀胱癌的主要治疗方式是经尿道膀胱肿瘤电切术和卡介苗(BCG)治疗,但治疗效果并不理想。
巨噬细胞作为重要的固有免疫细胞分布于人体全身,能够通过不同的极化途径获得功能各异的表型[2](图 1)。 在微生物产物如脂多糖(lipopolysac⁃charide,LPS)或促炎细胞因子(如 IFN⁃γ,TNF 等)的刺激下,巨噬细胞可极化为M1型,M1型巨噬细胞抗原提呈能力强,可合成释放一氧化氮(nitric oxide,NO)及活性氧自由基(reactive oxygen species,ROS),并分泌 TNF⁃α、IL⁃1、IL⁃6、IL⁃12、I型 IFN、CXCL1⁃3、CXCL5和CXCL8等多种促炎细胞因子[3],因而具有促进Th1型免疫应答的能力以及较强的抗微生物和抗肿瘤活性。 M2型巨噬细胞是在 IL⁃4、IL⁃13和IL⁃10等细胞因子的作用下极化形成的[4],M2 型巨噬细胞并不产生NO和ROS,而是以上调甘露糖受体,清道夫受体 A、B⁃1,CD163,CCR2,CXCR1 和 CXCR2等的表达为主要特征[5]。M2型巨噬细胞主要产生IL⁃10等抗炎细胞因子和极低水平的IL⁃12等促炎细胞因子,在促进Th2型免疫应答、组织重塑、免疫抑制以及肿瘤进展中发挥作用[6]。
恶性肿瘤组织中浸润的巨噬细胞称为肿瘤相关巨噬细胞(tumor⁃associated macrophages,TAMs),研究[7]证明TAMs多具有M2型巨噬细胞的表型特征。近年来,TAMs的促肿瘤作用及其与肿瘤进展的密切联系逐渐被揭示[8]。同样,TAMs在膀胱癌的发生、生长、侵袭和转移中也发挥重要作用,与膀胱癌患者的预后状况密切相关。随着研究的不断深入,靶向TAMs的新疗法应运而生,成为治疗膀胱癌的新方向。本文将介绍TAMs在膀胱癌中的作用,并从清除TAMs,调节TAMs极化以及抑制TAMs的功能三个方面论述靶向TAMs治疗的研究进展。
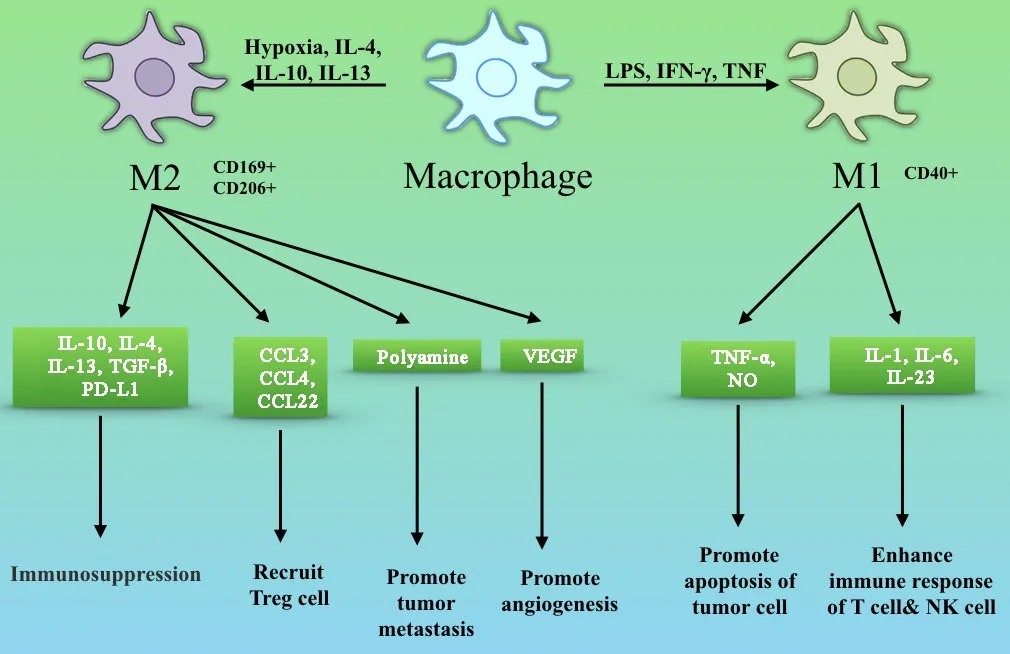
图1 巨噬细胞在不同条件下极化为M1型或M2型,具有不同功能特征[9]
1 TAMs在膀胱癌中的作用
1.1 局部微环境对TAMs极化的影响 局部微环境的条件(如缺氧)能够调节巨噬细胞的极化[10]。肿瘤组织的缺氧环境可促进TAMs向具有促肿瘤作用的M2型极化,这一过程可以通过诱导TAMs的类M2基因(如 VEGF、Arg1、PKM2 等)表达实现[11],也可以由肿瘤细胞(其代谢过程中乳酸水平升高)通过HIF⁃1α依赖的方式进行无氧代谢而实现[12]。 因此,肿瘤组织中的TAMs多具有M2型巨噬细胞的特征,主要发挥抗炎症、促肿瘤效应[13]。TAMs通过破坏基底膜,促进肿瘤血管形成,免疫抑制和基质重塑等作用,在肿瘤原发部位和转移部位促进肿瘤的进展[14-15]。
1.2 TAMs与膀胱癌预后
1.2.1 TAMs 密度 Zhang 等[16]的研究发现,肿瘤组织中浸润的TAMs数量越多、密度越高,泌尿系统癌症患者的总存活率越低、预后越差。此外,高密度TAMs浸润的膀胱癌对BCG疗法较不敏感,影响BCG的治疗效果[17]。
1.2.2 M2 型 TAMs CD68 广泛表达于各类巨噬细胞,MAC387是 M1型极化的巨噬细胞标志物,而CLEVER⁃1/Stabilin⁃1则是 M2 型极化的巨噬细胞标志物。Boström等[18]通过对184名膀胱癌患者预后情况的调查统计发现,除表达 CLEVER⁃1/Stabilin⁃1的M1型巨噬细胞外,其余各巨噬细胞表型皆与膀胱癌进展恶化风险升高、患者预后变差以及生存率降低相关。具体而言,CD68+/MAC387+巨噬细胞数量与肿瘤高分期、高分级呈正相关;而 CLEVER⁃1/Stabi⁃lin⁃1+巨噬细胞数量则与之呈负相关。由此可见,肿瘤组织中M2型极化的巨噬细胞,即TAMs比例越高,患者预后越差。
1.3 TAMs作为膀胱癌治疗靶点的条件 TAMs的M1⁃M2型极化是一个高度动态的过程。因此无论TAMs的极化状态如何,其仍然具有可塑性,可根据局部微环境的变化,在M1和M2两种表型之间进行转换。诱导巨噬细胞从免疫抑制型向免疫促进型转换,作为新的治疗途径,目前已有相关研究开展[19-20]。
2 靶向TAMs的治疗方法
2.1 清除TAMs 大量实验[20]表明,清除小鼠肿瘤组织及其周围的TAMs能改善其预后,这可能是通过消除TAMs对肿瘤细胞的旁分泌作用而实现的。这为我们提供了定向清除TAMs从而治疗膀胱癌的新思路。
2.1.1 M2pep Cieslewicz等[21]通过噬菌体肽库筛选技术模拟M2型巨噬细胞的选择性配体,获得了一种称为M2pep的多肽序列,M2pep能够优先识别并选择性结合荷瘤小鼠体内的 M2表型巨噬细胞,即TAMs,并被其内化,同时几乎不影响M1型巨噬细胞的正常功能。在此基础之上,将M2pep与促凋亡肽KLAKLAKKLAKLAK(KLA)偶联后注入荷瘤小鼠体内,结果证明其能有效减少荷瘤小鼠体内的TAMs数量,提高存活率。该项研究启示通过实验室筛选特异性靶向多肽并与药物偶联,针对性清除TAMs辅助抗癌治疗,改善患者预后具有可观前景。
2.1.2 曲贝替定 一种提取自海洋生物加勒比海鞘(ecteinascidia turbinata)的生物碱——曲贝替定(trabectdin/yondelis),对巨噬细胞具有特异性细胞毒性,不会造成其他免疫细胞的损伤,因而其具有抗肿瘤活性[22]。这一药物已成功应用于多种恶性肿瘤的治疗。
2.2 调节TAMs的极化
2.2.1 铜绿假单胞菌 铜绿假单胞菌甘露糖敏感血凝菌毛株(pseudomonas aeruginosa⁃mannose sensitive hemagglutinin,PA⁃MSHA)能够通过增强机体的特异性细胞免疫功能和非特异性抗肿瘤免疫活性,改善自身的免疫状态而发挥其抗肿瘤效应。研究[23]发现PA⁃MSHA能够上调 IL⁃12、TNF⁃α 和 IFN⁃γ 等 M1 型相关基因的表达,促进TAMs的M1型极化,增强其吞噬能力;另一方面 PA⁃MSHA 能够下调 IL⁃4、IL⁃10和TGF⁃β等 M2型相关基因的表达,抑制 TAMs的M2型极化,增强其抗肿瘤作用。该研究结果证明了PA⁃MSHA在靶向TAMs治疗中的价值。
2.2.2 乳酸 膀胱癌细胞与TAMs之间的乳酸穿梭是巨噬细胞重编程的关键机制[8]。癌细胞依赖有氧条件下的糖酵解来维持合成代谢和增殖,而乳酸是糖酵解的主要代谢产物,癌细胞产生的乳酸通过单羧酸转运体 4(monocarboxylate transporter 4,MCT4)分泌至肿瘤微环境中,再通过单羧酸转运体1(monocar⁃boxylate transporter 1,MCT1)转运至巨噬细胞内[24]。
乳酸在乳酸脱氢酶 1(lactate dehydrogenase,LDH1)作用下转变为丙酮酸,丙酮酸竞争性抑制α⁃酮戊二酸与丙酮酸脱氢酶的结合,从而抑制了HIF⁃1α 的泛素化,也阻止了 HIF⁃1α 被蛋白酶体分解[25]。 HIF⁃α 可增强缺氧相关基因 Arg⁃1 的表达,促进巨噬细胞合成VEGF,从而诱导血管生成[26]。由此可见,乳酸促进TAMs M2型极化。
乳酸不仅可以通过抑制TAMs表达iNOS来抑制NO 产生,还可下调 NF⁃κB 通路[9]。 NO 是肿瘤相关炎症最重要的内源性因子之一。NO与细胞色素c氧化酶竞争氧,导致线粒体功能障碍,还可诱导线粒体自噬[27],从而导致细胞死亡。 NF⁃κB 通路通过调节肿瘤相关炎症因子(如IL⁃1R)的转录在肿瘤相关炎症中发挥重要作用。由此可见,乳酸穿梭可以通过下调NF⁃κB通路,降低NO和肿瘤相关炎症因子的生成,抑制TAMs的M1极化。
膀胱癌细胞通过乳酸穿梭将TAMs重编程为M2表型,造成肿瘤微环境的免疫抑制[8]。阻断乳酸穿梭可成为新的治疗方向,MCTs作为乳酸的转运体,可能是新的治疗靶点。
2.2.3 OK⁃432 由于感染或转移而引起的死亡率升高是癌症手术切除治疗的一大副作用。手术应激反应会引起免疫抑制,促进肿瘤的转移,导致预后不良。因此,避免或减少癌症术后免疫抑制的发生可以改善患者的预后,提高生存率。Tian等[28]通过实验发现,OK⁃432 能够抑制 TAMs表达 IL⁃10,同时促进 TNF⁃α的表达,发挥抗肿瘤作用。此外,Nakamoto等[29]的实验证明,提前应用OK⁃432能够减弱术后应激反应对免疫功能的抑制,快速恢复TAMs的TNF⁃α活性水平,减少术后癌症转移的发生。其作用机制与抑制TAMs的M2型分化和促进TAMs的M1型分化有关。
2.2.4 CSF⁃1 集落刺激因子⁃1(colony stimulating factor⁃1,CSF⁃1)在 TAMs 分化过程中作用显著。 有研究[30]发现,CSF⁃1在小鼠肿瘤模型的高密度血管网的形成过程中也具有重要作用。应用CSF⁃1的抑制剂能够通过增强抗肿瘤免疫而加强放、化疗的疗效[31]。 此外,CSF⁃1 受体(colony⁃stimulating factor⁃1 receptor,CSF⁃1R)的表达通常仅限于巨噬细胞(除了怀孕期间),因此其编码基因——c⁃fms也可作为治疗靶点。针对c⁃fms的抑制剂可通过抑制TAMs表达CSF⁃1R,抑制 TAMs向M2型分化,减弱其促血管生成作用,发挥抗肿瘤作用[32-33]。
2.2.5 科罗索酸 研究[34]发现,三萜类化合物(trit⁃erpenoid compounds)能够显著抑制TAMs向M2型极化。科罗索酸(corosolic acid)就是其中之一,主要存在于苹果渣和香蕉叶中,能够显著抑制皮下肿瘤的生长和小鼠肉瘤模型的肺转移。科罗索酸在动物肿瘤模型治疗中的成功应用为治疗膀胱癌提供了新思路。
2.2.6 NF⁃κB 核因子 κB(NF⁃κB)是 TAMs 向 M1型极化过程中的一个关键转录因子,调控多种炎症基因(如 TNF⁃α、IL⁃1B、COX2 等)的表达[35]。 当 TAMs中NF⁃κB的激活存在缺陷时,NF⁃κB相关炎症功能(如细胞毒性介质、NO等)和细胞因子(如 TNF⁃α、IL⁃1、IL⁃12 等)的表达出现障碍,导致 TAMs对抗肿瘤作用减弱[23-24]。 因此,恢复 TAMs 中 NF⁃κB 的活性具有治疗潜力。近期有研究[25]发现,联合使用CpG(免疫刺激剂)和抗IL⁃10受体抗体可诱导肿瘤中浸润的M2型TAMs向M1型转换,并激活固有免疫应答消融肿瘤组织。另有研究[36]发现,人体产生的富组氨酸糖蛋白(histidine⁃rich glycoprotein,HRG)能够通过下调胎盘生长因子(placental growth factor)活性使TAMs向M1型极化,促进抗肿瘤免疫应答和肿瘤血管的正常化。
2.3 抑制M2型TAMs功能
2.3.1 减弱 M2 型 TAMs的免疫抑制功能 研究[37]发现,膀胱癌可诱导 M2型 TAMs表达 PD⁃L1,表达PD⁃L1的TAMs具有免疫抑制作用,可在体外消除CD8+T细胞,且表达高水平的微粒体前列素E2合成酶(mPGES1)和COX2。通过使用mPGES1和COX2的药物抑制剂或前列腺素脱氢酶(15⁃PGDH),抑制前列腺素2(PGE2)的生成,可有效降低PD⁃L1的表达[37],从而减弱TAM的免疫抑制功能,具有抗肿瘤治疗意义。
2.3.2 抑制M2型TAMs的促淋巴管生成作用 在原位膀胱癌小鼠模型研究中,发现 TAMs高表达VEGF⁃C/D,淋巴管内皮细胞高表达 VEGFR⁃3[38]。VEGF⁃C/D 结合其受体 VEGFR⁃3后激活酪氨酸激酶,促进新的淋巴管生成,可引起膀胱癌的淋巴道转移。 研究[39]发现,采用表达 VEGFR⁃3的腺病毒可以阻断VEGF⁃C/D信号通路,从而抑制M2型 TAMs的淋巴管生成作用。
3 总结与展望
近年来,随着对TAMs研究的兴起,TAMs作为膀胱癌治疗的潜在靶点得到更深入的认识,为膀胱癌的治疗提供了新思路。尝试多种途径清除、调节或抑制TAMs从而抑制肿瘤进展、侵袭和转移的实验室研究已取得较大进展,临床应用前景可观。然而多数治疗方案仍停留在体外实验或动物模型阶段,治疗效果和不良反应尚不明确,有待更多实验数据加以论证。综合多种治疗方案,如将M2pep对TAM的选择性识别作用和曲贝替定对巨噬细胞的特异性细胞毒性相结合,靶向清除TAMs,减轻单一药物的毒副作用,可为研发新药提供新思路。TAMs代谢过程相关蛋白如MCTs的表达水平,可作为膀胱癌预后和治疗的参考指标,用于监测病情变化。此外,利用分子生物学技术准确定位控制TAMs分化、极化和功能的碱基序列有助于更精准地在基因层面通过调控TAMs,从而控制和治疗膀胱癌,同时结合免疫疗法,必将为膀胱癌等多种肿瘤的治疗提供新理念。
[1]Network CGA.Comprehensive molecular characterization of urothelial bladder carcinoma[J].Nature,2014,507(7492):315-22.
[2]O'Shea JJ,Paul WE.Mechanisms underlying lineage commitment and plasticity of helper CD4+T cells[J].Science,2010,327(5969):1098-102.
[3]Sica A,Mantovani A.Macrophage plasticity and polarization:in vivo veritas[J].J Clin Invest,2012,122(3):787-795.
[4]Mantovani A,Sozzani S,Locati M,et al.Macrophage polarization:tumor⁃associated macrophages as a paradigm for polarized M2 mono⁃nuclear phagocytes[J].Trends Immunol,2002,23(11):549.
[5]Gordon S,Martinez FO.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32(5):593-604.
[6]Mantovani A,Germano G,Marchesi F,et al.Cancer⁃promoting tumor⁃associated macrophages: new vistas and open questions[J].Eur J Immunol,2011,41(9):2522-2525.
[7]Sica A,Schioppa T,Mantovani A,et al.Tumour-associated macro⁃phages are a distinct M2 polarised population promoting tumour pro⁃gression: potential targets of anti-cancer therapy[J].Eur J Cancer,2006,42(6):717-727.
[8]Komohara Y,Jinushi M,Takeya M.Clinical significance of macro⁃phage heterogeneity in human malignant tumors[J].Cancer Sci,2014,105(1):1-8.
[9]Zhang Y,Wang D,Xu T,et al.Bladder cancer cells re⁃educate TAMs through lactate shuttling in the microfluidic cancer microenvi⁃ronment[J].Oncotarget,2015,6(36):39196-39210.
[10]Escribese MM,Casas M,Corbí AL.Influence of low oxygen tensions on macrophage polarization[J].Immunobiology,2012,217(12):1233-1240.
[11]Laoui D,Van Overmeire E,Di Conza G,et al.Tumor hypoxia does not drive differentiation of tumor⁃associated macrophages but rather fine⁃tunes the M2⁃like macrophage population [J].Cancer Res,2014,74(1):24-30.
[12]Colegio OR,Chu NQ,Szabo AL,et al.Functional polarization of tumour⁃associated macrophages by tumour⁃derived lactic acid [J].Nature,2014,513(7519):559-563.
[13]Hao NB,Lü MH,Fan YH,et al.Macrophages in tumor microenvi⁃ronments and the progression of tumors[J].Clin Dev Immunol,2012,2012:948098.
[14]Wang HW,Joyce JA.Alternative activation of tumor⁃associated macrophages by IL⁃4: priming for protumoral functions[J].Cell Cycle,2010,9(24):4824-4835.
[15]Caux C,Ramos RN,Prendergast GC,et al.A milestone review on how macrophages affect tumor growth [J].Cancer Res,2016,76(22):6439-6442.
[16]Zhang QW,Liu L,Gong CY,et al.Prognostic significance of tumor⁃associated macrophages in solid tumor: a meta⁃analysis of the litera⁃ture[J].Plos One,2012,7(12):e50946.
[17]Suriano F,Santini D,Perrone G,et al.Tumor associated macropha⁃ges polarization dictates the efficacy of BCG instillation in non⁃mus⁃cle invasive urothelial bladder cancer[J].J Exp Clin Cancer Res,2013,32(1):87.
[18]Boström MM,Irjala H,Mirtti T,et al.Tumor⁃associated macropha⁃ges provide significant prognostic information in urothelial bladder cancer[J].Plos One,2015,10(7):e0133552.
[19]Quail Daniela F,Joyce Johanna A.Molecular pathways: deciphering mechanisms of resistance to macrophage⁃targeted therapies[J].Clin Cancer Res,2017,23(4):876-884.
[20]Baay M,Brouwer A,Pauwels P,et al.Tumor cells and tumor⁃associ⁃ated macrophages: secreted proteins as potential targets for therapy[J].Clin Dev Immunol,2011,2011:565187.
[21]Cieslewicz M,Tang J,Yu JL,et al.Targeted delivery of proapoptot⁃ic peptides to tumor⁃associated macrophages improves survival[J].Proc Natl Acad Sci USA,2013,110(40):15919-15924.
[22]Allavena P,Signorelli M,Chieppa M,et al.Anti⁃inflammatory properties of the novel antitumor agent yondelis(trabectedin): inhi⁃bition of macrophage differentiation and cytokine production[J].Cancer Res,2005,65(7):2964-2971.
[23]Liu J,Duan X.PA⁃MSHA induces apoptosis and suppresses metasta⁃sis by tumor associated macrophages in bladder cancer cells[J].Cancer Cell Int,2017,17:76.
[24]Hirschhaeuser F,Sattler UG,Mueller⁃klieser W.Lactate: a metabolic key player in cancer[J].Cancer Res,2011,71(22):6921-6925.
[25]Lu H,Dalgard CL,Mohyeldin A,et al.Reversible inactivation of HIF⁃1 prolyl hydroxylases allows cell metabolism to control basal HIF⁃1[J].J Biol Chem,2005,280(51):41928-41939.
[26]Constant JS,Feng JJ,Zabel DD,et al.Lactate elicits vascular endothelial growth factor from macrophages:a possible alternative to hypoxia[J].Wound Repair Regen,2000,8(5):353-360.
[27]Martinez⁃Outschoorn UE,Balliet RM,Rivadeneira DB,et al.Oxidative stress in cancer associated fibroblasts drives tumor⁃stroma co⁃evolution: A new paradigm for understanding tumor metabolism,the field effect and genomic instability in cancer cells[J].Cell Cycle,2010,9(16):3256-3576.
[28]Tian YF,Tang K,Guan W,et al.OK⁃432 suppresses proliferation and metastasis by tumor associated macrophages in bladder cancer[J].Asian Pac J Cancer Prev,2015,16(11):4537-4542.
[29]Nakamoto T,Yoshimura H,Honda T,et al.Treatments for the acti⁃vating macrophages that reduces surgical stress and postoperative mortalities from bacterial infections and tumor metastases[J].In Vivo,2007,21(2):357-364.
[30]Kubota Y,Takubo K,Shimizu T,et al.M⁃CSF inhibition selectively targets pathological angiogenesis and lymphangiogenesis[J].J Exp Med,2009,206(5):1089-1102.
[31]Shiao SL,Ruffell B,DeNardo DG,et al.TH2⁃Polarized CD4(+) T cells and macrophages limit efficacy of radiotherapy[J].Cancer Immunol Res,2015,3(5):518-525.
[32]Sapi E.The role of CSF⁃1 in normal physiology of mammary gland and breast cancer: an update[J].Exp Biol Med(Maywood),2004,229(1):1-11.
[33]Pyonteck SM,Akkari L,Schuhmacher AJ,et al.CSF⁃1R inhibition alters macrophage polarization and blocks glioma progression[J].Nat Med,2013,19(10):1264-1272.
[34]Horlad H,Fujiwara Y,Takemura K,et al.Corosolic acid impairs tumor development and lung metastasis by inhibiting the immunosup⁃pressive activity of myeloid⁃derived suppressor cells[J].Mol Nutr Food Res,2013,57(6):1046-1054.
[35]Wang N,Liang H,Zen K.Molecular mechanisms that influence the macrophage m1⁃m2 polarization balance[J].Front Immunol,2014,5:614.
[36]Rolny C,Mazzone M,Tugues S,et al.HRG inhibits tumor growth and metastasis by inducing macrophage polarization and vessel normalization through downregulation of PlGF [J].Cancer Cell,2011,19(1):31-44.
[37]Prima V,Kaliberova L N,Kaliberov S,et al.COX2/mPGES1/PGE2 pathway regulates PD⁃L1 expression in tumor⁃associated mac⁃rophages and myeloid⁃derived suppressor cells[J].Proc Natl Acad Sci U S A,2017,114(5):1117-1122.
[38]Eklund L,Bry M,Alitalo K.Mouse models for studying angiogenesis and lymphangiogenesis in cancer[J].Mol Oncol,2013,7(2):259-282.
[39]Yang H,Kim C,Kim MJ,et al.Soluble vascular endothelial growth factor receptor⁃3 suppresses lymphangiogenesis and lymphatic metas⁃tasis in bladder cancer[J].Mol Cancer,2011,10:36.

