NaCl胁迫下壳寡糖对油菜苗生长的影响
丁振中,曾哲灵,龚劲松,张超,雷鹏,高小燕,徐俊山,张家宏
(1.扬州日兴生物科技股份有限公司,江苏扬州225601;2.江苏里下河地区农业科学研究所,江苏扬州 225001)
现代农业生产过程中,土壤盐渍化是影响农作物生长并造成作物产量降低最常见的非生物胁迫。据不完全统计,全世界盐渍化土地的面积已超过10亿公顷,而我国盐渍化土地超过1亿公顷[1]。土壤的盐渍化会带来严重的农作物减产甚至绝收,因此,提高作物抗盐的能力是保证我国粮食产量稳定,促进国民经济发展的重要研究方向。
近年来,生物刺激素受到越来越多的关注。欧洲生物刺激素行业委员会提出,生物刺激素用于植物或植物根际后,能通过激发植物自身的生命过程来增强植物对营养物质的吸收及利用效率或提高植物的抗非生物胁迫能力或改善作物品质,生物刺激素可以是化学物质或微生物。目前,已有一些生物聚合物被欧洲生物刺激素行业委员会认可作为生物刺激素,主要有腐植酸、几丁质、壳寡糖等[2]。然而,国内针对壳寡糖在作物抗盐方面的相关研究还比较少,基于此,本研究以油菜苗为对象,考察壳寡糖对油菜苗的抗盐效果影响,并对其增强油菜苗的抗盐机制进行初步探究。
1 材料与方法
1.1 植物材料与生长条件
以甘蓝型油菜苏油1号(油菜种子采购自江苏省农业科学院)作为研究对象,种子消毒后置于湿润的滤纸上进行催芽,约3天后,将露白的种子播种于营养土中。油菜苗生长环境为本课题组的光照培养室,控制光照时间为16 h,光培养温度控制为25℃,暗培养温度15℃,控制培养室湿度为65%。待油菜苗生长4周后,选取长势一致的油菜苗转入水培盒(34 cm×23 cm×10 cm)进行水培培养。水培时使用1/2Hoagland营养液。水培一周,待油菜苗适应水培环境后,开始施加实验处理。
1.2 胁迫实验处理
待油菜苗适应水培环境后,设计4组处理,见表1。各处理组的油菜苗除在培养液中NaCl及壳寡糖的添加量不同外,其他培养条件均相同。营养液每隔24 h按表中的处理更换一次,油菜苗施加处理后分别于第48 h、96 h、144 h取样进行各项生长及生理指标检测。本实验所有处理均设计3次重复。本研究中所用壳寡糖(COS)纯品由扬州日兴生物科技股份有限公司提供,分子量为2 kDa 。

表1 盐胁迫实验设计
1.3 生物量测定
测定油菜苗生物量时,每个处理每次取样量均不少于6株苗,用吸水纸将油菜苗根部的营养液吸干,用剪刀将油菜苗分为地上部分和地下部分,然后置于105℃烘箱中杀青30 min,随后将烘箱温度调至80℃烘干24 h,分别称取油菜苗地上部分和地下部分的干重。
1.4 油菜苗叶片中K+/Na+值测定
K+/Na+值的测定参考Gorham的方法[3]。称取1.00 g叶片组织,加入5 mL去离子水研磨成匀浆,5000 g离心15 min,上清液转移至100 mL容量瓶中定容,定容后用火焰分光光度计测定K+、Na+浓度。
1.5 丙二醛(MDA)含量测定
MDA含量的测定参考Liu等人的方法[4]。称取0.5 g叶片组织,用5%(w/v)的三氯乙酸溶液研磨成匀浆;匀浆液在12000 g条件下离心15 min,上清液与5 mL 0.5%硫代巴比妥酸溶液(用20%的三氯乙酸溶液配制)混合;混合液置于沸水中加热25 min,冷却至室温后,7500 g离心5 min。离心后测定上清液在450 nm、532 nm、600 nm波长下的吸光值。按照公式(1)计算叶片组织中MDA含量:
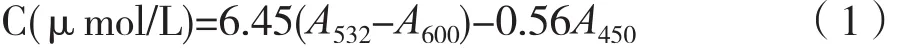
其中,C代表待测液中MDA浓度,A450、A532、A600分别代表待测液在在450 nm、532 nm、600 nm波长下的吸光值。
1.6 脯氨酸含量测定
脯氨酸含量的测定参考Bates的方法[5]。称取叶片组织0.5 g,剪成碎片置于试管内;向试管加入5 mL 3%磺基水杨酸,将试管置于沸水中浸提10 min;于试管内取2 mL上清液,与2 mL乙酸、3 mL 2.5%酸性茚三酮显色液混合后,沸水浴中加热40 min;再向上述混合反应液中加入4 mL甲苯,充分震荡后静置40 min;用移液器吸取上层甲苯层,在520 nm波长下测定吸光值。根据脯氨酸标准品在520 nm波长下吸光值绘制的标准曲线,即可计算出叶片组织中萃取的脯氨酸浓度。
1.7 抗氧化酶活力的测定
粗酶液的提取参考Abedi等的方法[6]。称取0.5 g叶片组织,在1.5 mL Tris-HCl缓冲液(pH 7.5,含5%的蔗糖和0.1%的巯基乙醇)中研磨成匀浆;4℃下离心20 min;上清液即为粗酶液,用于测定超氧化物歧化酶(SOD,EC 1.15.1.1)、过氧化氢酶(CAT,EC 1.11.1.6)和过氧化物酶(POD,EC 1.11.1.7)的活力。粗酶液蛋白含量按照Bradford的方法,即考马斯亮蓝法进行测定。
SOD活力的测定参考Abedi等的方法[6]。吸取0.1 mL上述粗酶液,与1.5 mL50 mmol/L磷酸缓冲液(pH 7.8,内含1%聚乙烯吡咯烷酮)、0.3 mL130 mmol/L甲硫氨酸溶液(用磷酸缓冲液配制)、0.3 mL750 μmol/L氮蓝四唑溶液(用磷酸缓冲液配制)、0.3 mL100 μmol/L EDTA-Na2溶液(用磷酸缓冲液配制)、0.3 mL20 μmol/L核黄素溶液(用磷酸缓冲液配制)及0.5 mL去离子水混合,将混合溶液置于4000 lx日光灯下反应20 min,反应液为样品组;以0.1 mL磷酸缓冲液替代上述混合液中的粗酶液,在4000 lx日光灯下反应20 min,反应液作为对照组;以0.1 mL磷酸缓冲液替代上述混合液中的粗酶液,在黑暗条件下反应20 min,反应液作为空白组;测定各组反应液在560 nm波长下的吸光值。SOD酶活定义为抑制50%氮蓝四唑还原所需要的酶量,SOD酶活表示为U/mgprotein。
CAT活力的测定参考Abedi等的方法[6]。用移液器分别将0.1 mL 2% H2O2和2 mL50 mmol/L磷酸缓冲液(pH 7.0,含1%聚乙烯吡咯烷酮、0.1%巯基乙醇)加入1 cm比色皿中,再加入0.1 mL粗酶液,常温下混匀,立即在240 nm波长下5 min内测定吸光值,每隔1 min读一次数,直至每分钟的吸光值降低量达到稳定。CAT的活力定义为每分钟H2O2的减少量,表示为mmol/(min·g) protein。
POD活力的测定参考Zhou和Leul的方法[7]。吸取0.1 mL粗酶液,与2.9 mL50 mmol/L磷酸缓冲液(pH 7.0,含1%聚乙烯吡咯烷酮、0.1%巯基乙醇)、0.5 mL 2%H2O2溶液、0.1 mL 2%愈创木酚溶液混合;混合液直接在470 nm波长下测定吸光值,每隔1 min记录一次,共记录5次。POD活力定义为每分钟愈创木酚的氧化量,表示为nmol/(min·mg) protein。
2 结果与讨论
2.1 NaCl胁迫下壳寡糖对油菜苗生物量的影响
NaCl胁迫下壳寡糖对油菜苗生物量影响的实验结果见表2。如表2所示,在非胁迫条件下壳寡糖能促进油菜苗的生长。处理144 h后,与CK组相比,NaCl胁迫显著抑制了油菜苗的生长,但在添加了壳寡糖的条件下(NaCl+COS组),油菜苗全植株、地上部分以及地下部分的干重比NaCl组分别显著提高了37.4%、38.8%和34.1%。结果表明,壳寡糖缓解了盐胁迫对油菜苗生长的抑制。一般来说,在高盐环境中,植物生物量的提高与其所处的生理环境有关,生物量的增加意味着植物体内的离子分布更合理,所受的活性氧(ROS)毒害更少,其自身渗透调节能力更强[8]。因此,壳寡糖能缓解盐胁迫导致的生物量降低,说明其对油菜苗的离子平衡、渗透调节、ROS清除等生理过程产生了影响。
2.2 壳寡糖对K+/Na+值的影响
在盐胁迫条件下,细胞内的K+/Na+值通常能够反映植物受到的盐伤害程度。受到NaCl胁迫时,环境中的Na+会取代K+转运进入细胞内,从而降低细胞内的K+/Na+值,过量的Na+在细胞内会对细胞产生毒害[9]。NaCl胁迫下壳寡糖对油菜苗叶片中K+/Na+值的影响如图1所示。在非胁迫条件下,壳寡糖处理(COS组)能显著提高油菜苗叶片内的K+/Na+值,特别是在施加处理96 h后。在NaCl胁迫下,油菜苗叶细胞内的K+/Na+值显著地降低,特别是在处理后144 h,NaCl组中的K+/Na+值与CK组中的K+/Na+值相比下降了97.1%。然而,在取样时间内,壳寡糖的施用(NaCl+COS组)则在一定程度上缓解了NaCl引起的K+/Na+值的降低。在144 h时,NaCl+COS组中油菜苗叶片内的K+/Na+值是NaCl组的8倍。以上结果表明,盐胁迫环境下,壳寡糖能在一定程度上缓解NaCl引起的K+/Na+值的降低。
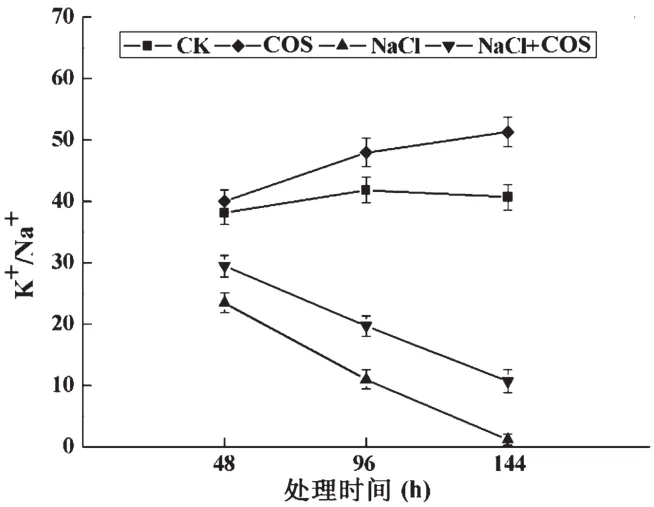
图1 NaCl胁迫下壳寡糖对油菜苗叶片中K+/Na+值的影响

表2 NaCl胁迫下壳寡糖对油菜苗全植株、地上部分和地下部分干重的影响
2.3 NaCl胁迫下壳寡糖对MDA含量的影响
高盐胁迫还会引起ROS在植物细胞内大量积累,从而进一步造成对细胞的氧化胁迫,由过剩ROS引起的膜脂氧化一般被认为是高盐胁迫对细胞的主要伤害。MDA是膜脂过氧化的产物,通常细胞内的MDA浓度能直接反映ROS对植物细胞的伤害程度[10]。壳寡糖对MDA含量的影响如图2所示。与CK组相比,COS组中油菜苗叶片内的MDA含量无显著变化。但在NaCl胁迫条件下,油菜苗叶片内的MDA含量显著提高。尽管NaCl组与NaCl+COS组中油菜苗叶片内的MDA含量均显著高于CK组,但在取样时间内,NaCl+COS组中MDA含量始终显著低于NaCl组。在144 h时,与NaCl组相比,NaCl+COS组中MDA含量减少了16.7%。以上结果表明,盐胁迫引起了油菜苗叶片中MDA含量的增加,而壳寡糖可以显著缓解盐胁迫导致的MDA含量提高,这说明,壳寡糖对盐胁迫环境下ROS的清除起着积极的作用。
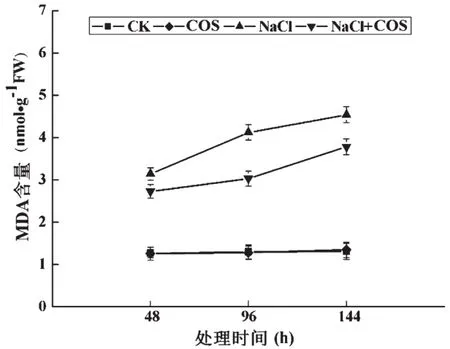
图2 NaCl胁迫下壳寡糖对油菜苗叶片中MDA含量的影响
2.4 壳寡糖对抗氧化酶活力的影响
本研究考察了壳寡糖对SOD、CAT、POD3种抗氧化酶活力的影响。这3种酶是植物体内清除过剩ROS的主要酶系,植物在受到盐胁迫后能够通过增强这3种抗氧化酶来缓解盐胁迫引起的氧化胁迫[11]。壳寡糖对抗氧化酶的影响如图3所示。在本研究中,SOD、CAT、POD具有相似的变化趋势,在非胁迫环境下,3种抗氧化酶受COS影响(COS组),其活力均呈现出上调的趋势。在NaCl胁迫环境下(NaCl组),3种酶的活力显著提高,但随着胁迫时间的延长,在144 h时,酶活呈现降低的趋势;而在使用壳寡糖后(NaCl+COS组),3种酶的酶活不仅在取样时间内显著高于NaCl组,而且在取样时间内,始终呈现高活力状态。因此,壳寡糖有助提高油菜苗叶片内的SOD、CAT、POD活力,并且在NaCl胁迫环境下这种增强效果更为显著。因此,NaCl胁迫环境下,壳寡糖能显著提高油菜苗叶片中3种抗氧化酶的活力,这说明在高盐胁迫环境中壳寡糖增强了油菜苗清除过剩ROS的能力,从而降低了膜脂的氧化程度,减少了胞内MDA的产生。
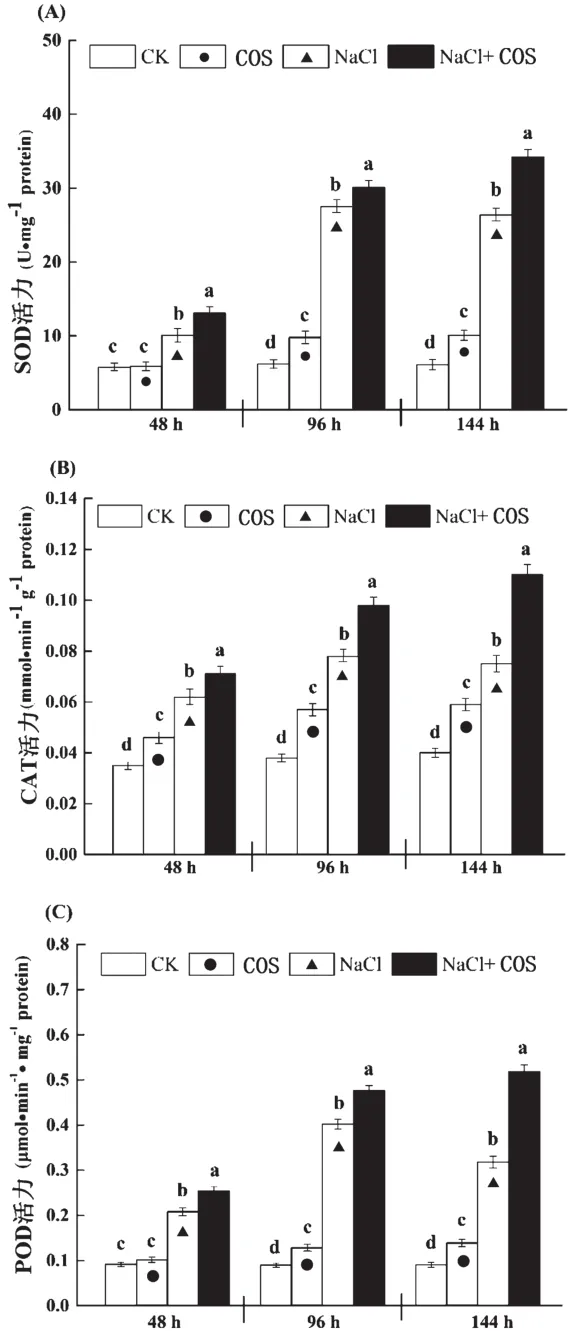
图3 NaCl胁迫下壳寡糖对油菜苗叶片中SOD(A)、CAT(B)和POD(C)活力的影响
2.5 壳寡糖对脯氨酸积累的影响
在高盐环境中,植物还会通过积累渗透调节物质来应对胁迫引发的胞内外渗透压失衡,对于大部分植物,通过在细胞内积累脯氨酸等小分子渗透调节物质是应对渗透压失衡的主要策略[12]。壳寡糖对脯氨酸的积累如图4所示。与CK组相比,COS组中油菜苗叶片内的脯氨酸含量呈明显上升趋势,特别是在施加处理96 h之后。在盐胁迫环境中,油菜苗叶片内的脯氨酸含量显著提高,并且NaCl+COS组中脯氨酸含量显著高于NaCl组,特别是在施加处理96 h后。在144 h时,NaCl+COS组中油菜苗叶片内的脯氨酸含量达到3.505 mg/g FW,比NaCl组高出36.5%。结果表明,无论是否在盐胁迫环境下,壳寡糖均能促进油菜苗叶片内脯氨酸的积累,但在盐胁迫环境中,壳寡糖使脯氨酸的积累更为显著。
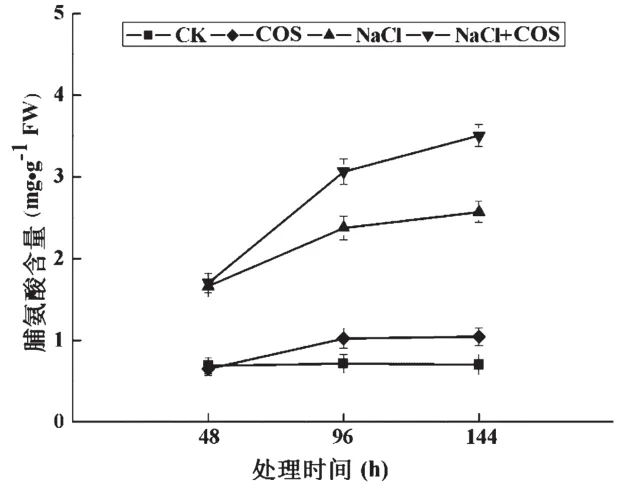
图4 NaCl胁迫下壳寡糖对油菜苗叶片中脯氨酸(proline)含量的影响
实验结果发现,壳寡糖即使在非胁迫条件下也能促进油菜苗脯氨酸的积累,而脯氨酸除了是一种小分子渗透调节物质,还能作为信号分子来调控离子平衡、稳定细胞酶活,以及启动特定基因的表达,这对植物应对高盐环境都至关重要[13]。Khedr等人发现,脯氨酸能够诱导盐胁迫相应蛋白的表达[14];Sobahan等人发现外源施用脯氨酸能够有效抑制盐胁迫环境中植物对Na+的吸收,增强植物对K+的吸收,提高细胞内的K+/Na+值[15];Yan等人报道外源施用脯氨酸还能提高SOD、CAT、POD等抗氧化酶的活力,从而降低胁迫环境中植物细胞内的ROS水平[16]。因此,笔者推测,壳寡糖能够缓解油菜苗遭受NaCl胁迫时的Na+毒害以及氧化伤害,与其促进油菜苗细胞内的脯氨酸积累有关。
3 结论
本研究以水培油菜为研究对象,考察盐胁迫条件下壳寡糖对油菜生长的影响。结果显示,NaCl显著抑制油菜苗生长,但施用了壳寡糖后,油菜苗的全植株干重、地上部分干重、地下部分干重分别提高了37.4%、38.8%和34.1%,说明壳寡糖确实能缓解盐胁迫对植物的伤害。研究还发现,100 mmol/LNaCl胁迫环境下,壳寡糖在一定程度上抑制了油菜苗细胞内K+/Na+值的降低和丙二醛(MDA)含量的增加;此外,壳寡糖增加了脯氨酸的积累,增强了抗氧化酶(SOD、CAT、POD)的活力。上述结果说明壳寡糖提高了油菜苗在盐胁迫下的渗透调节能力和ROS清除能力。考虑到壳寡糖在非胁迫条件下也能促进脯氨酸积累,本研究认为,壳寡糖激活了脯氨酸的合成途径,提高了油菜苗细胞内脯氨酸的积累量,从而增强了油菜苗盐胁迫下的耐受能力。
[1]汪泓洋.玉米苗期耐盐性状的关联分析[D].扬州:扬州大学,2016.
[2]张洪胜.生物刺激素行业发展概述[J].烟台果树,2016(2):1-3.
[3]Gorham J. Salt Tolerance in the Triticeae: K/Na Discrimination in Synthetic Hexaploid Wheats[J]. Journal of Experimental Botany,1990,41(5):623-627.
[4]Liu X, Chi H, Yue M, et al. The Regulation of Exogenous Jasmonic Acid on UV-BStress Tolerance in Wheat[J]. Journal of Plant Growth Regulation,2012,31(3):436-447.
[5]Bates L S, Waldren R P, Teare I D. Rapid Determination of Free Proline for Water-Stress Studies[J]. Plant & Soil,1973,39(1):205-207.
[6]Abedi T, Shiraz UNIV, Pakniyat H, et al. Antioxidant Enzyme Changes in Response to Drought Stress in Ten Cultivars of Oilseed Rape(Brassica napus L.) [J]. Czech Journal of Genetics and Plant Breeding -UZEI (Czech Republic),2010,46(1):27-34.
[7]Zhou W, Leul M. Uniconazole-Induced Alleviation of Freezing Injury in Relation to Changes in Hormonal Balance, Enzyme Activities and Lipid Peroxidation in Winter Rape[J]. Plant Growth Regulation,1998,26(1):41-47.
[8]林栖凤,李冠一.植物耐盐性研究进展[J].中国生物工程杂志,2000,20(2):20-25.
[9]张海军,张娜,杨荣超,等.NaCl胁迫对茄子幼苗生长和K+、Na+和Ca2+分布的影响及耐盐机理[J].中国农业大学学报,2013,18(4):77-83.
[10]汪月霞,孙国荣,王建波,等.NaCl胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J].生态学报,2006,26(1):122-129.
[11]任红旭,陈雄,王亚馥.抗旱性不同的小麦幼苗在水分和盐胁迫下抗氧化酶和多胺的变化 [J].植物生态学报,2001,25(6):709-715.
[12]赵勇,马雅琴,翁跃进.盐胁迫下小麦甜菜碱和脯氨酸含量变化[J].植物生理与分子生物学学报,2005,31(1):103-106.
[13]Szabados L, Savouré A. Proline: a Multifunctional Amino Acid[J].Trends in Plant Science,2010,15(2):89-97.
[14]Khedr AHA, Abbas MA, Wahid AAA, et al. Proline Induces the Expression of Salt-Stress-Responsive Proteins and may Improve the Adaptation of Pancratium maritimumL. to Salt-Stress[J]. Journal of Experimental Botany,2003,54(392):2553-2562.
[15]Sobahan MA, Arias CR, Okuma E, et al. Exogenous Proline and Glycinebetaine Suppress Apoplastic Flow to Reduce Na+uptake in Rice Seedlings[J]. Journal of the Agricultural Chemical Society of Japan,2009,73(9):2037-2042.
[16]Yan Z, Guo S, Shu S, et al. Effects of Proline on Photosynthesis, Root Reactive Oxygen Species (ROS) Metabolism in Two Melon Cultivars(Cucumis melo L.) under NaCl Stress[J]. African Journal of Biotechnolo gy,2011,10(80):18381-18390.

