七氟醚对单肺通气大鼠肺癌HIF-1α/EMT通路活性及侵袭力的影响
熊艳峰 赖晓红 梁桦 张涛 周桥灵 杨承祥
佛山市第一人民医院麻醉科(广东佛山528000)
肺癌是全球发生率最高的呼吸道恶性肿瘤,外科切除是治疗肺癌的主要方法之一。单肺通气(OLV)常用于肺癌手术麻醉,OLV过程中非通气侧肺组织处于低氧状态,并可上调正常大鼠肺组织HIF-1α表达[1]。研究证实,低氧环境上调缺氧诱导因子1α(HIF-1α)/上皮间质转化(EMT)通路活性后,可促进肿瘤细胞侵袭和转移[2-3]。目前,OLV对大鼠肺癌HIF-1α/EMT通路活性及侵袭力有何影响尚不明确。本研究拟探讨OLV对大鼠肺癌HIF-1α/EMT信号通路活性及侵袭力的影响,并观察七氟醚的干预效应,为临床麻醉提供参考。
1 材料与方法
1.1 大鼠肺癌模型建立 KM小鼠和SD大鼠由中山大学实验动物中心提供,生产许可证号:SCXK(粤)2011-0129。参照文献[4],Walker-256乳腺癌细胞(中国医学科学院)置于含10%胎牛血清的RMPI-1640培养液培养,制成1×107/mL细胞悬液,接种到KM小鼠腹腔(0.2 mL/只),1周内出现腹水。SD雄性大鼠,6~8周龄,体质量220~250 g。无菌注射器抽取KM小鼠Walker-256细胞腹水,生理盐水稀释后细胞计数,制成0.5×105/mL浓度。经SD大鼠尾静脉注射腹水细胞悬液,0.2 mL/只。
1.2 动物分组与处理 尾静脉注射癌细胞3周后,采用随机数字表法,将造模大鼠分为4组[n=6:对照组(C组)、双肺通气组(T组)、单肺通气组(O组)和七氟醚复合单肺通气组(SO组)]。参照文献[5],腹腔注射10%水合氯醛4 mL/kg麻醉,固定于仰卧位。气管切开后行气管内插管,O组用插管过深法将气管导管插入右侧主支气管,连接小动物呼吸机(型号:HX-l00E,成都泰盟科技有限公司)行右侧OLV 2.0 h,将气管导管退至主气管,行双肺通气0.5 h。呼吸参数设置:吸呼比=1∶1,FiO2=100%,OLV时通气频率80次/min,潮气量6 mL/kg;双肺通气时通气频率60次/min,潮气量10 mL/kg。股动脉行穿刺置管,监测HR、MAP。T组大鼠行双肺通气2.5 h。O组行右肺OLV 2.0 h、双肺通气0.5 h。SO组大鼠置于有进气口和出气口的密闭容器,进气口接入纯氧气和七氟醚挥发罐,出气口接麻醉气体监测仪(PM8060,Dräger,德国)。吸入2.6%浓度七氟醚(批号:S196L513,Baxter,美国)。通气期间,大鼠SpO2均 > 95%,PetCO2维持在35~45 mmHg。于双肺通气0.5 h时处死大鼠,所有大鼠肺表面均可见肺癌结节,证实肺癌造模成功,收集左肺。
1.3 Western blot检测 取左肺组织,显微镜下仔细分离肿瘤,Western blot法分别检测HIF-1α、Fibronectin、Vimentin的蛋白表达。
1.4 RT-PCR检测 按照试剂盒(Invitrogen公司,美国)操作步骤,TRIzol法抽提肺肿瘤总RNA,应用UV-2000分光光度计(UNIKO公司,美国)评估样品RNA的纯度,反转录合成cDNA。建立PCR反应体系。MMP-2上游引物:5′-ACAAGTGGTCCGCGTAAAGT-3′,下游引物:5′-GTAAACAAGGCTTCATGGGGG-3′;MMP-9上游引物:5′-CATTCGCGTGGATAAGGAGT-3′,下游引物:5′-ACCTGGTTCACCTCATGGTC-3′;GAPDH 上游引物:5′-CCAATGTGTCCGTCGCGTGGATCT-3′,下游引物:5′-GTTGAAGTCGCAGGAGACAACC-3′。采用荧光定量PCR仪(Bio-Rad公司,美国)测定Ct值,采用2-ΔΔCt法计算目的基因的表达水平。
1.5 统计学方法 采用SPSS 14.0统计学软件进行分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 4 组HIF-1α、Vimentin、Fibronectin比较与C组、T组比较,O组、SO组HIF-1α、Vimentin、Fibronectin蛋白表达水平升高(P<0.05);与O组比较,SO组HIF-1α、Vimentin、Fibronectin蛋白表达水平降低(P<0.05);C组和T组的HIF-1α、Vimentin、Fibronectin蛋白表达水平比较无统计学差异(P>0.05),见表1和图1。
表1 4组HIF-1α、Vimentin、Fibronectin蛋白表达比较Tab.1 The comparison of protein levels of HIF-1α,Vimentin and Fibronectin(n=6) ± s,%
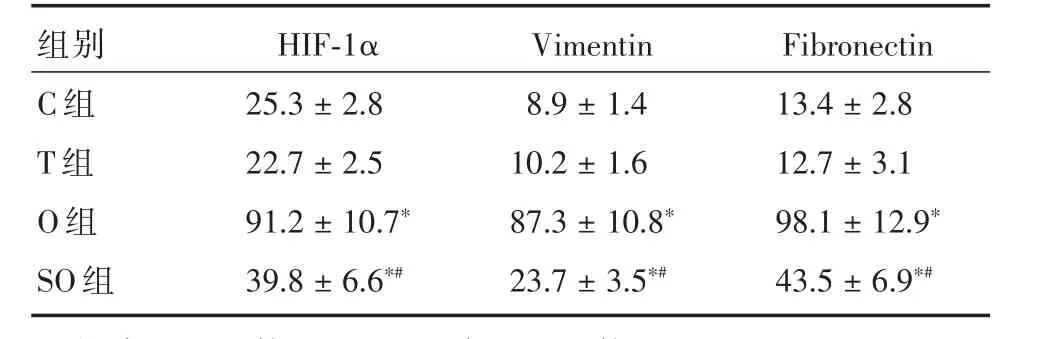
表1 4组HIF-1α、Vimentin、Fibronectin蛋白表达比较Tab.1 The comparison of protein levels of HIF-1α,Vimentin and Fibronectin(n=6) ± s,%
注:与C组比较,*P<0.05;与O组比较,#P<0.05
组别C组T组O组SO组HIF-1α 25.3±2.8 22.7±2.5 91.2±10.7*39.8±6.6*#Vimentin 8.9±1.4 10.2±1.6 87.3±10.8*23.7±3.5*#Fibronectin 13.4±2.8 12.7±3.1 98.1±12.9*43.5±6.9*#

图1 4组大鼠肺癌组织HIF-1α、Vimentin、Fibronectin蛋白印迹图Fig.1 The Western Blot of HIF-1α,Vimentin and Fibronectin in lung cancer of rats
2.2 4 组MMP-2和MMP-9表达的比较 与C组和T组比较,O组、SO组MMP-2、MMP-9 mRNA表达水平升高(P<0.05);与O组比较,SO组MMP-2、MMP-9 mRNA表达水平降低(P<0.05);C组和T组的MMP-2和MMP-9表达水平比较无统计学差异(P>0.05),见表2。
3 讨论
HIF-1是由α、β亚基构成一种低氧信号传递因子。低氧环境诱导HIF-1α稳定表达,与HIF-1β形成二聚体后转位到细胞核,参与调控肿瘤细胞增殖和转移。EMT是指上皮细胞失去上皮特性获得间质细胞表型和主动转移特性的一种生物学现象,在肿瘤转移过程中起重要作用。肿瘤低氧微环境诱导产生HIF-1α,后者可直接调控与EMT过程有关的基因,促进EMT转化过程[2-3]。EMT过程中伴随间质标志蛋白Vimentin、Fibronectin上调,检测Vimentin、Fibronectin的表达水平可评价上皮间质转化[6]。MMP-2和MMP-9属于锌依赖性蛋白水解酶,能降解细胞外基质和基底膜,反映肿瘤的侵袭力[7-8]。本研究结果发现,OLV明显上调肺癌组织HIF-1α、Vimentin、Fibronectin、MMP-2和MMP-9表达水平,提示OLV可上调肺癌HIF-1α/EMT通路活性,增加肿瘤侵袭力。

表2 四组MMP-2和MMP-9表达的比较Tab.2 The comparison of levels of MMP-2 and MMP-9(n=6) x±s
笔者之前研究证实,七氟醚抑制离体肺癌细胞生长和转移能力,并可通过下调HIF-1α抑制低氧诱导的肺癌细胞生长和转移[9-10],因此本研究选择七氟醚作为干预药物。临床上七氟醚常用浓度为1~2 MAC,因此本研究选择1.5 MAC处理OLV大鼠。本研究发现,OLV大鼠接受七氟醚处理后,肺癌组织HIF-1α、Vimentin、Fibronectin、MMP-2和MMP-9表达水平下调,提示七氟醚可抑制OLV上调肺癌HIF-1α/EMT通路活性和侵袭力的作用。
肿瘤细胞在手术期间播散进入循环系统成为循环肿瘤细胞是导致术后肿瘤复发或远处转移的重要原因[11-12]。EMT是产生循环肿瘤细胞的重要途径[13-15]。本研究结果提示,OLV有可能增加肿瘤细胞在手术期间血循环播散的风险。但本研究属于基础研究,无外科手术介入,未能充分模拟临床。七氟醚和OLV对肺癌患者外科手术期间肿瘤细胞侵袭性的影响还有待进一步研究。
综上所述,OLV上调大鼠肺癌HIF-1α/EMT通路活性及侵袭力,七氟醚可抑制OLV上调大鼠肺癌HIF-1α/EMT号通路活性及侵袭力的作用。
[1]LIN F,PAN L H,RUAN L,et al.Differential expression of HIF-1α,AQP-1,and VEGF under acute hypoxic conditions in the non-ventilated lung of a one-lung ventilation rat model[J].Life Sci,2015,124(124):50-55.
[2]YANG S W,ZHANG Z G,HAO Y X,et al.HIF-1α induces the epithelial-mesenchymal transition in gastric cancer stem cells through the Snail pathway[J].Oncotarget,2017,8(6):9535-9545.
[3]SHAIKH D,ZHOU Q,CHEN T,et al.cAMP-dependent protein kinase is essential for hypoxia-mediated epithelial-mesenchymal transition,migration,and invasion in lung cancer cells[J].Cell Signal,2012,24(12):2396-2406.
[4]黄文革,李婕,陈凤英,等.大鼠Walker256移植性肺癌模型的建立[J].中国比较医学杂志,2012,22(4):64-67.
[5]LEITE C F,CALIXTO M C,TORO I F,et al.Characterization of pulmonary and systemic inflammatory responses produced by lung re-expansion after one-lung ventilation[J].J Cardiothorac Vasc Anesth,2012,26(3):427-432.
[6]RIBATTI D.Epithelial-mesenchymal transition in morphogenesis,cancer progression and angiogenesis[J].Exp Cell Res,2017,353(1):1-5.
[7]LEE W,NAM J H,CHO H J,et al.Epimedium koreanum Nakai inhibits PMA-induced cancer cell migration and invasion by modulating NF-κB/MMP-9 signaling in monomorphic malignant human glioma cells[J].Oncol Rep,2017,38(6):3619-3631.
[8]徐枫,黄琼,张涛,等.异氟醚和七氟醚麻醉患者血清对人肺腺癌A549细胞侵袭和迁移能力的影响[J].实用医学杂志,2016,32(20):3432-3434.
[9]LIANG H,YANG C X,ZHANG B,et al.Sevoflurane suppresses hypoxia-induced growth and metastasis of lung cancer cells via inhibiting hypoxia-inducible factor-1α[J].J Anesth,2015,29(6):821-830.
[10]LIANG H,WANG H B,LIU H Z,et al.The effects of combined treatment with sevoflurane and cisplatin on growth and invasion of human adenocarcinoma cell line A549[J].Biomed Pharmacother,2013,67(6):503-509.
[11]PESTA M,FICHTL J,KULDA V,et al.Monitoring of circulating tumor cells in patients undergoing surgery for hepatic metastases from colorectal cancer[J].Anticancer Res,2013,33(5):2239-2243.
[12]BAYARRI-LARA C,ORTEGA F G,CUETO LADRÓN DE GUEVARA A,et al.Circulating tumor cells identify early recurrence in patients with Non-Small cell lung cancer undergoing radical resection[J].PLoS One,2016,11(2):e0148659.
[13]MICALIZZI D S,HABER D A,MAHESWARAN S.Cancer metastasis through the prism of epithelial-to-mesenchymal transition in circulating tumor cells[J].Mol Oncol,2017,11(7):770-780.
[14]JIE X X,ZHANG X Y,XU C J.Epithelial-to-mesenchymal transition,circulating tumor cells and cancer metastasis:Mechanisms and clinical applications[J].Oncotarget,2017,8(46):81558-81571.
[15]CHEN J,CAO S W,CAI Z,et al.Epithelial-mesenchymal transition phenotypes of circulating tumor cells correlate with the clinical stages and cancer metastasis in hepatocellular carcinoma patients[J].Cancer Biomark,2017,20(4):487-498.

