PM2.5联合中波紫外线处理对HaCaT细胞的影响
牛梦鸽 谢雄雄 王超鹏 周美娟
南方医科大学公共卫生学院放射医学系,广东省热带病研究重点实验室(广州 510515)
随着对环境污染关注,大气颗粒物(particulate matter,PM)已经成为环境质量监测的重要指标。由于PM2.5粒径小,表面积相对大,因而更容易富集环境中存在的金属离子、细菌、病毒、有机物质以及酸性氧化物等,并对人体健康造成不良影响[1]。已有相关文献报道暴露于PM2.5可以引起特异性皮炎、痤疮、湿疹等炎症性皮肤疾病以及促进皮肤老化[2-4],但具体发生机制还不明确。国内外研究证明PM2.5可以通过氧化应激产生炎症因子[5-6],进而引起细胞凋亡或者自噬。日光中的紫外线,尤其是中波紫外线(UVB),是造成人体皮肤损害最常见的环境因素之一,角质形成细胞是皮肤表皮的重要组成部分,占表皮细胞的90%,是UVB辐射的主要靶细胞。UVB作用角质形成细胞,可通过氧化应激,DNA损伤等引起其辐射损伤[7-9],甚至诱发皮肤癌[10]。暴露于外界环境中的人体皮肤是极易受到上述两种环境致伤因素的联合作用,但目前二者联合处理后对皮肤细胞的影响尚不清楚,本研究基于此,尝试性探讨了PM2.5联合UVB处理对人皮肤角质形成细胞HaCaT的影响。
1 材料与方法
1.1 实验材料 人表皮角质形成细胞HaCaT,购自武汉大学生命科学院中国典型培养物保藏中心。DMEM培养基(美国Gibco公司),0.25%Trypsin-EDTA(美国Gibco公司),新生牛血清(杭州四季青生物工程材料有限公司),DMSO(广东光华科技股份有限公司),Annexin V双标凋亡检测试剂盒(北京全式金生物公司),紫外照射源(上海顾村光电仪器厂),超声清洗器(DL-720A),冷冻真空干燥机(CHRIST 1-2LD plus),流式细胞仪器(FACS),电感耦合等离子体质谱仪(X SeriesⅡ)。
1.2 细胞培养 人表皮角质形成细胞HaCaT,在5%CO2,37℃条件下,用含体积分数为10%的小牛血清、100 kU/L青霉素、100 mg/L链霉素的DMEM培养基中培养,取对数生长期细胞进行实验。
1.3 处理方法
1.3.1 PM2.5悬液制备及成分分析 PM2.5采样滤膜来自2016年11月23日广州地区采集72 h的样品。将采样滤膜剪成1 cm×4 cm大小,浸入50 mL超纯水中,超声处理1 h,用洁净扁圆头镊子单向反复轻刮擦滤膜表面,至滤膜由黑色转变为浅白色,制备成悬液,悬液经6~8层纱布过滤后分装于玻璃瓶中置于-80℃冰箱过夜。样品置于真空冷冻干燥器进行冷冻干燥处理,待其水分蒸发后可得干燥灰色絮状物,称重容器内获取的絮状物重量,加入相应体积的PBS配制成终浓度为5 mg/mL的PM2.5储备液,高压灭菌后-20℃保存,使用时用完全培养基配制成相应的浓度。
1.3.2 细胞分组与处理 将细胞分为空白对照组(NC组)、单纯IC50浓度的PM2.5处理组(PM2.5组)、单纯30 mJ/cm2的UVB照射组(UVB组)和PM2.5联合UVB处理组(联合处理组)。将HaCaT细胞消化后制成105个/mL细胞悬液,并按一定细胞数量分别接种于96孔板、6 cm培养皿,培养24 h后,各组分别用PBS清洗3次后进行相应处理。UVB组和联合处理组置于距离UVB紫外光辐射源(光源波长为305 nm,功率密度0.165 mW/cm2,辐照剂量=辐射密度×辐射时间)40 cm的紫外光源箱体指定位置,累计照射剂量达30 mJ/cm2,对照组和PM2.5组给予同等条件下假照射,即除不照射UVB外,其余处理过程均与UVB组和联合处理组一致。照射完毕后对照组和UVB组分别加入完全培养基,PM2.5组和联合处理组分别加入含PM2.5质量浓度为300 μg/mL的完全培养基,所有组别细胞处理完毕后均置于5%CO2,37℃恒温培养箱中继续培养24 h后收集细胞,进行后续实验。
1.3.3 MTT法检测 取对数生长期的细胞,消化离心收集后,调整细胞悬液浓度为1×105个/mL,接种于96孔板中,每孔加入100 μL,将96孔板置于5%CO2,37℃恒温培养箱中培养24 h后加入不同浓度的PM2.5悬液,终浓度为5、10、25、50、100、200、400 μg/mL,每个浓度设5个复孔。染毒24 h后弃上清,清洗3次后每孔加入20 μL MTT溶液(5 mg/mL),置于培养箱继续培养4 h后每孔加入150 μL DMSO,在酶联免疫检测仪振荡10 min,测量OD570nm处各孔的吸光值;细胞存活率=(检测组OD-空白孔OD)/(对照组OD-空白孔OD)×100%。实验重复3次。
1.3.4 流式细胞术测细胞凋亡 细胞完成处理后收集细胞,加入50 μL预冷的1×Annexin V Binding Buffer重悬细胞,加入2.5 μL Annexin V-FITC 和2.5 μLPI,轻轻混匀,室温避光反应 15 min,加入200 μL预冷的1×Annexin V Binding Buffer,轻轻混匀,冰上避光放置,1 h内流式细胞仪上机检测。实验重复3次。
1.3.5 蛋白免疫印迹实验 细胞接受各处理24 h后收集细胞提取蛋白,BCA试剂盒测定蛋白浓度,SDS-PAGE电泳分离,转移至硝酸纤维素膜,5%脱脂奶粉室温封闭2 h,加入一抗(1∶5 000)后4℃孵育过夜,TBST漂洗三次后加入相应的二抗(1∶5 000)室温孵育1 h,最后经ECL化学发光法显色。实验重复3次。
1.4 统计学方法 数据使用SPSS 20.0软件进行统计分析。定量资料经检验服从正态分布采用均数±标准差进行描述,多个样本进行比较采用单因素方差分析,方差齐性时采用LSD法,方差不齐时采用Dunnett-T3法。检验水准α=0.05。
2 结果
2.1 PM2.5样品金属成分鉴定 电感耦合等离子体质谱仪检测样品中金属所占含量由多到少依次为:Ca、Zn、Ba、Al、Mg、Cu、Pb、Mn,其余测出的金属含量均低于0.50 mg/L,故未列出(表1)。

表1 在PM2.5样品中检测金属成分含量Tab.1 Detection of metal components in the sample PM2.5
2.2 不同浓度(0、5、10、25、50、100、200、400 μg/mL)的PM2.5处理HaCaT细胞的IC50的分析 在0~400 μg/mL范围内,PM2.5处理细胞24 h后对细胞活力的抑制呈剂量依赖性地上升趋势。见图1。不同浓度的PM2.5对细胞活力的抑制趋势变化符合对数方程y=6.905 5ln()+10.351,R2=0.975,计算出PM2.5的IC50约为300 μg/mL。
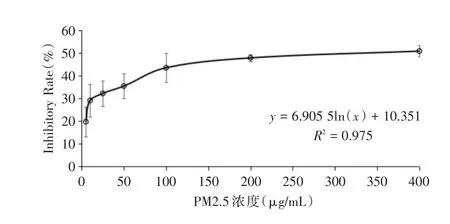
图1 不同浓度的PM2.5处理HaCaT细胞对细胞活力的影响Fig.1 The effect of PM2.5 treatment with different concentrations on the inhibition of cell viability in HaCaT
2.3 PM2.5处理HaCaT细胞后细胞活力随时间的变化趋势 在不同时间点(0、3、9、12、15、18、24 h),PM2.5对细胞活力的抑制总体呈现逐渐上升趋势,其中,在处理后3 h,对细胞活力的抑制率可达30%,随后对细胞活力的抑制呈缓慢上升趋势。见图2。
2.4 NC组、PM2.5组、UVB组以及联合处理组HaCaT细胞的细胞形态及活力变化 各组在接受相应处理后24 h,NC组的HaCaT细胞呈梭形,细胞紧凑排列,边界清晰,PM2.5组和UVB组细胞均呈现形态皱缩、细胞有变圆变亮的情况,联合处理组表现更为明显,出现细胞间隙变大,细胞完全失去正常形态。见图3。MTT结果显示:与NC组比,PM2.5、UVB及联合处理24 h后细胞活力被抑制,差异显著(P<0.001),两两比较结果分析,联合处理组细胞活力最低,差异有统计学意义(P<0.001),显示PM2.5与UVB照射联合处理对抑制细胞活力有协同作用。见图4。

图2 PM2.5对HaCaT细胞活力的抑制在不同时间点的变化Fig.2 The inhibitory changes of cell viability at different time points after the treatment with PM2.5 in HaCaT
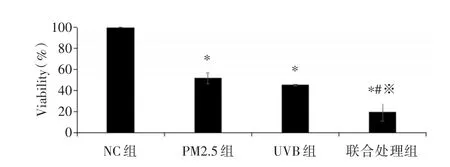
图4 NC组、PM2.5组、UVB组以及联合处理组作用HaCaT后细胞活力变化Fig.4 The changes of cell viability after the treatment of NC,PM2.5,UVB and the combined group in HaCaT
2.5 NC组、PM2.5组、UVB组以及联合处理组HaCaT细胞的凋亡变化 流式细胞术观察不同因素处理情况下细胞凋亡率的变化:结果显示各组之间有差异(P<0.05),其顺序依次为UVB组>PM2.5+UVB组>PM2.5组>NC组。两两比较的结果显示,与NC组相比,单独UVB或PM2.5处理以及联合处理,均能增加细胞的细胞凋亡率(P<0.01)。但联合处理组的细胞凋亡率又介于单纯的PM2.5处理组和单纯UVB照射组之间(P<0.05)。见图5、表2。
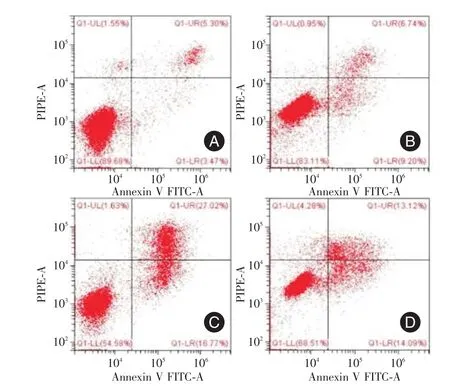
图5 流式检测NC组、PM2.5组、UVB组以及联合处理组细胞凋亡变化Fig.5 Flow cytometry was used to detect the changes of apoptosis of HaCaT in NC,PM2.5,UVB and the combined group
表2 流式检测NC组、PM2.5组、UVB组以及联合处理组细胞凋亡百分比Tab.2 Flow cytometry was used to detect the percentage of apoptosisof HaCaT in NC,PM2.5,UVB and the combined group(n=3)±s
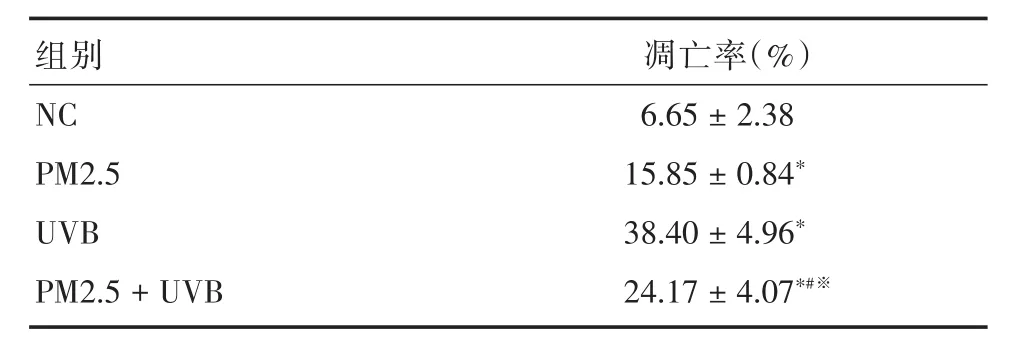
表2 流式检测NC组、PM2.5组、UVB组以及联合处理组细胞凋亡百分比Tab.2 Flow cytometry was used to detect the percentage of apoptosisof HaCaT in NC,PM2.5,UVB and the combined group(n=3)±s
注:与NC组比较,*P <0.01;与PM2.5比较,#P <0.05;与UVB比较,※P<0.01
组别NC PM2.5 UVB PM2.5+UVB凋亡率(%)6.65±2.38 15.85±0.84*38.40±4.96*24.17±4.07*#※
2.6 NC组、PM2.5组、UVB组以及联合处理组HaCaT细胞凋亡蛋白及自噬蛋白变化 与NC组相比,凋亡标志蛋白PARP剪切体在PM2.5组、UVB组以及联合处理组均增加,UVB组高于PM2.5组,联合处理后较UVB组降低。与NC组相比,LC3-Ⅱ表达在PM2.5组、UVB组以及联合处理组均增加,联合处理组最多,PM2.5组其次,UVB组最少。见图6。

图6 NC组、PM2.5组、UVB组、以及联合处理组HaCaT细胞蛋白表达变化Fig.6 The changes of protein of HaCaT in NC,PM2.5,UVB and the combined group
3 讨论
随着我国工业化进程加快,环境污染日益加剧,空气污染成为我国各个地区担心的首要问题。在众多空气污染物中,PM2.5对人体健康的危害最严重。大量国内外流行病学研究已经报道了PM2.5对人体健康的危害,但这些研究多集中在PM2.5对呼吸系统、心血管系统造成的危害[11]。近年来人们开始意识到PM2.5对皮肤系统的影响,但具体作用还不明确,关于PM2.5对HaCaT细胞的研究更少。臭氧空洞的形成,对太阳辐射的吸收减少,照射到地面的太阳光紫外线增加,使得人们接受到更多紫外辐射。而在现实生活中,人体皮肤同时会受到PM2.5、UVB两种因素的联合损伤。有研究表明UVB诱导氧化应激、细胞凋亡等对细胞造成损伤;PM2.5作用于HaCaT细胞后,产生炎症因子诱导细胞凋亡与自噬[6,12]。但尚未有研究涉及二者的联合作用后对细胞凋亡、自噬的影响,因此本研究尝试性分析了PM2.5、UVB以及联合处理对HaCaT细胞在细胞活力、凋亡、自噬方面的影响。
通过MTT实验检测不同浓度的PM2.5(0~400 μg/mL)处理细胞24 h细胞活力的变化,发现PM2.5对HaCaT细胞抑制率随着浓度的升高而增加(图1),这说明PM2.5对HaCaT细胞具有明显的毒性作用,且计算出IC50为300 μg/mL,观察到该浓度下PM2.5对细胞活力的抑制随着时间(0~24 h)的推延,抑制效果呈上升趋势(图2),表明处理时间越长,PM2.5对细胞的毒性作用越强。这和熊书晗等[13]研究的PM2.5对HaCaT细胞活力的抑制作用是一致的。与NC组比,PM2.5组、UVB组、联合处理组细胞活力均被显著抑制(P<0.001);联合处理组细胞活力小于PM2.5组、UVB组(P<0.001),这说明PM2.5、UVB二者对细胞活力的抑制具有协同作用,两者相加,会导致细胞更严重的损伤。
笔者以往的实验中,就已经明确UVB能影响细胞的功能,如DNA损伤、细胞凋亡等,本次研究发现不同处理组之间,HaCaT细胞的凋亡率依次为UVB组>联合处理组>PM2.5组>NC组,结合本研究对PM2.5金属成分的分析,发现PM2.5中含有一定量的Ca,且达到了30.55 mg/L。有研究发现皮肤中的钙离子与角质形成细胞的增殖、分化密切相关[14],高剂量UVB照射角质细胞在低钙培养基中培养时细胞发生凋亡,而在正常含钙培养基中角质细胞对UVB引起的凋亡有抗性,但细胞在高剂量UVB处理后失去增殖能力[15]。在本研究中,钙离子也可能通过上述机制,影响了细胞活力,抑制了细胞凋亡的发生。
为了进一步分析联合作用是通过何种途径发挥对HaCaT细胞活力的影响的,笔者检测了凋亡标志蛋白PARP和自噬标志蛋白LC3的表达。Western blot结果显示:除NC组外,PARP蛋白在UVB组最高,联合处理组其次,最后是PM2.5组,这与前面流式细胞术检测出的细胞凋亡趋势一致,进一步说明联合处理组中细胞凋亡被抑制了,即凋亡不是细胞活力比单纯致伤因素进一步降低的原因;而自噬标志蛋白LC3-Ⅱ的变化趋势为联合处理组>PM2.5组>UVB组>NC组,联合处理组中LC3-Ⅱ增加,这说明联合作用后PM2.5可能诱导较强的自噬增加了UVB对HaCaT细胞的损伤。但是,联合处理终究是通过哪些信号通路发挥作用的,其上下游信号通路有哪些,目前还不明确,也是笔者今后进一步研究的方向。
[1]ANDERSON J O,THUNDIYIL J G,STOLBACH A.Clearing the air:a review of the effects of particulate matter air pollution on human health[J].J Med Toxicol,2012,8(2):166-175.
[2]KIM K E,CHO D,PARK H J.Air pollution and skin diseases:Adverse effects of air borne particulate matter on various skin diseases[J].Life Sci,2016,152:126-34.
[3]NGOC L T N,PARK D,LEE Y,et al.Systematic review and meta-analysis of human skin diseases due to particulate matter[J].Int J Environ Res Public Health,2017,14(12):1458.
[4]AHN K.The role of air pollutants in atopic dermatitis[J].J Allergy Clin Immunol,2014,134(5):993-999.
[5]ZHANG Y,ZHENG L,TUO J.Analysis of PM2.5-induced cytotoxicity in human HaCaT cells based on a microfluidic system[J].Toxicol in Vitro,2017,43:1-8.
[6]LI Q,KANG Z,JIANG S,et al.Effects of ambient fine particles PM2.5 on human HaCaT cells[J].Int J Environ Res Public Health,2017,14(1):72.
[7]ZHANG D,LU C,YU Z,et al.Echinacoside alleviates UVB Irradiation-mediated skin damage via inhibition of oxidative stress,DNA damage,and apoptosis[J].Oxid Med Cell Longev,2017,2017(3):1-15.
[8]NICHOLS J A,KATIYAR S K.Skin photoprotection by natural polyphenols:anti-inflammatory,antioxidant and DNA repair mechanisms[J].Arch Dermatol Res,2010,302(2):71-83.
[9]刘红霞,周良,丁振华.紫外线对皮肤角质形成细胞DNA的损伤效应以及白藜芦醇的保护作用[J].实用医学杂志,2015,31(23):3822-3825.
[10]MANCEBO S E,WANG S Q.Skin cancer:role of ultraviolet radiation in carcinogenesis[J].Rev Environ Health,2014,29(3):265.
[11]POPE C A,BURNETT R T,THUN M J,et al.Lung cancer,cardiopulmonary mortality,and long-term exposure to fine particulate air pollution[J].JAMA,2002,287(9):1132-1141.
[12]盛晚香,张丽芳,吴剑波,等.PM2.5对人皮肤角质形成细胞自噬水平的影响[J].中国皮肤性病学杂志,2017,31(7):723-726.
[13]熊书晗,武月婷,孟繁竹,等.PM2.5对HaCaT细胞的损伤作用及机制研究[J].医学临床研究,2017,34(10):1900-1903.
[14]BIKLE D D,XIE Z,TU C L.Calcium regulation of keratinocyte differentiation [J].Expert Rev of Endocrinol Metab,2014,7(4):461-472.
[15]KUMAR M G,HURWITZ S A,COTTON J,et al.Subphysiological concentrations of extracellular calcium sensitize normal human keratinocytes to UVB-induced apoptosis[J].Arch Dermatol Res,1999,291(1):37-46.

