利用碱处理纳米纤维素制备三维网状水凝胶的研究1
王海莹, 陈 诺, 丁 颖, 潘婷婷, 李大纲*
(南京林业大学 材料科学与工程学院,江苏 南京 210037)
纤维素是世界上最丰富的天然可再生资源之一,广泛存在于各种形式的可再生生物质材料中。由于纤维素这种天然多糖具有较好的生物相容性、生物降解性和低毒性,可广泛用于各种水凝胶的制备,应用于生物医学、医药和组织工程等。近年来,纳米纤维素(CNF)作为纤维素的一种结晶形式,由于其优良的特性(如纳米级尺寸、高比表面积、良好的亲水性、生物可降解性、高抗拉强度和刚度等),是生物质材料研究领域的热点[1-2]。至今 CNF的制备方法很多,主要包括化学法(酸解、碱处理、TEMPO催化氧化法等)、生物法(酶处理)、机械法(超细研磨、超声破碎、高压均质等)及静电纺丝法等[3-4]。
纤维素Ⅰ是天然存在的纤维素,如高等植物细胞壁中的纤维素;纤维素Ⅱ是溶液中再生或者丝光化过程得到的晶体变体。纤维素Ⅰ和纤维素Ⅱ结晶区的轴向杨氏模量分别可以达到138 GPa和88 GPa[5]。宏观状态的纤维素在碱液(NaOH)浓度为 12.5%(wt)时发生晶型结构的改变,且制得的纤维素材料具备较高的热稳定性[6-7]。经碱液处理的纤维素具备较多优良性能,如热稳定性高、吸湿性好以及酶水解效能高等优良特性[6,8-9]。目前关于不同晶型结构的纳米纤维素研究还有待探究。Dinand等[10]及Shibazaki等[11]将制得的甜菜渣纳米纤丝和细菌纤维素纳米纤丝置于10%~12%(wt)NaOH溶液中处理后,发现纳米纤丝在溶液中发生了团聚现象,很难得到均匀分散的纳米纤丝。Abe等[12-13]利用碱液处理木质纳米纤丝,发现纳米纤丝在一定浓度的碱液中发生了团聚并产生凝胶化。
本文以木粉为原料,通过化学机械法制得纳米纤维素,然后利用不同浓度的碱液对 CNF进行处理,研究 CNF在碱液中的反应行为及晶型变化,对理解纳米纤维素的晶型转化过程具有重要意义。并通过强碱处理纳米纤维素得到水凝胶,对水凝胶的收缩率、结晶结构、形貌特征和力学性能进行研究,为制备高强度CNF水凝胶的研究提供理论依据。
1 实验
1.1 材料
1.2 纳米纤维素与水凝胶的制备
纳米纤维素(CNF):自制,利用樟子松木粉为原材料,将其粉碎成60~80目用于制备CNF。
1.2.1 纳米纤维素的制备
先利用化学法对木粉进行酸碱处理,脱除其中的木质素及大部分半纤维素,得到纯化纤维素,再利用机械法(一次研磨法)将纯化纤维素研磨成CNF。
化学法:利用1%(wt)亚氯酸钠在酸性条件下脱除木质素:将样品置于水浴75℃条件下处理3 h,其间每隔1 h加入1%(wt)的亚氯酸钠和适量冰醋酸,保持溶液pH在4~5。再用5%(wt)氢氧化钾脱除其中大部分半纤维素:该过程需将样品置于5%(wt)氢氧化钾溶液中浸泡12 h,再置于水浴锅(95℃)中搅拌处理2 h。再利用1%(wt)亚氯酸钠和适量冰醋酸脱除剩余的木质素,直至样品变白。在酸碱交替处理过程中,需用去离子水将样品清洗至pH值为中性。整个操作过程中样品始终保持在水润涨状态,以防止纤丝间的团聚。经过以上处理步骤后所得的样品称为纯化纤维素。
机械法:将纯化纤维素加水稀释配制成的水悬浊液,浓度为0.8%(wt),搅拌均匀后将其移至石臼超细研磨机中(MKCA6-3,Masuko Sangyo 公司,日本)研磨;转速设定为1 500 r/min,调节到合适的刻度,经一次研磨后即得到CNF悬浮液,如图1所示。
1.2.2 纳米纤维素水凝胶的制备
配置0.2%(wt)的CNF溶液,搅拌均匀之后,倒入直径为7.4 cm的砂芯漏斗中(砂芯漏斗中预先铺一张孔径≤0.22 μm的微孔滤膜),通过真空泵抽滤至不滴水状态;从砂芯漏斗中取出样品,得到CNF湿膜,膜的厚度控制在0.3 mm左右。将得到的CNF湿膜样品分别浸泡在不同浓度的NaOH溶液中[6%、9%、12%、15%、18%、21%(wt)] 12 h。然后将样品取出,用去离子水清洗至pH值为中性后得到CNF水凝胶,观察其结晶结构、形貌变化,并测试其力学性能。如图2所示为18%(wt)NaOH处理后的CNF水凝胶,经烘箱干燥,测得其水分含量为86.8 %。

图1 一次研磨后的CNF

图2 NaOH [18 %(wt)] 处理后的CNF水凝胶
1.3 分析与测试
α-纤维素含量的测定:精确称取干燥后的纯化纤维素或CNF样品1 g(精确到0.001 g),在温度20℃下,将样品放入17.5% NaOH溶液中静置处理45 min;稀释后将其倒入坩埚中,用去离子水洗去已溶解的物质直到溶液PH值至中性,其中未被溶解的剩余物即为α-纤维素;将其移入烘箱中进行烘干至恒重(105℃,12 h)。纯化纤维素和CNF的样品各取5组,数据取平均值。
水凝胶直径收缩率的测定:将浓度为0.2%的CNF溶液通过真空泵抽滤成直径为7.4 cm的CNF湿膜,然后将其浸泡在不同浓度的NaOH溶液中12 h,得到CNF水凝胶,并测定CNF水凝胶在碱处理前后直径的变化,计算水凝胶的直径收缩率(直径收缩率=直径变化量/原直径)。
X-射线衍射(XRD)分析:采用XRD分析CNF在NaOH溶液处理前后的结晶结构变化,管电压为40 kV,管电流为30 mA。测试采用铜靶,扫描速度为5°/min,扫描角度范围设定为为5°到40°。
场发射扫描电镜(FE-SEM)分析:采用FE-SEM(JSM-6700F,JEOL Ltd.,Tokyo,日本)观察分析CNF及所制得的水凝胶的表面形貌特征。采用喷金仪对样品表面喷铂金,电镜的工作电压设为1.5 kV。
力学测试分析:采用万能力学试验机上测试水凝胶的拉伸性能(GMT4204,深圳市新三思材料检测有限公司,中国),将水凝胶样品裁切为矩形样条,长30 mm×6 mm(长×宽),标距是20 mm,拉伸速率设为10 mm/min,每组样品测试5次,数据取平均值。
2 结果与讨论
2.1 α-纤维素含量的测定
为表征纯化纤维素和CNF的纯度,采用17.5%(wt)NaOH溶液处理法对纯化纤维素和CNF的α-纤维素含量进行测定。根据5次测试取平均值可得纯化纤维素的α-纤维素含量是85.2%,CNF的α-纤维素含量是82.8%。
2.2 X-射线衍射(XRD)分析
自然界中的植物纤维素以纤维素Ⅰ晶型存在。将纤维素Ⅰ通过强碱NaOH溶液处理后,水洗至中性得到纤维素Ⅱ。本文利用XRD分析碱处理后CNF水凝胶的晶型结构变化。如图3为CNF湿膜经不同浓度碱处理12 h后所得水凝胶的XRD图谱。当碱浓度为6%(wt)时,水凝胶仍为纤维素Ⅰ晶型,主要在2θ =14.6°、16.5°和 22.5°处出现衍射峰;当碱浓度为9%(wt)时,水凝胶在2θ =12.3°和20.1°处出现了代表纤维素Ⅱ晶型的衍射峰,和纤维素Ⅰ晶型共存。当碱浓度大于12%(wt)时,在2θ =12.3°、20.1°和21.9°的位置都出现了明显的衍射峰,表明水凝胶的晶型已由纤维素Ⅰ转变为了纤维素Ⅱ。
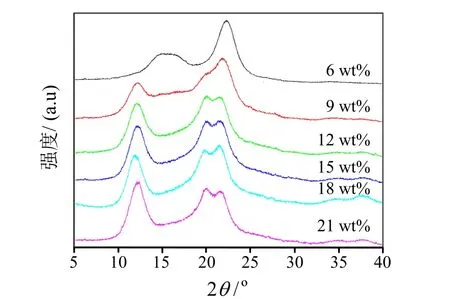
图3 不同碱浓度下CNF水凝胶的XRD图谱
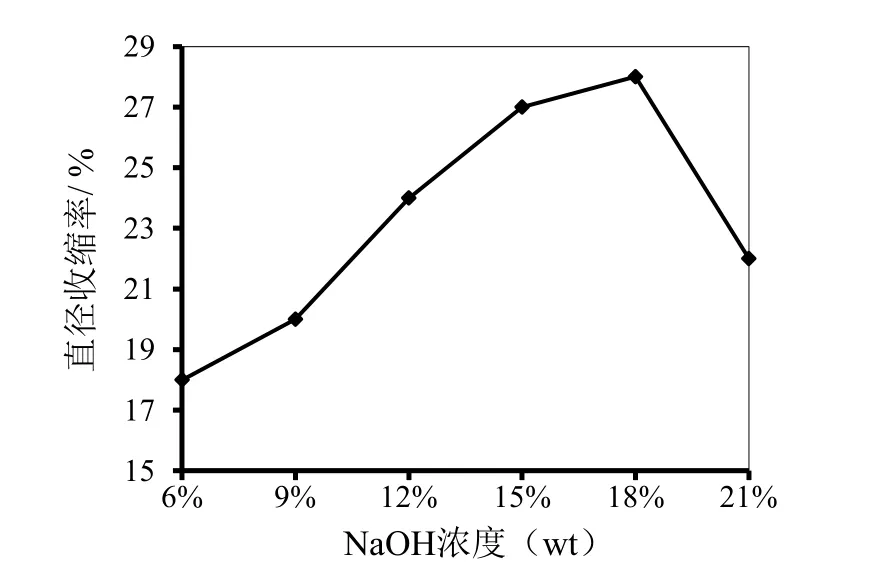
图4 水凝胶直径收缩率随碱浓度的变化图
2.3 水凝胶收缩率的测定
如图4所示为水凝胶的直径收缩率随NaOH浓度的变化情况。将得到的CNF湿膜浸泡在不同浓度的NaOH溶液中,然后测定水凝胶膜在NaOH溶液处理后直径的变化。从图中可见,CNF水凝胶随着NaOH浓度(6%~18%)的增加,会收缩的更加明显,当NaOH溶液的浓度为18%(wt)时,收缩率为28%,此时CNF水凝胶的收缩率最大;当NaOH溶液的浓度低于或高于18%(wt),水凝胶的收缩率都会减小。
2.4 场发射扫描电镜(FE-SEM)观察
如图 5a、5b为以樟子松木粉为原料,经化学处理脱除木质素和大部分半纤维素,再结合机械法(一次研磨法)所制得的CNF扫描电镜图,在超细研磨仪的高强度研磨剪切作用下,CNF有效开纤分离,如图5b,可见该法制得的CNF分散均匀,直径分布在约15~30 nm。该化学机械法制备的CNF长径比较高,一次研磨法后得率为82%。
如图6a、6b为经18%(wt)NaOH溶液处理后的CNF水凝胶表面的扫描电镜图。可见CNF湿膜经强碱处理后表面形貌发生了较大改变。纤维素Ⅱ晶型纳米纤维(CNF-Ⅱ)之间发生了团聚现象,这可能归因于CNF经过强碱以及水洗作用后,从平行链的纤维素Ⅰ晶型结构转变为反平行链的纤维素Ⅱ晶型结构(如图7),相邻的CNF之间发生了交错结合[13-14],形成了连续缠结的三维网状结构,并呈现了多孔特征。

图5 CNF的扫描电镜图

图6 NaOH [18%(wt)] 处理后的CNF水凝胶表面的扫描电镜图

图7 碱液处理纤维素的可能机理
2.5 力学性能分析
经一定浓度碱处理后,CNF之间发生交错缠结,形成三维网状结构的水凝胶,其结晶结构和形貌特征均发生了变化,且所得水凝胶还具备较好的力学性能。本文分析比较了CNF经过不同浓度NaOH溶液处理之后的水凝胶的拉伸力学性能(如图8所示),包括拉伸强度、弹性模量和断裂伸长率。

图8 a 水凝胶拉伸强度随碱浓度的变化图

图8 b 水凝胶弹性模量随碱浓度的变化图
如图8a为不同浓度NaOH处理CNF水凝胶的拉伸强度变化情况,由图可见,当NaOH浓度达到18%(wt)的时候,水凝胶的拉伸强度最大,为 4.8 MPa。但当NaOH浓度超过18%(wt)之后,水凝胶的拉伸强度出现下降。如图8b为不同浓度碱处理CNF水凝胶的弹性模量变化情况,由图可见,CNF水凝胶的弹性模量随着NaOH溶液的浓度升高而升高,NaOH溶液的浓度越高,水凝胶的弹性模量也会越大,当NaOH溶液的浓度达到18%(wt)的时候,水凝胶的弹性模量达到11.7 MPa。如图8c为不同浓度NaOH处理CNF水凝胶的断裂伸长率变化情况,由图可见,当NaOH的浓度为18%(wt)的时候,CNF水凝胶的断裂伸长率最大,为31.2%,当NaOH的浓度大于18%(wt)之后,水凝胶的断裂伸长率有所下降。
由图8可见,随着NaOH浓度的增加,水凝胶膜的力学性能基本呈上升趋势,在NaOH浓度为18%(wt)时达到最佳,浓度继续增加时拉伸强度和断裂伸长率均呈现回落状态。总结上述力学性能可知,制备高强度水凝胶的最佳NaOH浓度为18%(wt);将CNF膜浸泡在18%(wt)NaOH浓度下12 h,并水洗后可得拉伸强度为4.8 MPa,弹性模量为11.7 MPa,断裂伸长率为31.2%的高强度水凝胶。基于上述方法制得的水凝胶具有较高力学强度,且具有多孔特征。

图8 c 水凝胶断裂伸长率随碱浓度的变化图
3 结论
本文以樟子松木粉为原料,利用化学法(酸碱处理)结合机械法(一次研磨)制备了直径为15~30 nm的CNF。将浓度为0.2%的CNF溶液通过真空泵抽滤成直径为7.4 cm的CNF湿膜,然后将其浸泡在不同浓度的NaOH溶液中12 h后水洗至中性得到CNF水凝胶。
1)α-纤维素测试表明,纯化纤维素的α-纤维素含量达到85.2%,CNF的α-纤维素含量是82.8%。
2)XRD分析表明,当碱浓度为6%(wt)时,水凝胶仍为纤维素Ⅰ晶型。当碱浓度为 9%(wt)时,水凝胶出现了代表纤维素Ⅱ晶型的衍射峰,和纤维素Ⅰ晶型共存。当碱浓度大于12%(wt)时,水凝胶的晶型由纤维素Ⅰ转变成为纤维素Ⅱ。
3)FE-SEM表明,利用樟子松木粉制得的CNF直径分布在约15~30 nm,且长径比较高。CNF湿膜经强碱处理后表面形貌发生了较大改变,纤维素Ⅱ晶型纳米纤维之间发生了交错结合,呈现连续缠结的三维网状结构和多孔结构。
4)力学分析表明,制备高强度水凝胶的最佳NaOH浓度为18%(wt);将CNF膜浸泡在18%(wt)NaOH浓度下12 h后水洗至中性,可得拉伸强度为4.8 MPa,弹性模量为11.7 MPa,断裂伸长率为31.2%的高强度水凝胶。
[1]黄彪, 卢麒麟, 唐丽荣. 纳米纤维素的制备及应用研究进展[J]. 林业工程学报, 2016, 1(5): 1-9.
[2]李健昱, 徐朝阳, 周欢, 等. 多孔PVA-CNFs复合水凝胶的制备与性能[J]. 包装工程, 2016, 37(15) : 56-60.
[3] Siró I, Plackett D. Microfibrillated cellulose and new nanocomposite materials: A review[J]. Cellulose, 2010, 17(3):459-494.
[4]周静, 沈葵忠, 房桂干, 等. 漂白竹浆疏水改性纳米纤丝化纤维素的制备和表征[J]. 林业工程学报, 2017, 2(2):101-106.
[5] Nishino T, Takano K, Nakamae K. Elastic modulus of the crystalline regions of cellulose polymorphs[J]. J Polym Sci, Part A:Polym Chem, 1995, 33: 1647-1651.
[6] Wang H, Li D, Yano H, et al. Preparation of tough cellulose Ⅱ nanofibers with high thermal stability from wood[J]. Cellulose,2014, 21(3): 1505-1515.
[7]金二锁, 杨芳, 朱阳阳, 等. 碱处理后纤维素纳米晶体的XRD、FT-IR和XPS分析[J]. 纤维素科学与技术, 2016, 24(3):1-5.
[8] Mittal A, Katahira R, Himmel M E, et al. Effects of alkaline or liquid-ammonia treatment on crystalline cellulose: Changes in crystalline structure and effects on enzymatic digestibility[J]. Biotechnol Biofuels, 2011, 4: 41.
[9]刘锡华. 高档纯棉针织品的双丝光工艺研究[J]. 染整技术, 2002(4): 76-77.
[10] Dinand E, Vignon M, Chanzy H, et al. Mercerization of primary wall cellulose and its implication for the conversion of celluloseⅠ→celluloseⅡ[J]. Cellulose, 2002, 9: 7-18.
[11] Shibazaki H, Kuga S, Okano T. Mercerization and acid hydrolysis of bacterial cellulose[J]. Cellulose,1997, 4: 75-87.
[12] Abe K, Yano H. Formation of hydrogels from cellulose nanofibers[J]. Carbohydrate Polymers. 2011, 85: 733-737.
[13] Abe K, Yano H. Cellulose nanofiber-based hydrogels with high mechanical strength[J]. Cellulose, 2012, 19:1907-1912.
[14] Okano T, Sarko A. Mercerization of cellulose. Ⅱ. Alkali-cellulose intermediates and a possible mercerization mechanism[J]. J Appl Polym Sci, 1985, 30: 325-332.

