长期保护性耕作对丛枝菌根真菌多样性的影响*
张贵云, 张丽萍, 魏明峰, 刘 珍, 范巧兰, 吕贝贝, 姚 众, 柴跃进
长期保护性耕作对丛枝菌根真菌多样性的影响*
张贵云1, 张丽萍1**, 魏明峰1, 刘 珍1, 范巧兰1, 吕贝贝1, 姚 众1, 柴跃进2
(1. 山西省农业科学院棉花研究所 运城 044000; 2. 山西省临汾市农机局 临汾 041000)
为了明确我国北方干旱地区长期保护性耕作以及深松对丛枝菌根真菌(AMF)多样性的影响, 笔者于2014年在山西省临汾市连续22年实施保护性耕作的长期定位试验基地, 针对免耕覆盖(NTS)、深松免耕覆盖(SNTS)及传统耕作(TT)3种处理方式, 进行了不同耕作条件下土壤AMF物种丰度、孢子密度、Shannon多样性指数以及AMF侵染率等因素的比较研究。结果显示, 长期保护性耕作(NTS和SNTS)共分离鉴定出AMF 7属9种, 其中根孢囊霉属()和斗管囊霉属()各2种, 球囊霉属()、近明球囊霉属()、无梗囊霉属()、硬囊霉属()和隔球囊霉属()各1种; 而传统耕作(TT)共分离鉴定出AMF 6属8种, 没有检测到无梗囊霉属。NTS、SNTS和TT处理在不同土层的AMF优势种基本一致, 0~40 cm土层为摩西斗管囊霉()和变形球囊霉(), 40~80 cm土层为摩西斗管囊霉、变形球囊霉和聚丛根孢囊霉(), 80~120 cm土层为聚丛根孢囊霉, 120 cm土层以下只有NTS和SNTS处理中存在聚丛根孢囊霉, 说明保护性耕作措施促进了AMF向土壤深层发展。NTS和SNTS处理在同一土层的AMF物种丰度、孢子密度和Shannon多样性指数均高于TT处理, SNTS处理高于NTS处理。同一耕作措施不同土层的AMF物种丰度、孢子密度和Shannon多样性指数均随土层加深而逐渐降低; NTS和SNTS处理在小麦各生育期的丛枝侵染率和孢子密度均高于TT处理; 各处理在小麦拔节期的AMF侵染率最高, 分别为14.9%、16.1%和10.6%, 而在收获期的土壤孢子密度最高, 分别为111.7个∙(100g)-1、125.0个∙(100g)-1和90.3 个∙(100g)-1。研究认为, 长期免耕覆盖、尤其深松免耕覆盖, 提高了AMF多样性。该研究结果可为中国北方旱作农田生态系统中AMF自然潜力的充分发挥, 以及保护性耕作技术的合理应用提供科学依据。
丛枝菌根真菌(AMF); 免耕深松; 物种丰度; 多样性; 侵染率; 孢子密度
丛枝菌根真菌(AMF)在改善植物营养、提高植物多样性和生态系统稳定性等方面发挥着不可替代的作用[1-4]。农业生态系统中AMF多样性丰富, 并以独特的群落结构发挥其功能[5]。农田AMF多样性受相关农业管理措施, 如耕作方式、种植模式以及施肥施药等因素的影响[6-10]。
保护性耕作是以秸秆覆盖还田、农田免耕或少耕播种、施肥等复式作业为主要内容的一种全新的先进旱作机械化耕作方式[11]。与传统清耕方式相比, 保护性耕作不仅省工、省力、少投入, 还可以减少水土流失, 保持土层结构, 改善土壤理化性质, 进而促进微生物繁殖[12-14]。研究表明, 保护性耕作和传统耕作土壤中, AMF的物种丰富度和群落结构存在差异[15], 免耕可以增加AMF的物种丰度[16], 促进AMF侵染, 提高AMF产孢量, 进而提高作物产量[17]。而传统耕作措施则可在一定程度上改变AMF的群落结构, 导致AMF一些潜在生态功能的丧失[18]。国内外相关研究文献显示, 保护性耕作措施实施时间的长短, 对AMF多样性及其功能的影响有所不同。胡君利等[19]通过对3年保护性耕作农田的研究发现, 与翻耕处理相比, 免耕处理可使AMF物种总数升高, 但Shannon多样性指数与均匀度指数均没有稳定的变化规律; 高萍等[20]对14年的免耕及其他3种处理方式下AM真菌多样性进行研究, 发现免耕处理下土壤中的AMF多样性最高, 耕作处理下的AMF多样性最低, 4种耕作处理中AMF的群落组成丰富度大小依次表现为: 免耕>免耕+秸秆覆盖>耕作+秸秆覆盖>耕作。实施保护性耕作长达20年以上的农田生态系统中的AM真菌多样性如何, 目前尚鲜见报道。
保护性耕作技术是适应中国北方农业发展的一种新型耕作技术, 但如果长期单纯实施免耕措施, 会出现土壤变硬, 容重增大, 水分和养分减少, 作物根系发育不良等问题[21]。深松是利用深松铲, 疏松土壤, 加深耕层而不翻转土壤, 从而有效改善土壤结构, 提高土壤蓄水抗旱的能力[22]。由此, 保护性耕作技术实施过程中, 结合深松作业可以消除因多年免耕出现的土壤变硬问题。目前, 国内外学者已对深松技术及其应用效果进行了大量研究报道: Cresswell等[23]开展了深松对土壤水分保持及特性的研究; 何进等[24]开展了中国北方保护性耕作条件下深松效应与经济效益研究; 何润兵等[25]通过研究深松对土壤理化性质和冬小麦()生长特性的影响, 发现与免耕处理相比, 免耕+深松处理在20~40 cm土层内的土壤容重平均降低约2.9%, 收获期10~30 cm土层土壤含水量提高1.7%~3.8%。但至今为止, 尚少见长期深松或免耕+深松技术对土壤AMF多样性的影响研究报道。
为了明确我国北方干旱地区长期保护性耕作以及深松对AMF多样性的影响, 笔者于2014年以山西省临汾市实施保护性耕作22年的旱地小麦田[26]为试验平台, 开展了长期保护性耕作对AMF多样性的影响研究, 旨在从菌根微生态技术角度评价长期保护性耕作与免耕深松对AMF多样性的影响, 为AMF在中国北方农田生态系统中自然潜力的充分发挥提供科学依据, 为保护性耕作技术在农业生产中的合理应用提供理论支撑。
1 材料与方法
1.1 研究区概况
试验地位于山西省临汾市尧都区城隍村(36°01¢53²N, 111°37¢46²E), 海拔555 m, 试验区内年平均气温12.2 ℃, 年≥0 ℃积温4 600 ℃, 无霜期195 d, 年平均地温13.8 ℃。年均降水量515.7 mm, 且大部分集中在7—9月份; 年均蒸发量1 933.1 mm。土壤类型为碳酸盐褐土。试验地种植制度为每年只种1季冬小麦。各处理土壤理化性质见表1。
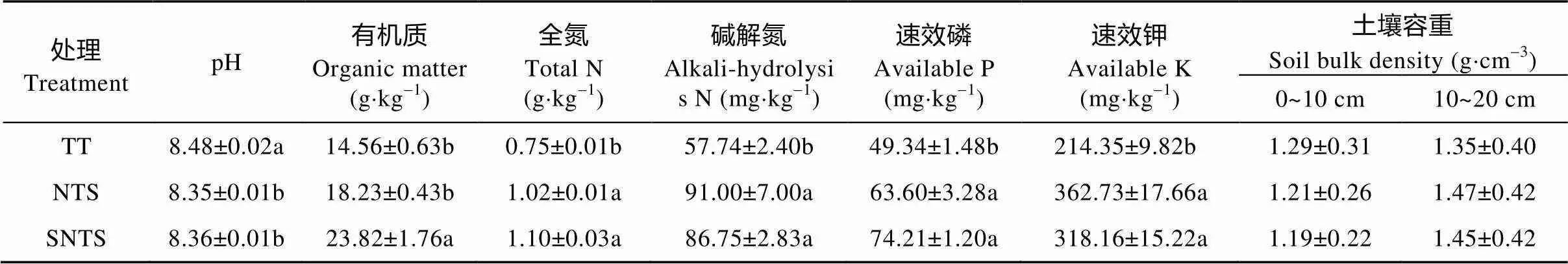
表1 不同耕作方式土壤的理化性状
NTS: 免耕覆盖; SNTS: 深松免耕覆盖; TT: 传统耕作。同列数字后不同小写字母表示处理间差异显著(<0.05)。TT: traditional tillage; NTS: no-till with straw mulching; SNTS: no-till with straw mulching after subsoiling. Different lowercase letters in the same column indicate significant differences at 0.05 level among different treatments.
1.2 试验设计
2014年11月, 借助1992年在山西省临汾市开始的保护性耕作体系长期定位试验[26], 开展了长期保护性耕作对土壤丛枝菌根真菌多样性的影响研究。本试验选择22年免耕覆盖(NTS)、连续深松覆盖4年后免耕18年的免耕覆盖(SNTS)和22年的传统耕作(TT)3种耕作处理方式。其中, NTS为全年不耕作, 播种时用免耕播种机一次性完成施肥和播种, 收获后将各小区秸秆粉碎全覆盖; SNTS是连续4年深松约40 cm后, 进行长期的免耕覆盖处理; TT是小麦收获后用铧式犁耕翻约25 cm, 无秸秆覆盖, 播前旋耕(深度约15 cm)整地。各处理重复3次, 每小区面积为600 m2。播种作物为冬小麦。2014年9月25日播种, 小麦品种为“长6359”, 播种量为120 kg×hm-2。试验田施尿素225 kg×hm-2, 磷酸二铵150 kg×hm-2。
1.3 样品采集
1)分别于2014年11月1日(小麦苗期)、2015年3月5日(返青期)、2015年4月6日(拔节期)、2015年5月10日(灌浆期)和2015年6月2日(成熟期), 取小麦根样和根际土样。每小区随机选3点, 每个样点先去掉表土, 再从0~20 cm土层取小麦新生根样10 g左右和根际土样1 kg左右。2)于2015年6月2日(小麦成熟期), 每小区随机选3点, 取小麦根系周围土样。每个点每隔20 cm深土层取1个样, 取至200 cm深土层, 每个点共取10个土样(每个土样0.5 kg左右)。将所采集的土样和根样装入无菌塑料袋中, 做好标记, 带回菌根实验室。土壤样品自然风干后保存于4 ℃冰箱中, 备用。根样水洗之后, 置于FAA固定液中备用, 并及时进行AMF侵染率、孢子密度的测定和菌种鉴定等。
1.4 AMF菌种鉴定及侵染率测定
菌种鉴定: 每份土壤样品中取100 g风干土, 采用湿筛倾析-蔗糖离心法筛取孢子[27], 在显微镜下观测计数, 计算孢子密度。在体视显微镜下先观察孢子颜色、大小、连孢菌丝的特征、孢子果形态等; 用微吸管挑取孢子置于载玻片上, 加水、乳酸、PVLG(聚乙烯醇–乳酸–甘油)和PVL(聚乙烯醇–乳酸酚)等作浮载剂, 封片后在显微镜下继续观察记录孢子的颜色和连孢菌丝的特征, 测定孢子的大小。压碎孢子后再观察内含物的性质、壁层次及各层颜色, 测定各层孢壁的厚度等, 鉴定中辅助使用Melzer’s试剂以观测孢子的特异性反应。
根据Schenck等[28]的《VA菌根真菌鉴定手册》及INVAM(http://invam.caf.wvu.edu/Myc-Info/)网站菌种的最新分类描述, 并参阅有关鉴定材料, 按照Redecker等[29]的AMF分类系统进行属、种的检索和鉴定。中文属名和种名参照王幼珊等[30]的命名。
菌根侵染率测定: 采用方格交叉法[31], 本论文仅计算丛枝侵染率。
1.5 AMF多样性相关指标计算方法
AMF丰度(species richness,)指出现在样本中的AMF种数。
相对多度(relative abundance, RA)指该采样点AMF某种孢子数占样本总孢子数的比率, 即:
RA=(AMF某种孢子数/样本总孢子数)×100% (1)
Shannon多样性指数():
=–∑(/)ln(/) (=1, 2, 3, …,) (2)
式中:为菌种的个体数;为所在样本中所有菌种的个体数之和;为菌种数, 即物种丰度。
孢子密度(spore density, SD)采用每100 g土样中AMF孢子数表示, 即:
SD=样本AMF孢子数/100 g土样 (3)
1.6 数据分析
试验数据采用SPSS 20统计软件进行方差分析, 用Duncan’s新复极差法进行多重比较, 检验各处理平均值之间的差异显著性。
2 结果与分析
2.1 不同耕作措施下土壤AMF种类、相对多度及优势种
土壤样品AMF孢子形态学鉴定结果见表2。保护性耕作处理(NTS和SNTS)共分离鉴定出AMF为7属9种, 其中根孢囊霉属()和斗管囊霉属()各2种, 球囊霉属()、近明球囊霉属()、无梗囊霉属()、硬囊霉属()和隔球囊霉属()各1种; 而传统耕作(TT)共分离鉴定出AMF为6属8种, 未发现无梗囊霉属。
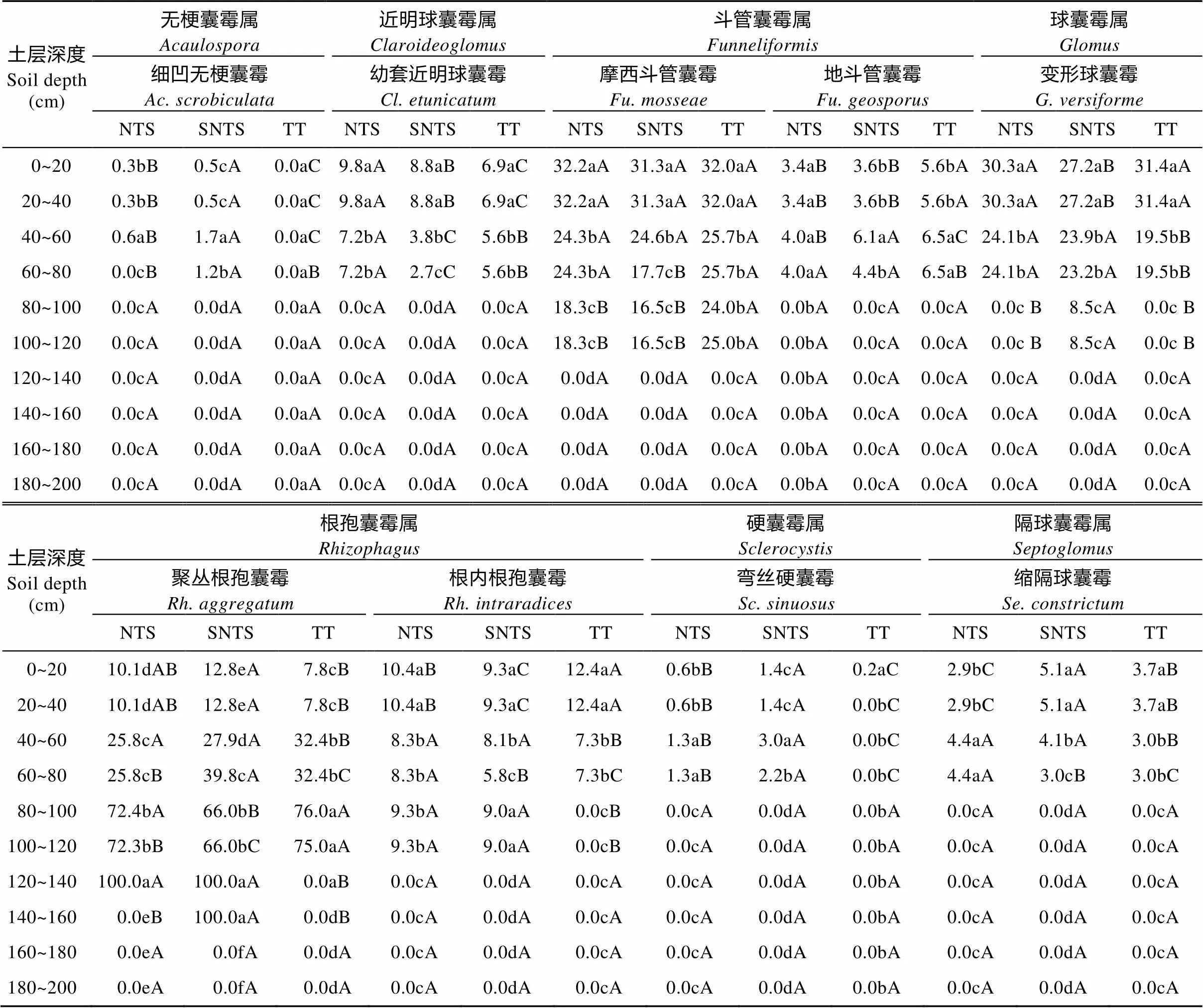
表2 小麦成熟期不同耕作措施下不同土层丛枝菌根真菌(AMF)种类分布及相对多度
NTS: 免耕覆盖; SNTS: 深松免耕覆盖; TT: 传统耕作。同列不同小写字母表示不同土层间差异显著(<0.05); 同行不同大写字母表示同一土层不同处理间差异显著(<0.05)。NTS: no-till with straw mulching; SNTS: no-till with straw mulching after subsoiling; TT: traditional tillage. Different small letters in the same column mean significant differences among different soil layers in the same treatment at< 0.05, and different capital letters in the same row mean significant differences in the same soil layer among different treatments at< 0.05.
NTS、SNTS和TT处理间的AMF相对多度存在一定差异。0~40 cm土层中,细凹无梗囊霉()和弯丝硬囊霉()的相对多度, SNTS处理显著高于NTS处理, NTS处理又显著高于TT处理; 幼套近明囊霉()的相对多度, NTS处理显著高于SNTS处理, SNTS处理又显著高于TT处理; 聚丛根孢囊霉()和缩隔球囊霉()的相对多度, SNTS处理显著高于NTS和TT两个处理; 变形球囊霉()的相对多度, SNTS处理则显著低于NTS和TT两个处理; 摩西斗管囊霉()的相对多度, NTS、SNTS和TT3个处理间的差异不显著; 地斗管囊霉()和根内根孢囊霉()的相对多度, TT处理显著高于NTS和SNTS处理。
NTS、SNTS和TT处理在不同土层的AMF优势种基本一致。0~40 cm土层, NTS、SNTS和TT处理的AMF优势种为摩西斗管囊霉和变形球囊霉, 40~80 cm土层为摩西斗管囊霉、变形球囊霉和聚丛根孢囊霉, 80~160 cm土层为聚丛根孢囊霉, 160~200 cm土层中没有检测到AMF。
2.2 不同耕作措施下土壤AMF物种丰度、孢子密度和多样性指数
由表3可知, 0~120 cm土层中, AMF物种丰度NTS和SNTS处理显著高于TT处理, SNTS处理高于NTS处理。同一耕作处理不同土层的AMF物种丰度不同, 且随着土层加深逐渐降低。其中, 0~40 cm土层AMF物种丰度显著高于40~80 cm土层, 40~80 cm土层显著高于80 cm以下土层。
各土层中, AMF孢子密度NTS和SNTS处理显著高于或相当于TT处理, SNTS处理与NTS处理差异不显著。同一耕作处理不同土层的AMF孢子密度不同, 且随着土层加深逐渐降低。从AMF在土壤中的分布深度看, NTS处理的AMF孢子分布深度为140 cm, SNTS处理分布深度为160 cm, 而TT处理仅为120 cm, 说明保护性耕作措施促进了AMF向土壤深层发展, 尤其深松效应明显。
AMF Shannon多样性指数, NTS和SNTS处理显著高于TT处理, SNTS处理高于NTS处理。同一耕作处理不同土层的AMF Shannon多样性指数不同, 且随着土层加深逐渐降低, NTS处理的AMF Shannon多样性指数为0.77~1.79, SNTS处理为1.0~1.83, TT处理为0.54~1.67。
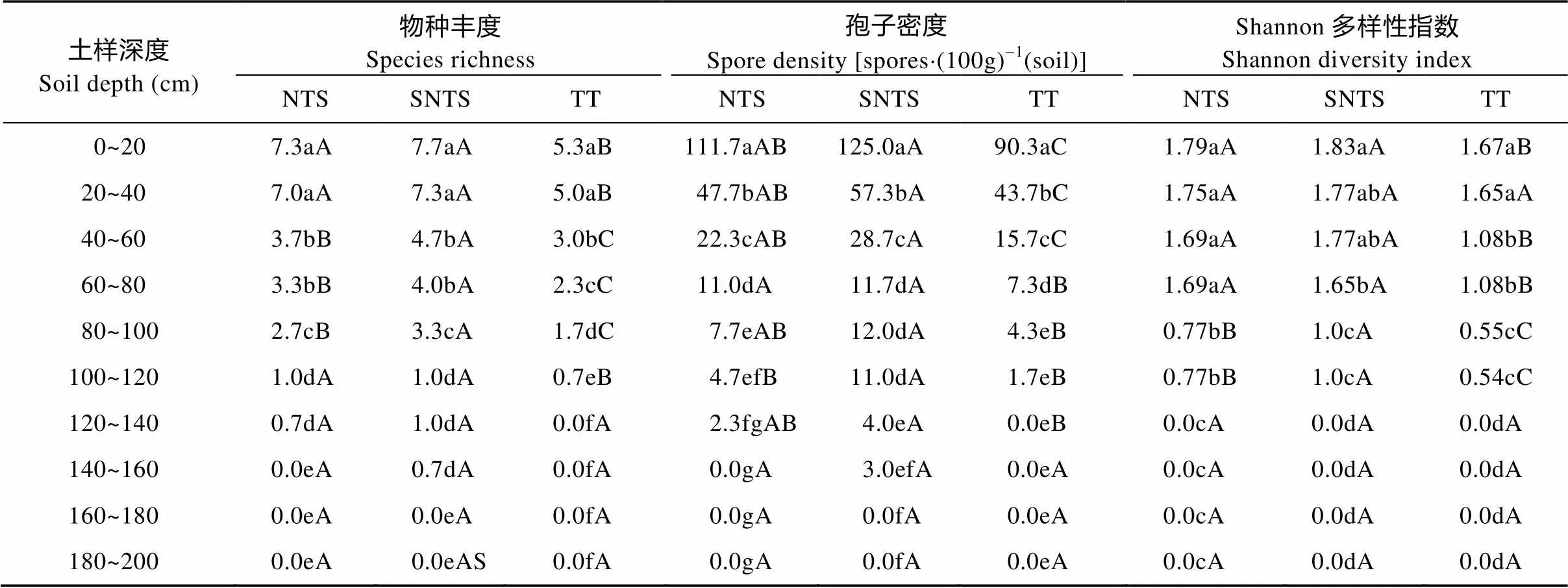
表3 小麦成熟期不同耕作措施下丛枝菌根真菌(AMF)物种丰度、孢子密度和多样性指数
NTS: 免耕覆盖; SNTS: 深松免耕覆盖; TT: 传统耕作。同列不同小写字母表示不同土层间差异显著(<0.05); 同行不同大写字母表示同一土层不同处理间差异显著(<0.05)。NTS: no-till with straw mulching; SNTS: no-till with straw mulching after subsoiling; TT: traditional tillage. Different small letters in the same column mean significant differences among different soil layers in the same treatment at< 0.05, and different capital letters in the same row mean significant differences in the same soil layer among different treatments at< 0.05.
2.3 小麦不同生育期AMF侵染率和孢子密度
由表4可知, 小麦苗期、返青期、拔节期和灌浆期, NTS和SNTS两个处理的AMF侵染率均高于TT处理, 小麦苗期3个处理间的AMF侵染率差异不显著; SNTS处理的AMF侵染率高于NTS处理。3个处理在小麦拔节期的AMF侵染率达到最高, 分别为14.9%、16.1%和10.6%, 小麦成熟期AMF侵染率最低, 均为0。
小麦各生育期的AMF孢子密度, NTS和SNTS处理均显著高于TT处理, SNTS处理高于NTS处理但差异不显著。小麦成熟期NTS、SNTS和TT处理的AMF孢子密度最高, 分别为111.7个∙(100g)-1(土)、125.0个∙(100g)-1(土)和90.3个∙(100g)-1(土), 在苗期和返青期最低, 为43.7~82.0个∙(100g)-1(土)。
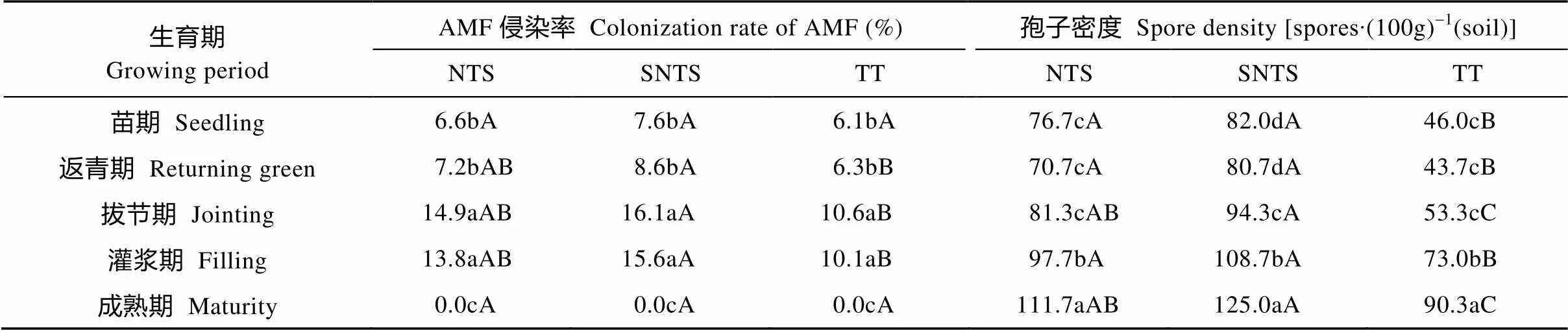
表4 不同耕作措施下小麦不同生育期丛枝菌根真菌(AMF)侵染率和土壤孢子密度
NTS: 免耕覆盖; SNTS: 深松免耕覆盖; TT: 传统耕作。同列不同小写字母表示不同土层间差异显著(<0.05); 同行不同大写字母表示同一土层不同处理间差异显著(<0.05)。NTS: no-till with straw mulching; SNTS: no-till with straw mulching after subsoiling; TT: traditional tillage. Different small letters in the same column mean significant differences among different soil layers in the same treatment at< 0.05, and different capital letters in the same row mean significant differences in the same soil layer among different treatments at< 0.05.
3 讨论
农田生态系统中的AM真菌群落结构受到耕作措施等诸多因素的影响[32-33]。本研究结果表明, 中国北方22年保护性耕作(NTS和SNTS)旱作小麦试验田共分离鉴定出AMF 7属9种, 传统耕作(TT)试验田共鉴定出AMF 6属8种; 长期保护性耕作试验田的AMF物种丰度、孢子密度、Shannon多样性指数以及AMF的侵染率均高于传统耕作处理田。研究结果说明, 长期保护性耕作增加了AMF物种数, 提高了AMF多样性, 与传统耕作相比, 更适宜一些AMF的生存与繁殖, 比如细凹无梗囊霉。本论文是基于中国北方长达22年保护性耕作试验平台开展的AMF多样性研究结果, 其与胡君利等[19]采用3年保护性耕作潮土农田生态系统中AMF多样性的研究结果有所不同, 后者认为与耕作处理相比, 免耕处理的AMF物种总数趋于升高, 但Shannon多样性指数和均匀度指数均没有稳定的变化规律; 高萍等[20]对于14年保护性耕作条件下的AMF多样性研究结果显示, 免耕土壤中的AMF多样性显著高于耕作处理。由此说明, 实施保护性耕作措施的时间越长, 越有利于AMF多样性的提高。
为了比较单纯免耕与深松免耕措施对AMF群落结构的影响, 本研究设置了深松免耕覆盖和单纯免耕覆盖处理。研究结果表明, 深松免耕覆盖处理的AMF物种丰度、孢子密度、Shannon多样性指数以及AMF侵染率均高于单纯免耕覆盖处理。在深松免耕处理土壤中, AMF的分布深度达160 cm, 单纯免耕处理中AMF分布深度为140 cm, 而在传统耕作处理中AMF分布深度仅为120 cm, 说明深松有利于AMF向土壤深层发展。何进等[24]研究认为, 在中国北方实施保护性耕作时, 深松效应可以持续4年以上, 不需要年年深松, 4年免耕覆盖加上1年深松的耕作方式, 不仅可以有效降低土壤容重, 还能解决每年深松作业出现的动土量大、水分利用率低等问题, 增加农民收入25%左右。由此说明, 农田生态系统中实施免耕深松的保护性耕作措施, 与单纯免耕耕作相比, 不仅可以改善土壤理化性质, 提高水分利用率, 还可以提高AMF多样性, 促进AMF向土壤深层发展。本研究结果表明, 聚丛根生囊霉可存在于160 cm深土层中, 说明聚丛根生囊霉具有适应深层土壤低氧环境的特性, 有利于作物对深层土壤养分的吸收利用, 具有一定的开发利用潜力, 对于聚丛根生囊霉的耐低氧特性尚需进一步深入研究。
近年来国内外学者对植物根系AMF侵染率的季相变化进行了一些研究[34-35]。李凌飞等[36]以草坪为研究对象, 探讨了草坪土壤中AMF种群的孢子组成、孢子密度、物种丰富度、多样性及其季相变化规律。结果表明, AMF孢子密度、物种丰富度和多样性指数在一年内随季节变化表现出一定的季相变化规律, 三者均在冬季达到最高, 在时间节律上与植物群落季相变化不同步。本研究结果表明, 小麦根系AMF侵染率和孢子密度表现出一定的季相变化规律, 各处理AMF侵染率均在小麦拔节期达到最高, 孢子密度在小麦收获期达到最高。
4 结论
1)中国北方旱地长期保护性耕作措施, 提高了AMF物种丰度、孢子密度、Shannon多样性指数以及AMF侵染率, 提高了AMF多样性。
2)深松免耕与纯免耕相比, 前者提高了AMF物种丰度、孢子密度和Shannon多样性指数, 促进了AMF向土壤深层的发展。说明深松与免耕相结合的保护性耕作方式, 更有利于提高土壤AMF多样性。
3)聚丛根孢囊霉可存在于160 cm深土层中, 具有适应深层土壤低氧环境的特性, 该发现有利于作物对深层土壤养分的吸收利用, 具有一定的开发利用潜力。
总之, 本研究结果为中国北方农田生态系统中AMF自然潜力的充分发挥, 以及保护性耕作技术的合理应用提供了科学依据。
[1] 韦莉莉, 卢昌熠, 丁晶, 等. 丛枝菌根真菌参与下植物-土壤系统的养分交流及调控[J]. 生态学报, 2016, 36(14): 4233–4243 WEI L L, LU C Y, DING J, et al. Functional relationships between arbuscular mycorrhizal symbionts and nutrient dynamics in plant-soil-microbe system[J]. Acta Ecologica Sinica, 2016, 36(14): 4233–4243
[2] 徐丽娟, 刁志凯, 李岩, 等. 菌根真菌的生理生态功能[J]. 应用生态学报, 2012, 23(1): 285–292 XU L J, DIAO Z K, LI Y, et al. Eco-physiological functions of mycorrhizal fungi[J]. Chinese Journal of Applied Ecology, 2012, 23(1): 285–292
[3] SMITH S E, READ D J. Mycorrhizal Symbiosis[M]. 3rd ed. Amsterdam Boston: Academic Press, 2008
[4] VAN DER HEIJDEN M G A, KLIRONOMOS J N, URSIC M, et al. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity[J]. Nature, 1998, 369(6706): 69–72
[5] 盛萍萍, 李敏, 刘润进. 农业技术措施对AM真菌群落结构的影响研究进展[J]. 应用生态学报, 2011, 22(6): 1639–1645 SHENG P P, LI M, LIU R J. Effects of agricultural practices on community structure of arbuscular mycorrhizal fungi in agricultural ecosystem: A review[J]. Chinese Journal of Applied Ecology, 2011, 22(6): 1639–1645
[6] SASVÁRI Z, HORNOK L, POSTA K. The community structure of arbuscular mycorrhizal fungi in roots of maize grown in a 50-year monoculture[J]. Biology and Fertility of Soils, 2011, 47(2): 167–176
[7] WANG M Y, HU L B, WANG W H, et al. Influence of long-term fixed fertilization on diversity of arbuscular mycorrhizal fungi[J]. Pedosphere, 2009, 19(5): 663–672
[8] WANG F Y, HU J L, LIN X G, et al. Arbuscular mycorrhizal fungal community structure and diversity in response to long-term fertilization: A field case from China[J]. World Journal of Microbiology and Biotechnology, 2011, 27(1): 67–74
[9] 马琨, 陶媛, 杜茜, 等. 不同土壤类型下AM真菌分布多样性及与土壤因子的关系[J]. 中国生态农业学报, 2011, 19(1): 1–7 MA K, TAO Y, DU Q, et al.fungi diversity and its relationship with soil environmental factors in different soil types[J]. Chinese Journal of Eco-Agriculture, 2011, 19(1): 1–7
[10] KITTIWORAWAT S, YOUPENSUK S, RERKASEM B. Diversity of arbuscular mycorrhizal fungi inand effect of the soil pH on the symbiosis[J]. Chiang Mai Journal of Science, 2010, 37(3): 517–527
[11] 吴玉红, 田霄鸿, 池文博, 等. 机械化保护性耕作条件下土壤质量的数值化评价[J]. 应用生态学报, 2010, 21(6): 1468–1476 WU Y H, TIAN X H, CHI W B, et al. Numerical evaluation of soil quality under different conservation tillage patterns[J]. Chinese Journal of Applied Ecology, 2010, 21(6): 1468–1476
[12] TREONIS A M, AUSTIN E E, BUYER J S, et al. Effects of organic amendment and tillage on soil microorganisms and microfauna[J]. Applied Soil Ecology, 2010, 46(1): 103–110
[13] 王碧胜, 蔡典雄, 武雪萍, 等. 长期保护性耕作对土壤有机碳和玉米产量及水分利用的影响[J]. 植物营养与肥料学报, 2015, 21(6): 1455–1464 WANG B S, CAI D X, WU X P, et al. Effects of long-term conservation tillage on soil organic carbon, maize yield and water utilization[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(6): 1455–1464
[14] 李萍, 郝兴宇, 宗毓铮, 等. 不同耕作措施对雨养冬小麦碳足迹的影响[J]. 中国生态农业学报, 2017, 25(6): 839–847 LI P, HAO X Y, ZONG Y Z, et al. Effect of tillage practice on carbon footprint of rainfed winter wheat[J]. Chinese Journal of Eco-Agriculture, 2017, 25(6): 839–847
[15] ROSENDAHL S, MATZEN H B. Genetic structure of arbuscular mycorrhizal populations in fallow and cultivated soils[J]. New Phytologist, 2008, 179(4): 1154–1161
[16] OEHL F, SIEVERDING E, INEICHEN K, et al. Community structure of arbuscular mycorrhizal fungi at different soil depths in extensively and intensively managed agroecosystems[J]. New Phytologist, 2005, 165(1): 273–283
[17] KABIR Z, O’HALLORAN I P, WIDDEN P, et al. Vertical distribution of arbuscular mycorrhizal fungi under corn (L.) in no-till and conventional tillage systems[J]. Mycorrhiza, 1998, 8(1): 53–55
[18] 李玉洁, 王慧, 赵建宁, 等. 耕作方式对农田土壤理化因子和生物学特性的影响[J]. 应用生态学报, 2015, 26(3): 939–948LI Y J, WANG H, ZHAO J N, et al. Effects of tillage methods on soil physicochemical properties and biological characteristics in farmland: A review[J]. Chinese Journal of Applied Ecology, 2015, 26(3): 939–948
[19] 胡君利, 杨安娜, 林先贵, 等. 保护性耕作对潮土AM真菌群落结构与功能的影响[C]//面向未来的土壤科学(中册)——中国土壤学会第十二次全国会员代表大会暨第九届海峡两岸土壤肥料学术交流研讨会论文集. 成都: 中国土壤学会, 2012 HU J L, YANG A N, LIN X G, et al. Conservation tillage effects on the community structure and function of arbuscular mycorrhizal fungi in a fluvo-aquic soil[C]//Proceedings of the 12th National Congress of the Chinese Soil Association and the Ninth Cross-Strait Symposium on Soil Fertilisers. Chengdu: Soil Society of China, 2012
[20] 高萍, 闫飞扬, 蒙程, 等. 黄土高原不同耕作措施下AM真菌的多样性[J]. 草业科学, 2016, 33(10): 1917–1923 GAO P, YAN F Y, MENG C, et al. Diversity of arbuscular mycorrhizal fungi under different agricultural practices in loess plateau in China[J]. Pratacultural Science, 2016, 33(10): 1917–1923
[21] 郭新荣. 土壤深松技术的应用研究[J]. 山西农业大学学报, 2005, 25(1): 74–77 GUO X R. Application study on technique of the soil deep loosening[J]. Journal of Shanxi Agricultural University, 2005, 25(1): 74–77
[22] PIKUL J L, AASE J K. Water infiltration and storage affected by subsoiling and subsequent tillage[J]. Soil Science Society of America Journal, 2003, 67(3): 859–866
[23] CRESSWELL H P, PAINTER D J, CAMERON K C. Tillage and water content effects on surface soil hydraulic properties and shortwave albedo[J]. Soil Science Society of America Journal, 1993, 57(3): 816–824
[24] 何进, 李洪文, 高焕文. 中国北方保护性耕作条件下深松效应与经济效益研究[J]. 农业工程学报, 2006, 22(10): 62–67 HE J, LI H W, GAO H W. Subsoiling effect and economic benefit under conservation tillage mode in northern China[J]. Transactions of the CSAE, 2006, 22(10): 62–67
[25] 何润兵, 李传友, 王明武. 深松对土壤理化性质和冬小麦生长特性的影响[J]. 中国农机化学报, 2014, 35(2): 119–122HE R B, LI C Y, WANG M W. Effects of subsoiling on soil physical and chemical properties and growth characteristics of winter wheat[J]. Journal of Chinese Agricultural Mechanization, 2014, 35(2): 119–122
[26] VERE D. Research into Conservation Tillage for Dryland Cropping in Australia and China. Impact Assessment Series Report No.33[R]. Canberra: The Australian Centre for International Agricultural Research, 2005: 8–46
[27] GERDEMANN J W, NICOLSON T H. Spores of mycorrhizalspecies extracted from soil by wet sieving and decanting[J]. Transactions of the British Mycological Society, 1963, 46(2): 235–244
[28] SCHENCK N C, PÉRÉZ Y. Manual for the Identification of VA Mycorrhizal Fungi[M]. 2nd ed. Gainesville, USA: University of Florida, 1988
[29] REDECKER D, SCHÜßLER A, STOCKINGER H, et al. An evidence-based consensus for the classification of arbuscular mycorrhizal fungi ()[J]. Mycorrhiza, 2013, 23(7): 515–531
[30] 王幼珊, 刘润进. 球囊菌门丛枝菌根真菌最新分类系统菌种名录[J]. 菌物学报, 2017, 36(7): 820–850 WANG Y S, LIU R J. A checklist of arbuscular mycorrhizal fungi in the recent taxonomic system of Glomeromycota[J]. Mycosystema, 2017, 36(7): 820–850
[31] GIOVANNETTI M, MOSSE B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J]. New Phytologist, 1980, 84(3): 489–500
[32] GUO X H, GONG J. Differential effects of abiotic factors and host plant traits on diversity and community composition of root-colonizing arbuscular mycorrhizal fungi in a salt-stressed ecosystem[J]. Mycorrhiza, 2014, 24(2): 79–94
[33] BRITO I, GOSS M J, DE CARVALHO M, et al. Impact of tillage system on arbuscular mycorrhiza fungal communities in the soil under Mediterranean conditions[J]. Soil and Tillage Research, 2012, 121: 63–67
[34] LUGO M A, GONZÁLEZ MAZA M E, CABELLO M N. Arbuscular mycorrhizal fungi in a mountain grassland Ⅱ: Seasonal variation of colonization studied, along with its relation to grazing and metabolic host type[J]. Mycologia, 2003, 95(3): 407–415
[35] RUOTSALAINEN A L, VÄRE H, VESTBERG M. Seasonality of root fungal colonization in low-alpine herbs[J]. Mycorrhiza, 2002, 12(1): 29–36
[36] 李凌飞, 杨安娜, 赵之伟. 丛枝菌根真菌种群的孢子季相动态研究[J]. 生态学杂志, 2005, 24(10): 1155–1158 LI L F, YANG A N, ZHAO Z W. Seasonal dynamics of arbuscular mycorrhizal fungal spores[J]. Chinese Journal of Ecology, 2005, 24(10): 1155–1158
Effect of long-term conservation tillage on arbuscular mycorrhizal fungi diversity*
ZHANG Guiyun1, ZHANG Liping1**, WEI Mingfeng1, LIU Zhen1, FAN Qiaolan1, LYU Beibei1, YAO Zhong1,CHAI Yuejin2
(1. Cotton Research Institute, Shanxi Academy of Agricultural Sciences, Yuncheng 044000, China; 2. Agricultural Machinery Bureau in Linfen City of Shanxi Province, Linfen 041000, China)
To verify the effect of long-term conservation tillage and subsoiling on arbuscular mycorrhizal fungi (AMF) diversity in dry areas in northern China,a comparative analysis of species richness, spore density, Shannon diversity index and colonization rate of AMF among no-till with straw mulching (NTS), no-till with straw mulching after subsoiling (SNTS) and traditional tillage treatment (TT) were conducted in 2014 at a long-term (22 years) positioning test base for conservation tillage in Linfen, Shanxi Province. In the study, 9 AMF species belonging to 7 genera were isolated and identified in soil samples of NTS and SNTS treatments, including two species each ofandand one species each of,,,andAlso 8 AMF species belonging to 6 genera were isolated and identified in soil samples of TT treatment. The AMF species in the TT treatment were the same with those in NTS and SNTS treatments, except that there was no.The dominant species of AMF in NTS, SNTS and TT treatments were the same. The dominant species of AMF in the 0-40 cm soil layer were mainlyand, the 40-80 cm soil layer were,andtum, and the 80-120 cm soil layer was. Below the 120 cm soil layer, the dominant AMF species was, which was found only under NTS and SNTS treatments. Species richness, spore density and Shannon diversity index of AMF in NTS and SNTS treatments in the same soil layers were higher than those in TT treatment, and those in SNTS treatment were higher than those in NTS treatment. Species richness, spore density and Shannon diversity index of AMF decreased with increasing of soil depth under the same treatment. The maximum species richness, spore density and Shannon diversity index of AMF were all in the 0-20 cm shallow soil layer. The colonization rate and spore density of AMF at different growth stages of wheat in NTS and SNTS treatments were all significantly higher than that in TT treatment. Colonization rate of AMF in NTS, SNTS and TT treatments was the highest at jointing stage of wheat and was respectively 14.9%, 16.1% and 10.6%. AMF spore density of soil was the highest at maturity stage of wheat and was respectively 111.7 spores∙(100g)-1, 125.0 spores∙(100g)-1and 90.3 spores∙(100g)-1. The study showed that long-term no-till with straw mulching improved AM fungi diversity, especially under no-till with straw mulching after subsoiling. The results provided the scientific basis for the full play of AMF role and reasonable application of conservation tillage in dry farmland ecosystems in northern China.
Arbuscular mycorrhizal fungi (AMF); No-till with straw mulching after subsoiling; AMF species richness; AMF diversity; Colonization rate; Spore density
, E-mail: lipingzh2006@126.com
Dec. 1, 2017;
Feb. 14, 2018
S34
A
1671-3990(2018)07-1048-08
10.13930/j.cnki.cjea.171119
* 山西省自然科学基金项目(2014011029-3)、山西省农业科学院博士基金项目(YBSJJ1405)和山西省重点研发计划项目(201703D321009-3)资助
张丽萍, 主要从事农作物病虫害综合治理和植物营养学研究。E-mail: lipingzh2006@126.com 张贵云, 主要从事植物营养学和菌根学研究。E-mail: guiyunzhang@126.com
2017-12-01
2018-02-14
* This study was supported by the Natural Science Foundation of Shanxi Provicne, China (2014011029-3), the Doctor Fund Project of Shanxi Academy of Agricultural Sciences, China (YBSJJ1405), and the Key Research and Development Project of Shanxi Provicne, China (201703D321009-3).
张贵云, 张丽萍, 魏明峰, 刘珍, 范巧兰, 吕贝贝, 姚众, 柴跃进. 长期保护性耕作对丛枝菌根真菌多样性的影响[J]. 中国生态农业学报, 2018, 26(7): 1048-1055
ZHANG G Y, ZHANG L P, WEI M F, LIU Z, FAN Q L, LYU B B, YAO Z, CHAI Y J. Effect of long-term conservation tillage on arbuscular mycorrhizal fungi diversity[J]. Chinese Journal of Eco-Agriculture, 2018, 26(7): 1048-1055

