外源腐解微生物的物种组合对土壤微生物群落结构及代谢活性的影响*
周 璇, 李玉明, 丛 聪, 王倩倩, 江 恒, 岳龙凯,尧水红**
外源腐解微生物的物种组合对土壤微生物群落结构及代谢活性的影响*
周 璇1, 李玉明2, 丛 聪1, 王倩倩1, 江 恒3, 岳龙凯1,尧水红1**
(1. 中国农业科学院农业资源与农业区划研究所 北京 100081; 2.黑龙江北大荒农业股份有限公司291分公司农业技术推广中心 双鸭山 155923; 3. 中国科学院东北地理与农业生态研究所 哈尔滨 150081)
本文采用饲料类芽孢杆菌(,P)、深红紫链霉菌(,S)和黄绿木霉(, T), 组合构建了3种单菌剂(P、S和T)、3种两菌种复合菌剂(PT、PS和ST)及1种3菌种复合菌剂(PST), 并将之添加到红壤中, 监测各菌剂添加后土壤总磷脂脂肪酸(PLFAs)量、特征微生物PLFAs百分含量、土壤呼吸速率及总代谢熵的变化, 旨在探明外源腐解微生物的物种组合对土壤微生物群落结构和代谢活性的影响, 进而为优化有机物分解菌剂种群配置提供参考。结果显示, 添加单菌剂的P、S和T处理及添加两菌种复合菌剂的PT和PS处理, 土壤微生物生物量显著增加, 增幅17.2%~121.6%(<0.05)。添加外源腐解微生物后, 各处理的土壤微生物群落的细菌百分含量基本稳定在79.6%~83.1%, 真菌百分含量显著增加8.8%~50.6%; 而放线菌百分含量除P和ST处理外, 其他处理显著降低9.4%~69.8%。PLFAs数据的主成分分析表明, 各外源菌剂处理与CK处理间的群落结构变异由小到大依次为: 接种单菌剂的P、S和T处理, 接种两菌种复合菌剂的PT、PS和ST处理, 接种3菌种复合菌剂的PST处理。添加单菌剂的P、T处理以及添加两菌种复合菌剂的ST处理, 在短期内影响了土壤微生物的对数生长, 使土壤呼吸速率的峰值分别提高48.7%、53.7%和78.7%; 且外源腐解微生物组合的物种数量越多, 土壤微生物进入潜伏期所需的时间越长。从外源腐解微生物对土壤肥力的长期影响来看, 两菌种复合菌剂ST的添加使土壤微生物代谢活性提高28.9%,因此该处理的土壤碳矿化量增加11.1%; 添加单菌剂的S处理使土壤微生物代谢活性显著降低32.4%, 因此该处理的土壤碳矿化量仅降低7.3%; 而添加两菌种复合菌剂的PS处理和3菌种复合菌剂的PST处理, 在保持代谢活性不变的情况下, 其土壤碳矿化量也降低5.8%~8.7%, 其原因有待进一步研究。综上所述, 外源腐解微生物的添加会改变土壤微生物的群落结构及其生长轨迹, 且随外源腐解微生物组合的物种数量增多这一干扰程度越大, 而土壤微生物代谢活性与外源腐解微生物组合的物种数量无显著相关性。
土壤微生物; 外源腐解微生物; 物种组合; 微生物生物量; 微生物群落结构; 微生物代谢活性; 土壤呼吸速率
有机物分解是土壤肥力形成的重要过程, 在土壤生态系统的养分循环中起枢纽作用。微生物是土壤生态系统中极其重要的分解者, 也是最为活跃的部分。新鲜有机物输入土壤后, 在微生物的作用下逐级分解, 最后以CO2形式释放到大气中[1-2]。因此, 有机物分解是一个持续而漫长的过程, 同时也是一个微生物接力的过程, 国内外许多学者曾对此进行过研究。有机物分解初期, 易分解的小分子有机物(蛋白质、水溶性物)首先被发酵性腐解微生物利用[3-4]; 随着易分解有机物的减少, 能分解大分子有机物(纤维素和半纤维素等)的微生物迅速繁殖, 即该阶段有机物分解主要依靠真菌群落[5-6]; 最后利用难降解有机物(木质素)的微生物成为土壤微生物的优势种群[7-8]。
外源腐解微生物是来源于土壤、饲料或堆肥中的能产生降解纤维素酶、半纤维素酶或木质素酶等粗纤维酶类的微生物[9-10]。已报道的对纤维素降解能力强的微生物多为木霉菌属()和类芽孢杆菌属()等的菌株[11-12], 而黄绿木霉()和饲料类芽孢杆菌()正是其中最具代表性的微生物[13-14]。近年来, 一些隶属放线菌门的浅紫链霉菌()、微杆菌(sp.)和红球菌(sp.)等微生物也被发现能有效降解木质素和纤维素类物质[15]。随着对外源腐解微生物的认识逐渐加深, 其作为堆肥腐熟剂和秸秆还田腐解剂等备受重视。石其伟等[16]研究表明, 添加微生物菌剂促进了稻草前期的分解作用和后期的腐殖化作用; 王晓娟等[17]研究表明, 添加腐解菌剂能加快鸡粪升温, 延长高温期, 缩短到达稳定期的时间。这些研究均表明外源腐解微生物的添加能显著加速有机物分解的进程。此外, 肖艳萍[18]研究发现, 复合菌系[链格孢霉菌()+短梗霉菌()+链霉菌(sp.)+厄氏菌(sp.)]的纤维素分解效率至少是单菌株的2.33倍, 且当各菌株等比例混合时, 其协同降解能力最佳; 冀颐之等[19]研究发现: 芽孢杆菌复合菌剂较单一芽孢杆菌不仅能加快纤维素和木质素的降解速率, 还能提高黄腐酸的产量。此类研究均证实了复合腐解菌系较任何单一菌种能提高降解纤维素与木质素能力。近两年来, 部分研究关注腐解微生物的物种差异对有机物腐殖化进程的影响, 并指出不同微生物对腐殖化进程的作用体现在不同培养阶段对不同物质和官能团的利用上[20-21]。但是, 关于外源腐解微生物对有机物腐解的影响机制尚不明确。
土壤微生物在有机物的分解过程中起到了很重要的作用, 外源腐解微生物的添加会引起土壤微生物数量和多样性的改变[22-23], 但以往都是选用单菌剂或者通过筛选构建复合菌系来进行研究, 复合腐解菌系往往由于存在菌株组成的种类多, 鉴定困难的缺陷, 因而关于外源腐解微生物如何通过物种组合来影响土壤微生物群落结构及活性的相关试验证据很少。本文通过源头控制构建物种数量不同的腐解微生物组合, 采用培养试验动态监测土壤微生物生物量与群落结构的变化, 明确外源腐解菌剂的物种组合对土壤微生物代谢活性及分解功能的影响。该研究结果不仅能为优化有机物分解菌剂种群配置提供参考, 还可为培肥地力和稳定土壤生态系统功能提供理论依据。
1 材料与方法
1.1 供试材料
供试土壤为旱地红壤, 采自江西省鹰潭市余江县邓家埠原种场三分场(28°5′N, 116°5′E), 地上植被为原生草丛, 取样深度为0~20 cm。根据美国土壤系统分类[24], 该土壤属于黏壤老成土, 根据中国土壤系统分类为富铁土[25]。土壤的母质是第四纪红黏土, 土壤有机质含量5.2 g·kg-1, 速效磷19.3 mg·kg-1, 速效钾237 mg·kg-1, 阳离子交换量10.2 cmol·kg-1。
供试微生物: 包括饲料类芽孢杆菌, 为杆菌科的一属细菌; 深红紫链霉菌(), 为链霉菌科的一属放线菌; 黄绿木霉, 为丛梗孢科的一属真菌。这3个菌种均由中国农业科学院菌种保藏管理中心提供, 是从土壤中分离的腐解微生物, 具有较强的有机物分解能力, 常用于配制商用秸秆腐解菌剂。
1.2 试验设计
菌株培养: 饲料类芽孢杆菌采用牛肉膏蛋白胨培养基, 深红紫链霉菌采用高氏一号培养基, 黄绿木霉菌采用马铃薯葡萄糖培养基。首先, 将纯化的菌株各自接种到已制备好的适宜菌株生长的培养液中, 恒温(25±3) ℃培养7 d; 然后, 将菌液离心(8 000 r·min-1, 15 min), 经无菌水清洗数次后, 以无菌水稀释成接近5×108cfu·mL-1菌悬液备用。
接种试验: 试验在恒温(25±1) ℃培养箱中进行。首先, 将风干过2 mm筛的土样调节至最大田间持水量的70%, 黑暗培养10 d, 恢复其土壤微生物活性。随后, 将备用的菌悬液按物种数量1、2、3自由组合并吸附于载体上(菌种组合见表1), 连同未接种的对照, 共设8个处理。菌剂载体为无菌草炭(总有机碳含量397 g·kg-1, 全氮11.9 g·kg-1, 碳氮比33.5),菌剂载体灭菌后按各处理的菌种组合要求接种菌体, 接种的有效活菌数为3.8×108CFU·g-1。然后, 将菌剂载体按8‰的质量百分比(投入草炭的碳含量与秸秆全量还田的碳含量相当)均匀地混入恢复活性的土壤中, 并将混匀后的土样均分18份(每份样品量折合干土重为50 g), 以保障每个取样时间均能取3个重复。最后, 将各处理的样品逐一置于250 mL的白色塑料瓶中恒温培养30 d。在培养的过程中, 定期称重及时补水, 以保持土壤水分含量相对稳定。
取样时间: 在培养的过程中每天连续监测土壤呼吸速率, 分析接种后土壤微生物的生长轨迹及代谢量; 在培养的第1 d、2 d、4 d、9 d、18 d和30 d, 动态取样测定土壤微生物生物量碳, 以计算整个培养周期中各处理的微生物生物量均值, 并结合累积呼吸量, 分析接种后土壤微生物代谢活性的差异; 在培养结束的第30 d, 取样测定土壤磷脂脂肪酸(phospholipid fatty acid, PLFA), 分析土壤微生物群落结构的变化。
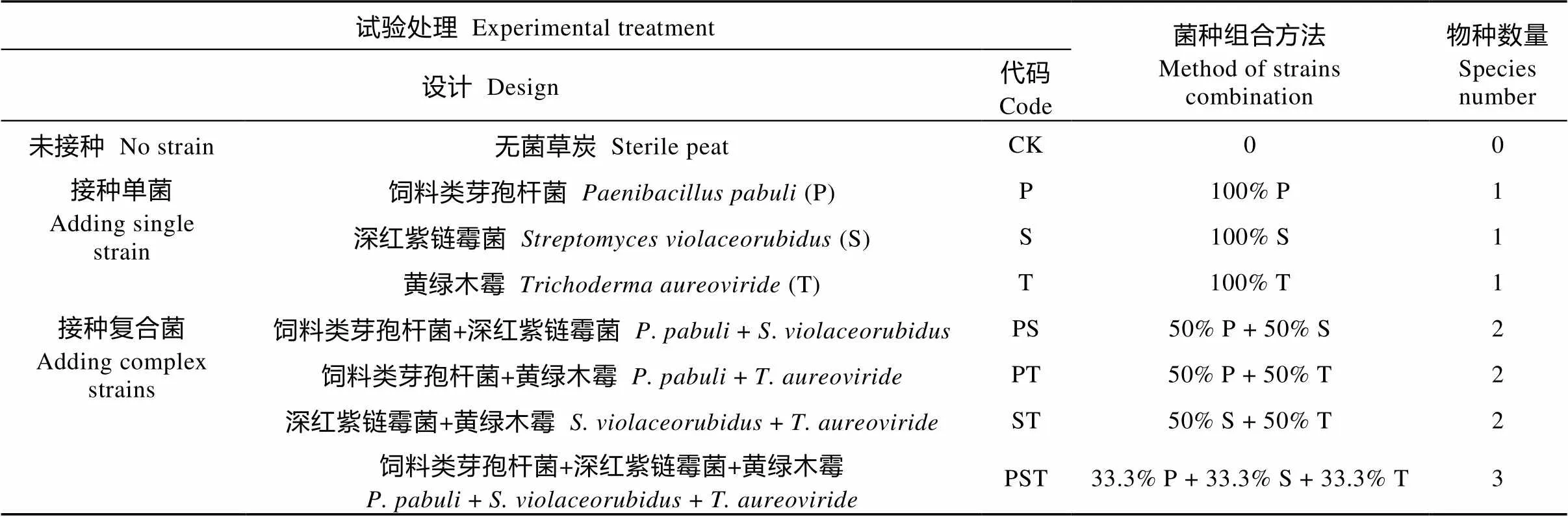
表1 试验处理及菌种组合方法
1.3 测定项目与方法
1.3.1 磷脂脂肪酸含量测定
采用改进后的Blight-Dyer法进行磷脂脂肪酸(PLFA)的提取[26-28], 运用GC-MS(Gas Chromatograph- Mass Spectrometry)分析仪分离不同分子, 并结合脂肪酸标准谱图(Bacterial Fatty Acid Standards)和美国商品化的MIDI系统(Microbial Identification System)识别与定量磷脂脂肪酸。总PLFAs含量()的计算公式如下:
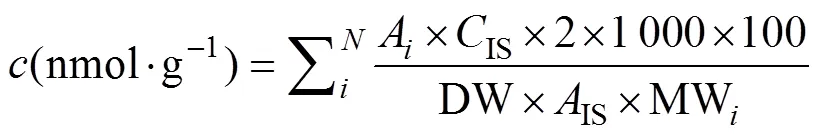
式中:A和MW分别为单个PLFA生物标记物的特征峰值和相对分子质量,IS为内标的浓度,IS为内标19:0的特征峰值, DW为土壤干重(g), MW为脂肪酸甲酯的分子量, 2为校正系数, 1 000为nmol的转化系数,为该试验中总特征PLFAs个数[29]。
将PLFA谱图中对提取的PLFA总量的贡献值小于1%的PLFA剔除[30], 筛选得到49个PLFAs, 其中10:0、12:0、13:0、14:0、15:0 2OH、16:0、17:0、18:0、20:0代表普通细菌源微生物; 革兰氏阳性细菌[Gram-positive bacteria, G(+) bacteria]包括: 11:0 iso、12:0 iso、13:0 iso、13:0 anteiso、14:0 iso、14:0 anteiso、15:0 iso、15:0 anteiso、16:0 iso、16:0 anteiso、17:0 iso、17:0 anteiso、18:0 iso、19:0 iso; 革兰氏阴性细菌[Gram-negative bacteria, G(-) bacteria]包括i14:1、a15:1、i15:1、15:1 ω8c、i16:1、16:1 2OH、16:1 ω9c、16:1 ω5c、17:1 ω5c、a17:1、17:1 ω8c、cy17:0、i18:1、18:1 ω7c、19:1 ω6c、19:1 ω11c、cy19:0 ω8c、20:1 ω9c; 18:1 ω9c, 18:2 ω6, 9c和18:3 ω6, 9, 12c代表真菌源微生物; 10Me 16:0, 10Me 17:0, 10Me 18:0和10Me 19:0代表放线菌源微生物。
1.3.2 土壤呼吸速率测定
采用碱液静态吸收法[31-32], 吸取5 mL 0.1 mol·L-1于10 mL特制吸收容量瓶中, 并将此瓶悬挂于250 mL的白色培养瓶中, 以吸收微生物呼吸释放的CO2, 25 ℃恒温箱培养24 h, 用0.1 mol·L-1HCl滴定剩余的NaOH, 以计算CO2释放速率。
1.3.3 土壤微生物生物量碳的测定
采用氯仿熏蒸浸提法, 详见Vance等[33]、林启美等[34]。以0.5 mol·L-1K2SO4溶液浸提熏蒸和未熏蒸的土壤, 浸提液过滤后直接用TOC仪(Vario TOC select, Elementar, Germany)测定[35]。转换系数取0.38。
1.4 数据处理与分析
数据处理采用Microsoft Excel 2013软件; 不同处理间的差异用单因素方差分析(One-Way ANOVA)和最小显著差异法(LSD)值进行分析比较; 通过主成分分析来研究接种不同物种组合微生物后土壤微生物群落结构的变化, 统计软件为SPSS 19.0, 并使用Origin 9.0软件作图。
2 结果与分析
2.1 外源微生物的物种组合对土壤微生物群落结构的影响
土壤微生物生物量以可提取的土壤总PLFAs含量表征。试验所用的红壤土著微生物生物量为141 nmol·g-1。该红壤的微生物群落结构组成中: 普通细菌类PLFAs占27.0%, G(+)细菌类PLFAs占20.4%, G(-)细菌类PLFAs占35.4%, 真菌PLFAs占9.1%, 放线菌类PLFAs占8.1%(图1)。草炭是外源微生物接种的常用载体, 含有较为丰富的有机质和矿物质, 且疏松多孔, 因而利于微生物的生长繁殖[36-38]。在未接种试验开始时(即0 d), 红壤加无菌草炭处理的微生物生物量为154 nmol·g-1, 较红壤本底值有一定程度上的增加; 但该处理的各类微生物的特征PLFAs所占百分含量与红壤土著微生物群落间无显著差异(图1), 说明红壤加无菌草炭并未影响微生物的群落组成。因此, 以红壤加无菌草炭作为本试验的对照处理, 能有效地反映接种外源腐解微生物对土壤微生物群落结构的影响。
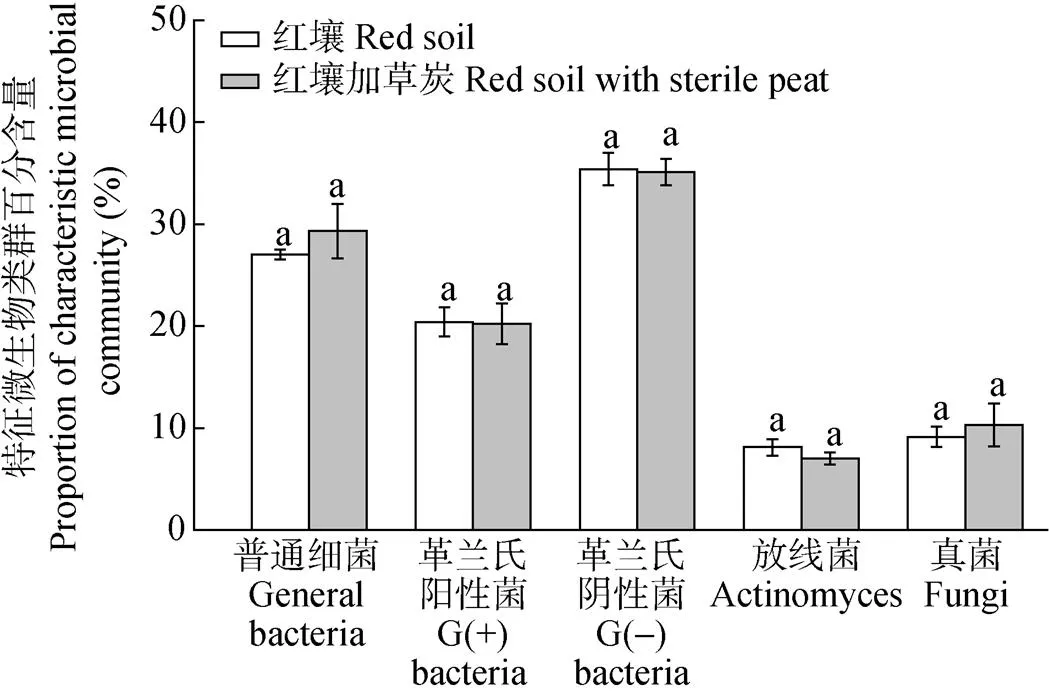
图1 试验用红壤及红壤加草炭的微生物群落结构组成
不同小写字母表示处理间差异显著(<0.05)。Different lowercase letters demonstrate significant differences between red soil and red soil with sterile peat.
接种不同物种组合的外源微生物并培养30 d后,各处理微生物生物量呈现一定的差异(图2A)。未接种的红壤加草炭处理(对照, CK)的微生物生物量为91 nmol·g-1; 接种单菌剂的P、S和T处理的微生物生物量为107~199 nmol·g-1, 显著高于未接种的CK处理(<0.05); 接种两菌种复合菌剂的PS和PT处理的微生物生物量分别为164 nmol·g-1、201 nmol·g-1, 也显著高于未接种的CK处理(<0.05); 而接种两菌种复合菌剂的ST和接种3菌种复合菌剂的PST处理微生物生物量分别为97 nmol·g-1和93 nmol·g-1, 与未接种的CK处理无显著差异。
土壤微生物群落结构组成用各类微生物特征PLFAs的百分含量表征。单因素方差分析显示, 未接种的对照处理(CK)的3大类菌群(细菌、真菌和放线菌)在培养结束后与0 d时相比无显著差异。培养30 d后, 未接种CK处理的微生物群落中细菌类微生物占绝对优势, 其中普通细菌类占22.4%、G(-)细菌类占30.6%、G(+)细菌类占29.5%(图2B); 真菌和放线菌类PLFAs分别占9.2%和8.3%(图2C和D)。接种不同物种组合的外源微生物后, 各处理微生物群落中细菌的总比例(79.6%~83.1%)较未接种CK处理无显著差异, 但细菌的组成有一定的变化(图2B)。与未接种的CK处理相比, 接种单菌剂的S处理, 普通细菌PLFAs百分含量显著下降20.0%, 而G(-)细菌PLFAs百分含量显著增加11.4%; 接种两菌种复合菌剂的ST处理, G(+)细菌PLFAs百分含量显著下降41.4%, 而G(-)细菌PLFAs百分含量增加19.5%; 接种3菌种复合菌剂的PST处理, G(+)细菌PLFAs百分含量显著下降17.9%(图2B)。接种不同物种组合的外源微生物后, 各处理的微生物群落中真菌所占比例显著高出未接种的CK处理的8.8%~50.6%(图2C)。各处理的微生物群落中放线菌所占比例, 接种单菌剂的P处理与未接种的CK处理无显著差异, 接种两菌种复合菌剂的ST处理显著高于未接种CK处理, 而其他5种菌剂处理较未接种的CK处理显著降低9.4%~69.8%(图2D)。
不同处理下土壤微生物PLFAs数据的主成分分析进一步表明: 外源腐解微生物对土著微生物的群落结构有显著影响, 各处理在PC1和PC2上与未接种的CK处理均无交集(图3A)。此外, 微生物的群落结构与外源腐解微生物组合中的物种数量也呈一定的相关性。接种单菌剂的P、S和T处理均位于X轴的上方, 与未接种的CK处理最为接近(图3A); 而接种两菌种复合菌剂的PT、PS和ST处理处在X轴下方的第4象限, 与未接种的CK处理的间距大于接种单菌剂的3个处理; 接种3菌种复合菌剂的PST处理则位于X轴下方的第3象限, 与未接种的CK处理的间距最远(图3A)。从PLFAs在主成分上的因子载荷图分析, 对PC1贡献大的PLFAs(特征向量系数>0.5)有13种, 其中普通细菌类PLFAs有5种, G(+)细菌类PLFAs有4种, G(-)细菌类PLFAs有2种, 放线菌类PLFAs有1种, 真菌类PLFAs有1种。对PC2起主要作用的PLFAs(特征向量系数>0.5)有8种, 其中普通细菌类PLFAs有1种, G(+)细菌类PLFAs有2种, G(-)细菌类PLFAs有3种, 放线菌PLFAs有2种(图3B)。
2.2 外源微生物的物种组合对土壤微生物活性的影响
土壤微生物活性即微生物代谢活力, 可以用多种方法测定[39-42]。CO2释放速率作为测定土壤微生物活性最常用的方法之一, 尽管存在一定的局限性, 但一直被广泛的应用[43]。外源腐解菌剂接种后土壤呼吸速率的动态变化, 反映了不同物种组合的外源腐解微生物对土著微生物的扰动轨迹(图4)。由图4可见, 未接种的CK处理在培养的过程中呈一条典型的微生物生长特征曲线, 即: a-b为对数生长期, 微生物以恒定的几何级数增长; b-c为稳定期, 由于营养物质消耗殆尽, 微生物数保持较稳定的个数; c-d为衰亡期, 微生物生长减慢, 死亡数目增多; d-e为潜伏期, 微生物恢复到自然活性状态。
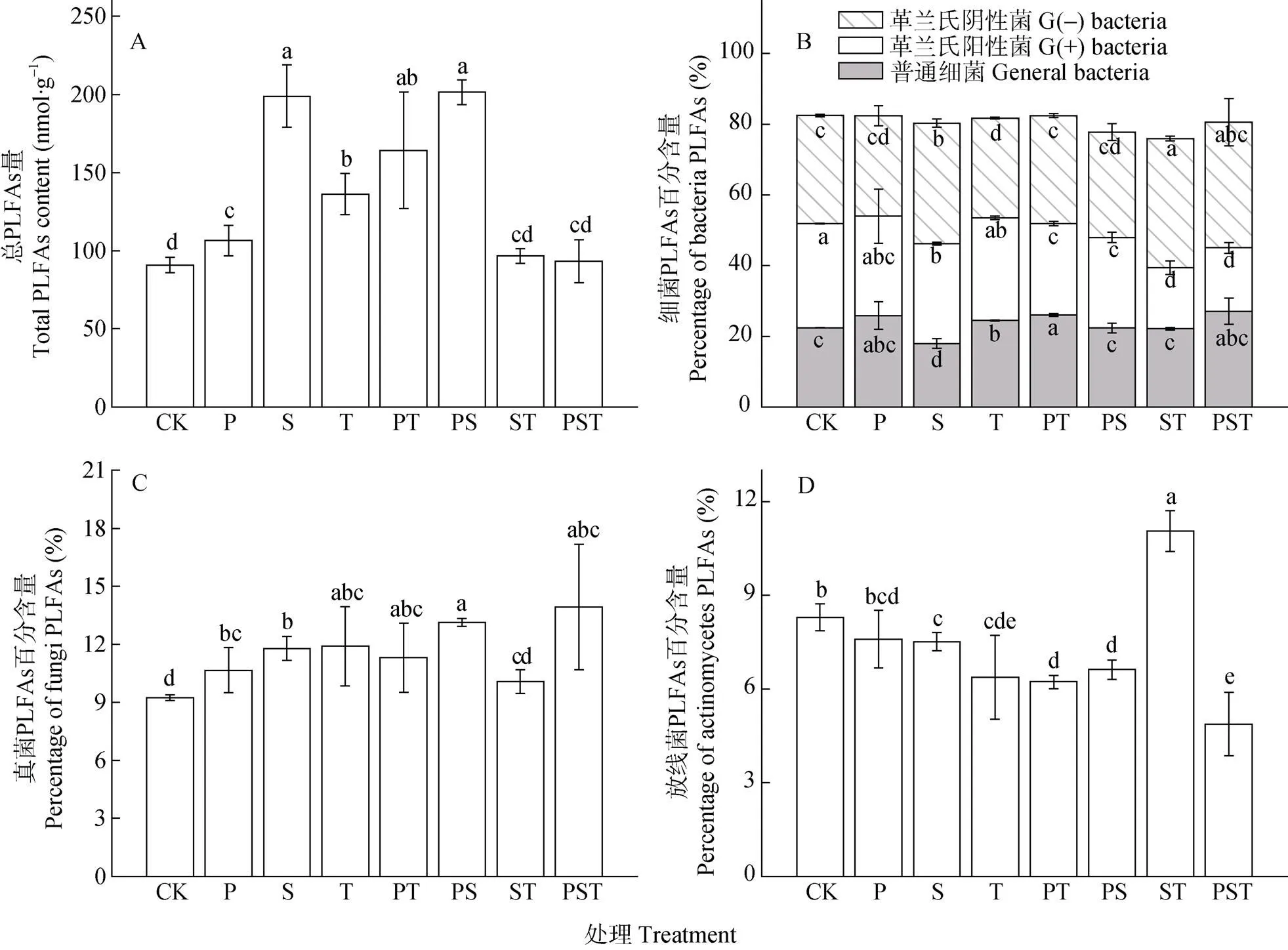
图2 培养30d后接种不同菌种及组合的土壤微生物生物量及特征微生物种群百分含量
不同小写字母表示不同处理间差异显著(<0.05)。Different lowercase letters indicate significant differences among treatments at 0.05 level.
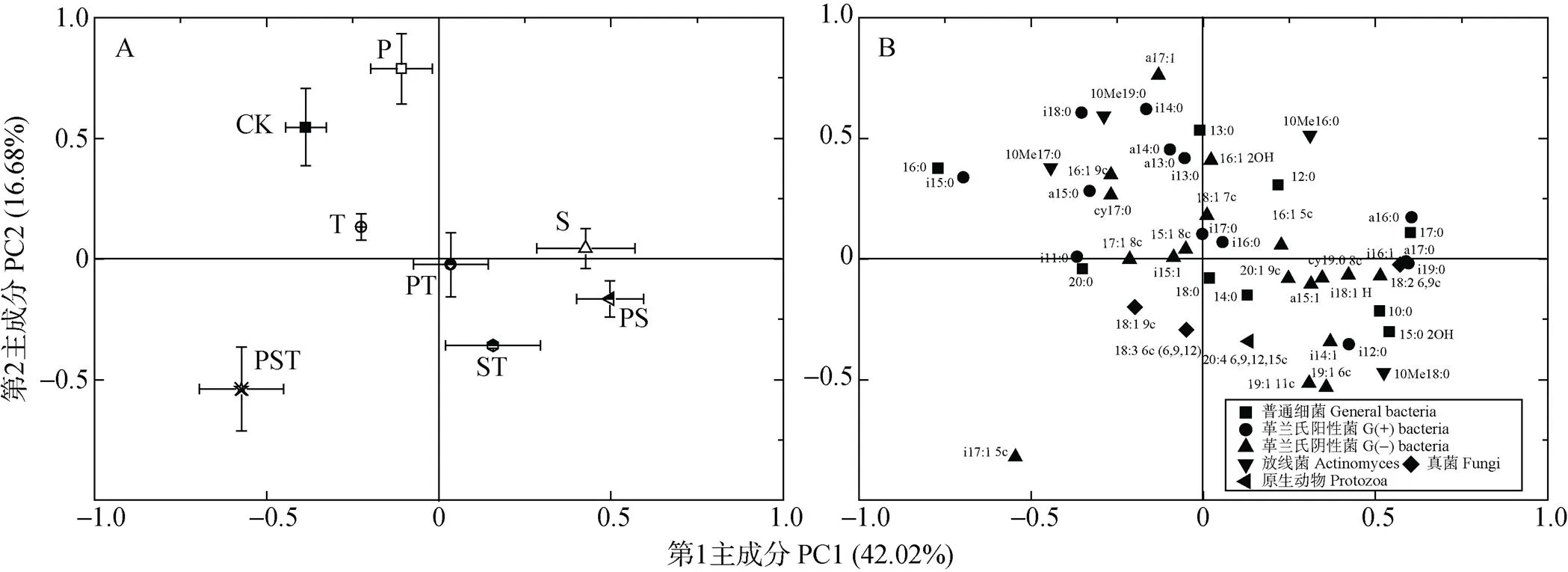
图3 接种不同菌种及组合处理的土壤微生物群落结构差异的主成分分析
外源腐解微生物的添加影响土壤微生物的对数生长(表2)。研究结果发现: 除P处理在接种单一饲料类芽孢杆菌后有一个明显的停滞期, 其他单菌剂和复合菌剂的处理均快速进入对数生长期, 土壤呼吸速率在培养1 d后出现峰值(图4, 表2)。在出现峰值时, 接种单菌剂的P、T处理和接种两菌种复合菌剂的ST处理, 土壤呼吸速率分别高出未接种的CK处理48.7%、53.7%和78.7%, 而其他4种菌剂处理的土壤呼吸速率与未接种的CK处理间无显著差异。对数生长后, 各处理均快速进入衰亡期、最后进入潜伏期(图4, 表2), 接种单菌剂的3个处理均在培养6~7 d后进入潜伏期; 而接种两菌种复合菌剂的3个处理在培养10~12 d后进入潜伏期; 接种3菌种复合菌剂的PST处理的波动周期最长, 在培养16 d后进入潜伏期。
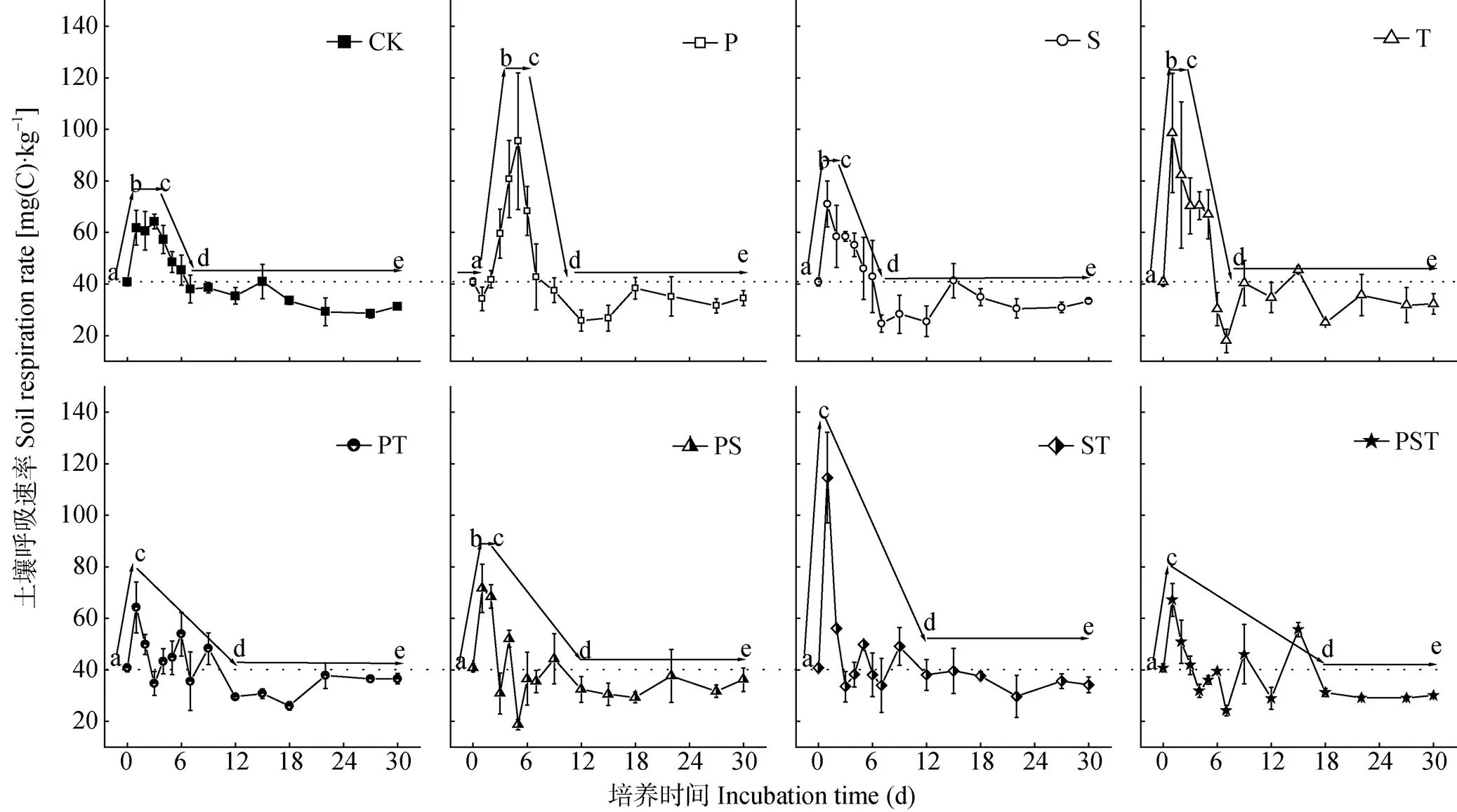
图4 培养过程中接种不同菌种及组合处理的土壤呼吸速率变化
a→b代表微生物生长特征曲线的对数期; b→c代表稳定期; c→d代表衰亡期; d→e代表潜伏期。a→b represents the logarithmic phase of microbial growth curve; b→c represents the stable phase of microbial growth curve; c→d represents the decline phase of microbial growth curve; d→e represents the latency phase of microbial growth curve.
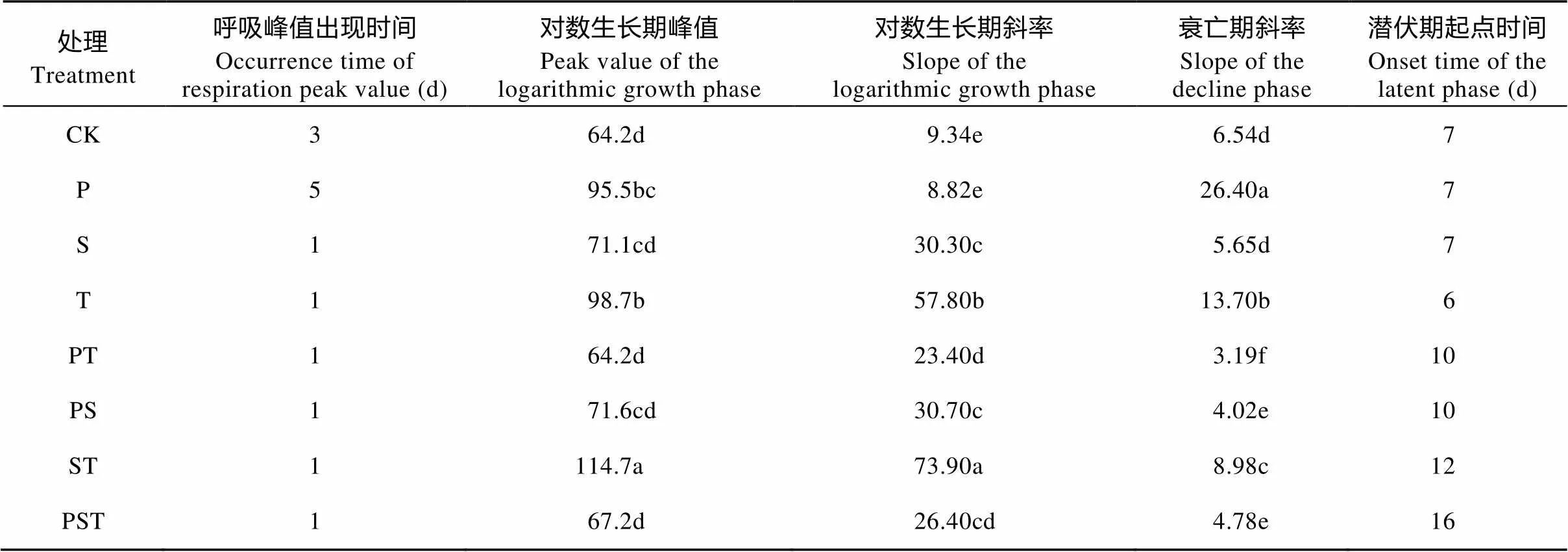
表2 接种不同菌种及组合处理土壤微生物活性特征指数
不同小写字母表示不同处理间的差异显著(<0.05)。Different lowercase letters indicate significant differences among treatments at 0.05 level.
外源腐解微生物的添加改变了土壤微生物的生长轨迹, 间接造成了各处理下土壤累积呼吸量的差异(图5A)。土壤累积呼吸量反映了外源腐解微生物的添加对土壤微生物活性的长期影响。未接种的CK处理的土壤累积呼吸量为1 145 mg·kg-1, 接种单菌剂的P和T处理及接种两菌种复合菌剂的PT处理, 土壤累积呼吸量与CK处理无显著差异; 接种两菌种复合菌剂的ST处理, 土壤累积呼吸量较CK处理显著增加了11.1%; 而接种单菌剂的S处理, 接种两菌种复合菌剂的PS处理和接种3菌种复合菌剂的PST处理, 土壤累积呼吸量较之略有降低。微生物总代谢熵由土壤累积呼吸量与微生物生物量均值的比率来表征, 各处理微生物总代谢熵(qCO2)也存在一定的差异(图5B)。接种单菌剂的S处理的微生物总代谢熵显著低于CK处理; 而接种两菌种复合菌剂的ST处理的总代谢熵较之增加了28.9%; 其他菌剂处理的微生物总代谢熵与CK处理间无显著差异。
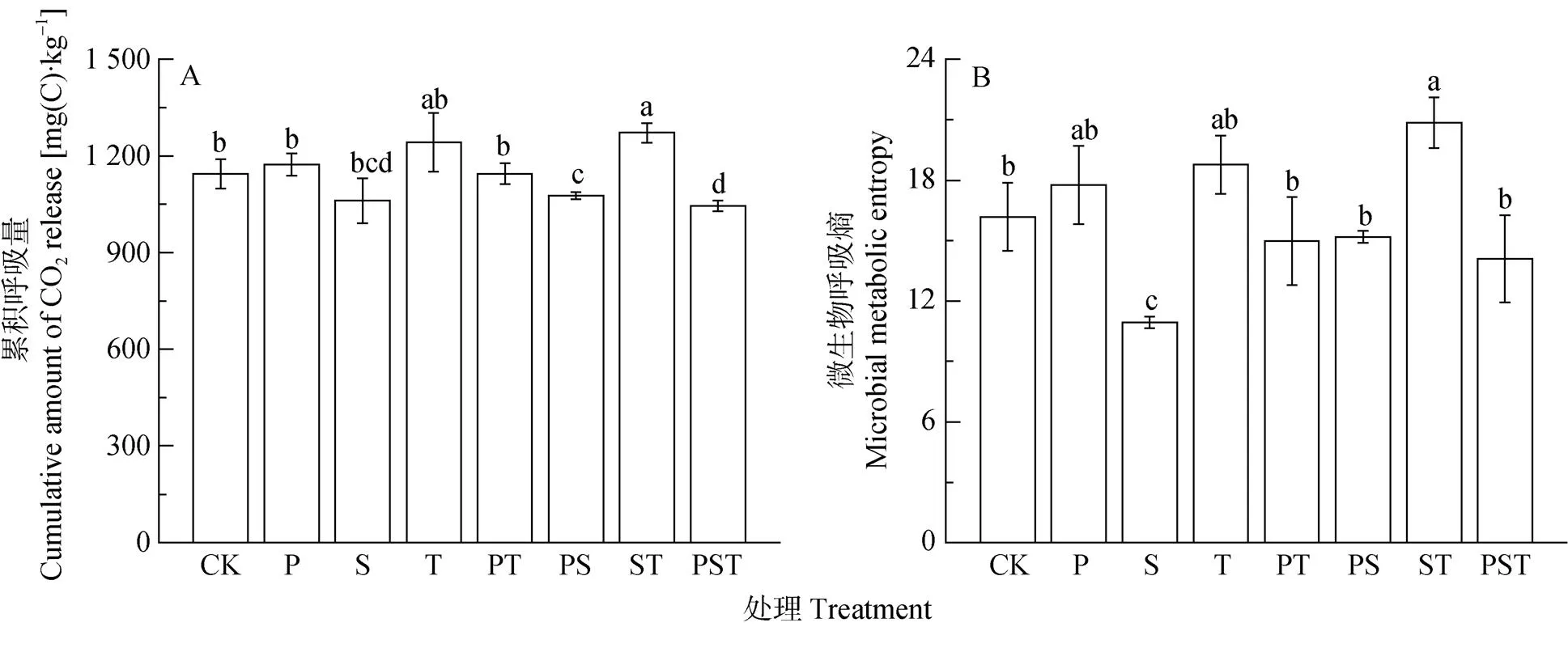
图5 培养周期内接种不同菌种及组合处理的土壤累积呼吸量(A)和微生物总呼吸熵(B)
不同小写字母表示不同处理间差异显著(<0.05)。Different lowercase letters indicate significant differences among treatments at 0.05 level.
3 讨论
3.1 外源腐解微生物的物种组合对土壤微生物群落结构的影响
外源腐解微生物的添加改变了土壤微生物的群落结构。本文研究发现: 接种深红紫链霉菌(放线菌)的S、PS、ST、PST处理与CK处理相比, G(+)细菌的百分含量显著降低, 说明深红紫链霉菌的添加抑制了G(+)细菌的生长, 这与前人的研究一致[44-45]。此外, 研究还发现: 外源腐解微生物添加后, 土壤微生物群落中的真菌百分含量增加、放线菌百分含量除P处理和ST处理外, 显著下降。
从本研究中PCA分析结果可知: 各外源菌剂处理与CK处理间均无交集, 且各处理与CK处理间的差异, 以接种单菌剂的3个处理最小, 接种两菌种复合菌剂的3个处理较大, 而接种3菌种复合菌剂的PST处理最大。这一结果表明, 外源微生物的添加会显著改变土壤微生物的群落结构, 且外源腐解微生物对土壤微生物群落的扰动作用随其物种数量增多而加强。究其原因可能是外源腐解微生物进入土壤后, 与土著微生物竞争养分与生态位[46], 从而引起土壤中整个微生物群落结构的改变。
土壤微生物生物量能反映土壤质量状况, 是评价土壤微生物状况随环境变化的敏感指标。本体土壤中的微生物生物量在一定的条件下是相对稳定的, 而当外源腐解微生物进入后, 土壤微生物生物量将发生改变[47-49]。本研究显示, 单一饲料类芽孢杆菌(细菌)、深红紫链霉菌(放线菌)和黄绿木霉(真菌)添加, 增加了土壤微生物生物量。此外, 菌种间无显著的拮抗作用的复合菌, 也能适应红壤土体的酸性环境并迅速繁殖, 土壤微生物生物量显著增加, 如本研究中的PS处理(饲料类芽孢杆菌和深红紫链霉菌复合菌)与PT处理(饲料类芽孢杆菌和黄绿木霉菌复合菌)。与此同时, ST处理(深红紫链霉菌和黄绿木霉菌复合菌)与PST处理(饲料类芽孢杆菌、深红紫链霉菌和黄绿木霉菌复合菌), 土壤微生物生物量与对照(CK)间无显著的差异, 但仅通过土壤微生物生物量还不足以证明菌株间的拮抗作用, 其原因可能是多菌混合后菌量增加所引起的竞争性抑制作用, 也可能是菌株代谢产生的次级代谢产物所引起的抑菌现象, 具体原因将进一步探究。
3.2 外源腐解微生物的物种组合对土壤微生物活性的影响
土壤呼吸的动态特征在一定程度上可反映土壤微生物活性的变化[50]。本文研究结果发现, 外源腐解微生物的添加刺激土壤微生物的生长, 使土壤微生物群落快速进入对数生长期(图4), 之前的研究也有过类似报道: 证实自生细菌接种土壤后会对农田土壤产生短期影响[51]。此外, 菌种组合中微生物的物种数量越多, 土壤微生物进入潜伏期所需的时间越长, 这可能是由于外源微生物组合中的物种数量越多, 与土著微生物在养分、水分及生存空间上的竞争更激烈, 土著微生物抵抗干扰所需的周期更长[52]。菌种组合中的物种数量与土壤累积呼吸量间无相关关系。
微生物总代谢熵(qCO2)可灵敏地反映土壤微生物的代谢活性[53], qCO2越高, 微生物利用相同能量形成的生物量小, 释放的CO2多, 土壤微生物代谢活性越强[54], 反之亦然。本研究发现, 接种单菌剂的S处理使qCO2显著降低, 接种两菌种复合菌剂的ST处理使qCO2显著增加, 而其他5种外源菌剂处理不改变土壤的qCO2, 这说明接种单一深红紫链霉菌的S处理能提高土壤微生物对碳的利用率, 从而利于土壤质量的改善。接种两菌种复合菌剂的ST处理较大程度地扰动了红壤微生物群落, 需要微生物耗费更多的能量来平衡外界的干扰[55]。总体上来说, 土壤微生物代谢活性与菌种组合中的物种数量间并无相关关系, 这除了土著微生物对外界干扰的抵抗外, 还可能与外源腐解菌种间的协同作用有关, 其中原因需要进一步研究。
4 结论
外源腐解微生物的添加影响土壤微生物生物量, 改变土壤微生物群落结构, 且外源腐解微生物对土著微生物群落结构的干扰程度随菌种组合中的物种数量增多而加强。本研究发现添加单菌剂P、S和T处理及添加两菌种复合菌剂的PT和PS处理较未接种的CK处理土壤微生物生物量显著增加, 其他处理与未接种的CK处理无显著差异。本研究中除ST处理外, 其余各处理均在一定程度增加真菌的百分含量, 降低放线菌的百分含量; 且由PCA分析结果可知, 各处理与CK处理间的差异, 以接种单菌剂的3个处理最小, 接种两菌种复合菌剂的3个处理较大, 而接种3菌种复合菌剂的PST处理最大。
外源腐解微生物的添加短期内影响土壤微生物的对数生长, 且菌种组合中的物种数量改变了土壤微生物进入潜伏期的时间, 但土壤微生物的总体代谢能力与菌种组合中的物种数量无关。研究结果发现: 除P处理有一个明显的停滞期, 其他单菌剂和复合菌剂的处理均快速进入对数生长期; 且在对数生长后, 接种单菌剂的3个处理进入潜伏期所需时间最短; 接种两菌种复合菌剂的3个处理进入潜伏期所需时间居中; 接种3菌种复合菌剂的PST处理进入潜伏期所需时间最长。此外本研究也发现, 添加单菌剂的P、T处理以及添加两菌种复合菌剂的ST处理, 土壤呼吸速率峰值显著提高; 但土壤累积呼吸量除ST处理较CK处理显著增加外, 其他处理低于或与CK处理无显著差异。
[1] 李英, 韩红艳, 王文娟, 等. 黄淮海平原不同土地利用方式对土壤有机碳及微生物呼吸的影响[J]. 生态环境学报, 2017, 26(1): 62–66 LI Y, HAN H Y, WANG W J, et al. Effects of different land use types on soil organic carbon and microbial respiration in Huang-Huai-Hai Plain[J]. Ecology and Environmental Sciences, 2017, 26(1): 62–66
[2] 李考学. 氮沉降对凋落物分解早期碳氮周转的影响[D]. 哈尔滨: 东北林业大学, 2006: 4–5 LI K X. Nitrogen deposition affects carbon and nitrogen turnover on the early stage of forest litter decomposition[D]. Harbin: Northeast Forestry University, 2006: 4–5
[3] 李云乐, 乔玉辉, 孙振钧, 等. 不同土壤培肥措施下农田有机物分解的生态过程[J]. 生态学报, 2006, 26(6): 1933–1939 LI Y L, QIAO Y H, SUN Z J, et al. The eco-process of agricultural organic matter decomposition under different soil conditions[J]. Acta Ecologica Sinica, 2006, 26(6): 1933–1939
[4] LUCE M S, WHALEN J K, ZIADI N, et al. Labile organic nitrogen transformations in clay and sandy-loam soils amended with15N-labelled faba bean and wheat residues[J]. Soil Biology and Biochemistry, 2014, 68: 208–218
[5] HOLLAND E A, COLEMAN D C. Litter placement effects on microbial and organic matter dynamics in an agroecosystem[J]. Ecology, 1987, 68(2): 425–433
[6] FREY S D, GUPTA V V S R, ELLIOTT E T, et al. Protozoan grazing affects estimates of carbon utilization efficiency of the soil microbial community[J]. Soil Biology and Biochemistry, 2001, 33(12/13): 1759–1768
[7] HUANG P M, WANG M K, CHIU C Y. Soil mineral-organic matter-microbe interactions: Impacts on biogeochemical processes and biodiversity in soils[J]. Pedobiologia, 2005, 49(6): 609–635
[8] SIX J, CONANT R T, PAUL E A, et al. Stabilization mechanisms of soil organic matter: Implications for C-saturation of soils[J]. Plant and Soil, 2002, 241(2): 155–176
[9] 史龙翔. 纤维素降解菌的筛选及其在果树枝条腐解中的应用[D]. 杨凌: 西北农林科技大学, 2015: 7–10 SHI L X. Screening of cellulose degradation baterrium and its application in composition of fruit tree branches[D]. Yangling: Northwest A&F University, 2015: 7–10
[10] 刘海静. 小麦秸秆高效降解菌的筛选及应用效果研究[D]. 北京: 中国农业科学院, 2012: 12–21 LIU H J. Screening of wheat straw degradation strains and application effects[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012: 12–21
[11] 肖胜文. 高效降解纤维素木霉菌株分离与筛选[D]. 长沙: 湖南农业大学, 2013: 18–26 XIAO S W. The screening and isolation of high efficiency cellulose degradation strains[D]. Changsha: Hunan Agricultural University, 2013: 18–26
[12] 李静, 张瀚能, 赵翀, 等. 高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J]. 应用与环境生物学报, 2016, 22(4): 689-696 LI J, ZHANG H N, ZHAO C, et al. Isolation and screening of cellulose decomposing microbe and the straw decomposing effect of complex microbial system[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(4): 689–696
[13] 张广志, 杨合同, 张新建, 等. 木霉现有种类名录[J]. 菌物学报, 2014, 33(6): 1210–1230 ZHANG G Z, YANG H T, ZHANG X J, et al. A checklist of known species of[J]. Mycosystema, 2014, 33(6): 1210–1230
[14] 刘国红, 刘波, 林乃铨, 等. 芽孢杆菌的系统进化及其属分类学特征[J]. 福建农业学报, 2008, 23(4): 436–449 LIU G H, LIU B, LIN N Q, et al. Phyletic evolution and taxonomic characteristics of[J]. Fujian Journal of Agricultural Sciences, 2008, 23(4): 436–449
[15] 汪学军, 闵长莉, 刘彭磊, 等. 牛粪中纤维素降解菌的分离鉴定及其产酶研究[J]. 天然产物研究与开发, 2015, 27(7): 1181–1186 WANG X J, MIN C L, LIU P L, et al. Identification of a cellulolytic actinomycete from cow manure and study on its cellulose-producing conditions[J]. Natural Product Research and Development, 2015, 27(7): 1181–1186
[16] 石其伟, 刘强, 荣湘民, 等. 不同微生物菌剂对水稻秸秆发酵效果的影响[J]. 湖南农业大学学报: 自然科学版, 2006, 32(3): 264–268 SHI Q W, LIU Q, RONG X M, et al. Effects of different microbial agents on fermentation of rice straw in composting[J]. Journal of Hunan Agricultural University: Natural Sciences, 2006, 32(3): 264–268
[17] 王晓娟, 李博文, 刘微, 等. 不同微生物促腐剂在鸡粪好氧堆肥中的应用研究[J]. 水土保持学报, 2011, 25(1): 238–241 WANG X J, LI B W, LIU W, et al. Effects of different microorganisms on chicken manure compost[J]. Journal of Soil and Water Conservation, 2011, 25(1): 238–241
[18] 肖艳萍. 复合微生物秸秆腐熟菌剂的筛选及其对毒死蜱残留的影响[D]. 昆明: 云南农业大学, 2017: 1–84 XIAO Y P. Screening of compound microbial inoculant for straw decomposing and its effect on chlorpyrifos residue[D]. Kunming: Yunnan Agricultural University, 2017: 1–84
[19] 冀颐之, 赵有玺, 程艳玲, 等. 微生物发酵床中黄腐酸生产菌株的筛选及其鉴定[J]. 食品研究与开发, 2018, 39(2): 181–186 JI Y Z, ZHAO Y X, CHENG Y L, et al. Screening and identification of strains to produce fulvic acid from deep litter system[J]. Food Research and Development, 2018, 39(2): 181–186
[20] 李艳, 窦森, 刘艳丽, 等. 微生物对暗棕壤添加玉米秸秆腐殖化进程的影响[J]. 农业环境科学学报, 2016, 35(5): 931–939 LI Y, DOU S, LIU Y L, et al. Effects of different microorganisms on humification of corn stover incorporated in dark brown soil[J]. Journal of Agro-Environment Science, 2016, 35(5): 931–939
[21] 丁杰, 郝艳, 侯佳奇, 等. 接种抗酸化复合菌对餐厨废弃物堆肥酸化缓解及腐殖化的影响[J]. 环境科学研究, 2016, 29(12): 1887–1894 DING J, HAO Y, HOU J Q, et al. Effects of anti-acidification microbial agents (AAMA) on reducing acidification and promoting humification during kitchen waste composting[J]. Research of Environmental Sciences, 2016, 29(12): 1887–1894
[22] 古丽君, 徐秉良, 梁巧兰, 等. 生防木霉对草坪土壤微生物区系的影响及定殖能力研究[J]. 草业学报, 2013, 22(3): 321–326 GU L J, XU B L, LIANG Q L, et al. Impact and colonisation ability ofon lawn soil microflora[J]. Acta Prataculturae Sinica, 2013, 22(3): 321–326
[23] 余贤美, 侯长明, 王海荣, 等. 枯草芽孢杆菌Bs-15在枣树体内和土壤中的定殖及其对土壤微生物多样性的影响[J]. 中国生物防治学报, 2014, 30(4): 497–502 YU X M, HOU C M, WANG H R, et al. Colonization ofBs-15 in jujube plant and soil and its influence on the microbial diversity in the soil[J]. Chinese Journal of Biological Control, 2014, 30(4): 497–502
[24] BURT R. Soil Survey Laboratory Methods Manual[M]. Washington, DC: United States Department of Agriculture, 2004
[25] 龚子同. 中国土壤系统分类-理论·方法·实践[M]. 北京: 科学出版社, 1999: 17GONG Z T. Chinese Soil Taxonomy-Theory·Method·Practice[M]. Beijing: Science Press, 1999: 17
[26] BLIGH E G, DYER W J. Extraction of lipids in solution by the method of Bligh & Dyer[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37: 911–917
[27] MANIRAKIZA P, COVACI A, SCHEPENS P. Comparative study on total lipid determination using Soxhlet, Roese-Gottlieb, Bligh & Dyer, and Modified Bligh & Dyer extraction methods[J]. Journal of Food Composition and Analysis, 2001, 14(1): 93–100
[28] JENSEN S K. Improved Bligh and Dyer extraction procedure[J]. Lipid Technology, 2008, 20(12): 280–281
[29] VARMA A, OELMÜLLER R. Advanced Techniques in Soil Microbiology[M]. Berlin, Germany: Springer, 2007: 182–187
[30] ZHONG W H, GU T, WANG W, et al. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J]. Plant and Soil, 2010, 326(1/2): 511–522
[31] FANG X M, YU D P, ZHOU W M, et al. The effects of forest type on soil microbial activity in Changbai Mountain, Northeast China[J]. Annals of Forest Science, 2016, 73(2): 473–482
[32] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 238–240LU R K. Methods of Chemical Analysis of Soil Agriculture[M]. Beijing: China Agricultural Science and Technology Press, 1999: 238–240
[33] VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703–707
[34] 林启美, 吴玉光, 刘焕龙. 熏蒸法测定土壤微生物量碳的改进[J]. 生态学杂志, 1999, 18(2): 63–66 LIN Q M, WU Y G, LIU H L. Modification of fumigation extraction method for measuring soil microbial biomass carbon[J]. Chinese Journal of Ecology, 1999, 18(2): 63–66
[35] WU J, JOERGENSEN R G, POMMERENING B, et al. Measurement of soil microbial biomass C by fumigation- extraction —An automated procedure[J]. Soil Biology & Biochemistry, 1990, 22(8): 1167–1169
[36] EUDOXIE G D, ALEXANDER I A. Spent mushroom substrate as a transplant media replacement for commercial peat in tomato seedling production[J]. Journal of Agricultural Science, 2011, 3(4): 41–49
[37] 李永兴, 匡柏健, 李久蒂. 不同载体对微生物菌剂质量的影响[J]. 土壤肥料, 1999, (6): 30–32 LI Y X, KUANG B J, LI J D. Influence of different carriers on qualities of microbial manure[J]. Soils and Fertilizers, 1999, (6): 30–32
[38] 陈春玉. 复合微生物菌剂在湖南煤矿区复垦土壤中的应用研究[D]. 长沙: 湖南农业大学, 2015: 1–6 CHEN C Y. Application of complex microbial inoculants in reclamation soil of coal mine area in Hunan Province[D]. Changsha: Hunan Agricultural University, 2015: 1–6
[39] POURREZA M, HOSSEINI S M, SINEGANI A A S, et al. Soil microbial activity in response to fire severity in Zagros oak (Lindl.) forests, Iran, after one year[J]. Geoderma, 2014, 213: 95–102
[40] WEI H, YAN W B, QUAN G M, et al. Soil microbial carbon utilization, enzyme activities and nutrient availability responses toand a non-invasive congener under different irradiances[J]. Scientific Reports, 2017, 7(1): 11309
[41] ROUSK J, Bååth E. Growth of saprotrophic fungi and bacteria in soil[J]. FEMS Microbiology Ecology, 2011, 78(1): 17–30
[42] BLAZEWICZ S J, BARNARD R L, DALY R A, et al. Evaluating rRNA as an indicator of microbial activity in environmental communities: Limitations and uses[J]. ISME Journal, 2013, 7(11): 2061–2068
[43] 车荣晓, 王芳, 王艳芬, 等. 土壤微生物总活性研究方法进展[J]. 生态学报, 2016, 36(8): 2103–2112 CHE R X, WANG F, WANG Y F, et al. A review on the methods for measuring total microbial activity in soils[J]. Acta Ecologica Sinica, 2016, 36(8): 2103–2112
[44] 刘姝, 陆颖健, 陆兆新, 等. 海洋链霉菌GB-2发酵产物的抗细菌活性及性质研究[J]. 生物工程学报, 2007, 23(6): 1077–1081 LIU S, LU Y J, LU Z X, et al. Antibacterial activity and property of the fermentation product of marinesp. GB-2[J]. Chinese Journal of Biotechnology, 2007, 23(6): 1077–1081
[45] 罗文新, 陈晓佳, 黄耀坚, 等. 来自海洋的链霉菌抑菌活性与其培养条件的关系[J]. 微生物学通报, 1998, 25(6): 325–328 LUO W X, CHEN X J, HUANG Y J, et al. Relationship between antimicrobial activity of marinespp. and their culture conditions[J]. Microbiology, 1998, 25(6): 325–328
[46] VAN VEEN J A, VAN OVERBEEK L S, VAN ELSAS J D. Fate and activity of microorganisms introduced into soil[J]. Microbiology and Molecular Biology Reviews, 1997, 61(2): 121–135
[47] 常文智, 马鸣超, 李力, 等. 施用胶质类芽孢杆菌对土壤生物活性和花生产量的影响[J]. 中国土壤与肥料, 2014, (1): 84–89CHANG W Z, MA M C, LI L, et al. Effects ofon soil biological activity and yield of peanut[J]. Soil and Fertilizer Sciences in China, 2014, (1): 84–89
[48] 秦华, 白建峰, 徐秋芳, 等. 丛枝菌根真菌菌丝对土壤微生物群落结构及多氯联苯降解的影响[J]. 土壤, 2015, 47(4): 704–710 QIN H, BAI J F, XU Q F, et al. Effects of arbuscular mycorrhizal fungal hyphae on soil microbial community composition and polychlorinated biphenyls degradation[J]. Soils, 2015, 47(4): 704–710
[49] 邱登林, 阴卫军, 陈建爱, 等. 黄绿木霉T1010对日光温室土壤微生物群落的影响[J]. 山东农业科学, 2011, (1): 59–62 QIU D L, YIN W J, CHEN J A, et al. Effects ofT1010 on soil microflora in solar greenhouse[J]. Shandong Agricultural Sciences, 2011, (1): 59–62
[50] THIET R K, FREY S D, SIX J. Do growth yield efficiencies differ between soil microbial communities differing in fungal: bacterial ratios? Reality check and methodological issues[J]. Soil Biology and Biochemistry, 2006, 38(4): 837–844
[51] AMBROSINI A, DE SOUZA R, PASSAGLIA L M P. Ecological role of bacterial inoculants and their potential impact on soil microbial diversity[J]. Plant and Soil, 2016, 400(1/2): 193–207
[52] LITCHMAN E. Invisible invaders: Non-pathogenic invasive microbes in aquatic and terrestrial ecosystems[J]. Ecology Letters, 2010, 13(12): 1560–1572
[53] BREUER L, HUISMAN J A, KELLER T, et al. Impact of a conversion from cropland to grassland on C and N storage and related soil properties: Analysis of a 60-year chronosequence[J]. Geoderma, 2006, 133(1/2): 6–18
[54] BASTIDA F, Barberá G G, García C, et al. Influence of orientation, vegetation and season on soil microbial and biochemical characteristics under semiarid conditions[J]. Applied Soil Ecology, 2008, 38(1): 62–70
[55] 黄科朝, 沈育伊, 徐广平, 等. 垦殖对桂林会仙喀斯特湿地土壤养分与微生物活性的影响[J]. 环境科学, 2018, 39(4): 1813–1823 HUANG K C, SHEN Y Y, XU G P, et al. Effects of reclamation on soil nutrients and microbial activities in the Huixian Karst Wetland in Guilin[J]. Environmental Science, 2018, 39(4): 1813–1823
Effects of species-combined exogenous decomposing micro-organisms on soil microbial community structure and metabolic activity*
ZHOU Xuan1, LI Yuming2, CONG Cong1, WANG Qianqian1, JIANG Heng3,YUE Longkai1, YAO Shuihong1**
(1. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 2. Center of Agricultural Technology Extension, No. 291 Branch of Heilongjiang Beidahuang Agriculture Company Ltd, Shuangyashan 155923, China; 3. Northeast Institute of Geography and Agro-ecology, Chinese Academy of Sciences, Harbin 150081, China)
An incubation experiment was conducted to study the effects of species combination of exogenous decomposing micro-organisms on soil microbial community structure and metabolic activity. The objective of the study was to lay the basis for the optimization of population configuration of decomposing microbial agents. In the study, three microbe species —(P),(S) and(T) — were selected. For the experiments, in addition to single P, S and T microbe strains, the microbes were merged to produce two species (PT, PS and ST) and three species (PST) combinations of decomposing microorganisms (forming a total of 7 microbial agents). These microbial agents were then added to red soil sampled from Jiangxi Province in South China. Moreover, a control treatment of red soil added with sterile peat was set to the experimental design. During the incubation period, temporal changes in soil respiration rate and microbial biomass carbon were monitored. Additionally, the changes in total PLFAs content and in the proportion of characteristic microbial population in different treatments after 30 days of incubation were determined. The PLFAs percentages of microbial communities showed the total microbial biomass and composition of soil microbial communities. The results showed that, except for ST and PST, most treatments showed that total microbial biomass increased from 17.2% to 121.6% (< 0.05). Compared with the control, the proportion of fungus in all the treatments increased by 8.8%–50.6% (< 0.05). However, the proportion of bacteria in PLFAs remained basically unchanged, increasing from 79.6% to 83.1%. For most of the treatments, except for P and ST, the proportion of actinomyces decreased from 9.4% to 69.8%. Principal component analysis (PCA) of PLFAs data indicated that soil microbial community structure was influenced by different decomposing micro-organisms agents. The change in microbial community structure varied with treatment type, among which single P, S and T microbe strains were smallest and their trio-combination (PST) biggest, compared with the control. The results of soil respiration rate showed the growth of micro-organisms. Treatments of single P and T microbe strains and binary combination of micro-organisms S and T (ST) affected logarithmic growth of soil microbes in the short-term, increasing peak soil respiration rate by 48.7% (P), 53.7% (T) and 78.7% (ST), respectively. Additionally, with increasing number of species of decomposing micro-organisms, it took more time for soil microbes to enter latent phase. From long-term impact of exogenous decomposing micro-organisms on soil fertility, these micro-organisms changed soil microbial metabolic activity, which led to a change in the amount of soil carbon mineralization. The addition of ST combination of microorganisms increased soil microbial metabolic quotient by 28.9%, consequently, the amount of soil carbon mineralization increased by 11.1%. The addition of single S microbe strain decreased soil microbial metabolic quotient by 32.4%, while the amount of soil carbon mineralization only decreased by 7.3%. However, under PS and PST combinations, microbial metabolic activity remained unchanged, while the amount of soil carbon mineralization decreased by 5.8% and 8.7%, separately. There was the need for further study on these treatment combinations. In conclusion, the addition of exogenous decomposing micro-organisms changed soil microbial community structure and growth trajectory. Furthermore, with increasing number of species of decomposing micro-organisms, change in microbial community structure increased. Finally, the study failed to account for any relationship between soil microbial metabolic activity and the number of species of decomposing micro-organisms.
Soil micro-organisms; Exogenous decomposing micro-organism; Species combination; Microbial biomass; Microbial community structure; Microbial metabolic activity; Soil respiration rate
, E-mail: yaoshuihong@caas.cn
Dec. 29, 2017;
Apr. 7, 2018
S154.36
A
1671-3990(2018)07-1056-11
10.13930/j.cnki.cjea.171216
* 国家自然科学基金青年基金项目(31400461)和中国农业科学院知识创新工程农业资源与农业区划研究所优秀青年项目(634-6)资助
尧水红, 主要研究方向为土壤生物物理与微生物生态。E-mail: yaoshuihong@caas.cn 周璇, 研究方向为土壤微生物生态。E-mail: xuanzhou15@163.com
2017-12-29
2018-04-07
* This study was supported by the National Natural Science Foundation of China (31400461) and the Outstanding Youth Project of Agricultural Resources and Agricultural Regionalization Institute from Intellectual Innovation Project of Chinese Academy of Agricultural Sciences (634-6).
周璇, 李玉明, 丛聪, 王倩倩, 江恒, 岳龙凯, 尧水红. 外源腐解微生物的物种组合对土壤微生物群落结构及代谢活性的影响[J]. 中国生态农业学报, 2018, 26(7): 1056-1066
ZHOU X, LI Y M, CONG C, WANG Q Q, JIANG H, YUE L K, YAO S H. Effects of species-combined exogenous decomposing micro-organisms on soil microbial community structure and metabolic activity[J]. Chinese Journal of Eco-Agriculture, 2018, 26(7): 1056-1066

