单核细胞/高密度脂蛋白胆固醇比值与急性ST段抬高型心肌梗死患者短期预后的相关性研究
王慧,尹良平,程丽,江志奎,赵岚
急性ST段抬高型心肌梗死(STEMI)主要是因冠状动脉粥样硬化斑块破裂,导致血管腔急性完全闭塞而引起的心肌细胞坏死,是临床上常见的急危重症之一。虽然介入治疗手段的发展挽救了众多患者的生命,但STEMI的病死率仍高于其他疾病。据相关数据表明,STEMI患者5年内的病死率约为19%,但其中32%左右的死亡发生在住院期间[1]。鉴于该病起病急、变化快且病情重,尽早对STEMI进行危险分层对改善患者的预后来说有重要意义。单核细胞/高密度脂蛋白胆固醇(HDL-C)比值(MHR)是近年来新发现的一种炎症标志物,已被证实与多种心血管疾病相关。例如,研究结果显示MHR可预测冠状动脉的狭窄程度和心房颤动消融术后的复发,并且是慢性肾脏病患者心血管风险的一个良好预测指标[2-4]。然而,关于MHR是否能够预测STEMI患者的短期预后目前尚无定论。本研究通过分析STEMI患者的临床资料,旨在探讨MHR水平与其院内主要不良心脏事件(MACE)的相关性,为高危的STEMI患者提供早期有效的预测指标。
1 资料与方法
1.1 研究对象 选取2012年1月~2017年6月于上海市徐汇区大华医院就诊的STEMI患者367例为研究对象,其中男性243例,女性124例,平均年龄(63.1±12.5)岁。纳入标准:STEMI的临床诊断符合2010年中华医学会心血管病学分会所制定的急性ST段抬高型心肌梗死诊断和治疗指南[5];患者年龄>18岁,且不超过85岁;STEMI的起病时间小于12 h;所有患者均接受急诊经皮冠状动脉介入治疗。排除标准:既往有急性心肌梗死或冠状动脉血运重建病史;合并血液系统疾病、恶性肿瘤、自身免疫性疾病、感染或炎症性疾病的患者;心、肝、肾功能严重不全的患者;正在服用糖皮质激素或非甾体类抗炎药的患者。所有患者均告知实验目的并签署知情同意书。
1.2 资料收集 入院后收集患者的年龄、性别、体质指数、既往病史(包括高血压史、糖尿病史、吸烟史、饮酒史)和药物使用史(β受体阻滞剂、ACEI/ARB类、钙通道阻滞剂)等资料,并记录其生命体征和Killip分级。在完善心电图检查后,立即抽取患者肘静脉血,检测血常规(Sysmex XE-2100血液分析仪)、肌钙蛋白T(Roche E601全自动电化学发光分析仪)和血生化指标(雅培C16000全自动生化分析仪),包括血脂、高敏C反应蛋白、血肌酐、尿酸、血糖等。根据血常规和血脂检测结果计算MHR,MHR=单核细胞计数/高密度脂蛋白胆固醇。
1.3 院内MACE分析 详细记录患者住院期间的MACE发生情况,包括全因死亡、急性心力衰竭、恶性心律失常、再发非致死性心肌梗死等。其中,恶性心律失常是指出现心室颤动、高度房室传导阻滞和室性心动过速等心律失常。
1.4 统计分析 所有数据均采用SPSS 19.0软件进行统计学分析。计量资料以(±s)表示,组间比较采用两独立样本t检验;计数资料以百分比表示,组间比较采用χ2检验。以卡方趋势检验分析不同MHR水平组患者院内MACE的发生趋势。采用多因素Logistic回归的方法分析影响STEMI患者院内MACE发生的独立因素,并以ROC曲线描述MHR对院内MACE的预测价值。仅当P<0.05时,认为差异具有统计学意义。
2 结果
2.1 一般资料比较 MACE组患者的年龄、心率和Killip分级≥Ⅱ级的比例明显高于非MACE组患者,差异具有统计学意义(P<0.05)。而两组患者在性别、体质指数、高血压史、糖尿病史、吸烟史、饮酒史、心血管药物使用情况和血压等方面无显著差异(表1)。
2.2 实验室检查结果比较 MACE组患者的肌钙蛋白T、高敏C反应蛋白和血尿酸水平明显高于非MACE组患者,差异具有统计学意义(P<0.05)。两组患者在血常规、血脂、血肌酐和入院血糖等方面无显著差异(表2)。

表1 一般资料的比较
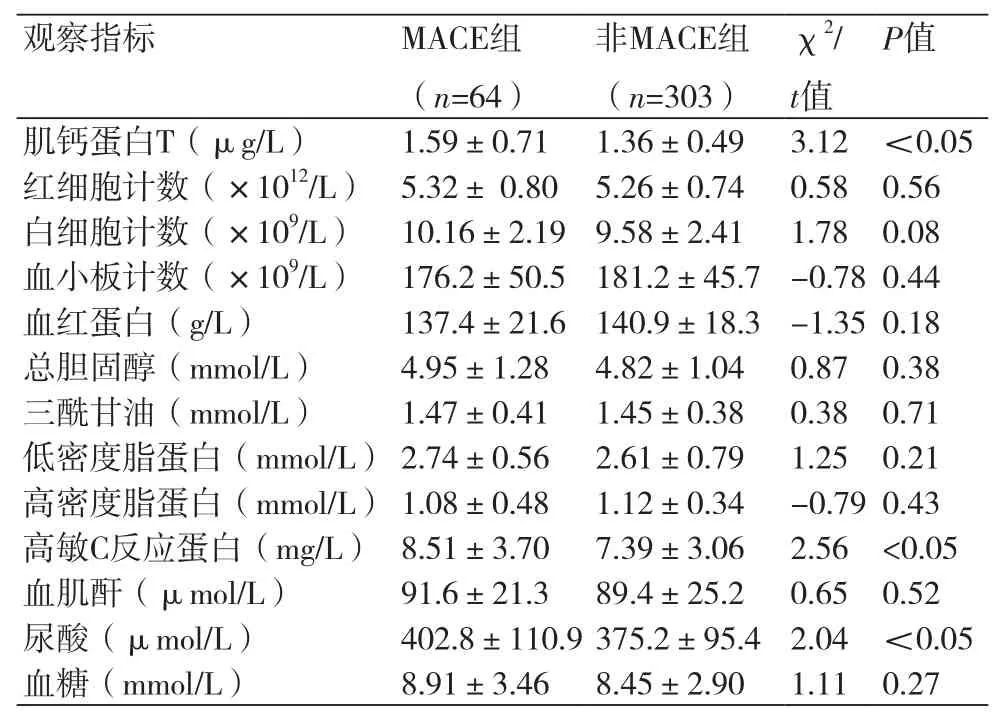
表2 实验室检查结果的比较
2.3 MHR水平与MACE的关系 与非MACE组相比,MACE组患者的MHR水平显著升高[(1.07±0.42)×109vs.(0.79±0.33)×109],差异具有统计学意义(P<0.01)。以所有患者MHR水平的三个四分位数为界点,将患者分为4组,随着STEMI患者MHR水平的增高,院内MACE的发生率也逐渐增加(χ2=17.33,P<0.01)(图1)。
2.4 多因素Logistic回归分析 对影响患者院内MACE发生的指标进行多因素Logistic回归分析,其中自变量为上述P值<0.1的指标,因变量为院内MACE的发生与否。结果表明,MHR水平是STEMI患者发生院内MACE的独立预测因素(OR=2.14,95%CI:1.27~3.62;P<0.01)。其他与STEMI患者院内MACE发生的相关因素包括年龄、Killip分级和肌钙蛋白T水平等(表3)。
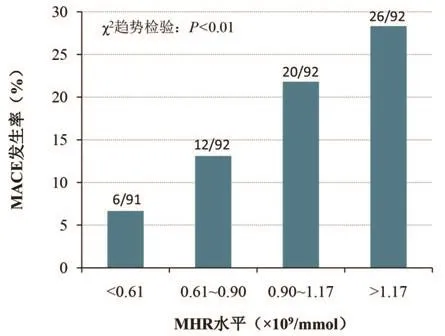
图1 不同MHR水平患者院内MACE发生情况
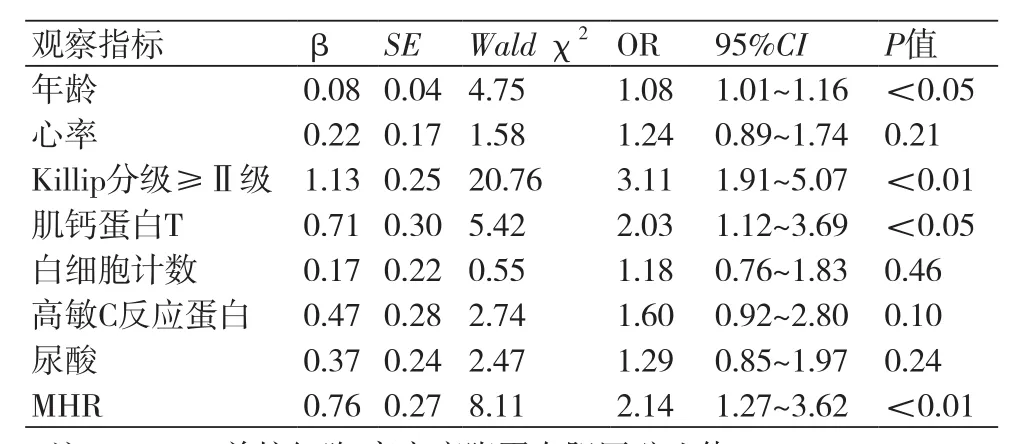
表3 影响院内MACE的多因素Logistic回归分析
2.5 ROC曲线分析 MHR水平预测STEMI患者院内MACE发生的ROC曲线下面积为0.81(95%CI0.75~0.86;P<0.01)。其最佳数值为0.89×109,预测的敏感性为70.3%,特异性为81.4%(图2)。
3 讨论
STEMI是严重威胁人类生命的急症之一,起病后可迅速引起心力衰竭、恶性心律失常和心源性休克等并发症,病情严重者甚至在短时间内发生死亡。因此,尽早对STEMI患者进行危险分层,进而采取相应的干预措施,有助于改善患者预后。本研究结果表明,STEMI患者入院早期的MHR水平与院内MACE的发生密切相关,且高MHR水平可独立预测院内MACE的发生,其预测具有良好的敏感性和特异性。同时,我们也发现年龄、Killip分级和肌钙蛋白T水平也可预测STEMI院内MACE的发生,这些结果与其他学者所报道的一致[6-8]。
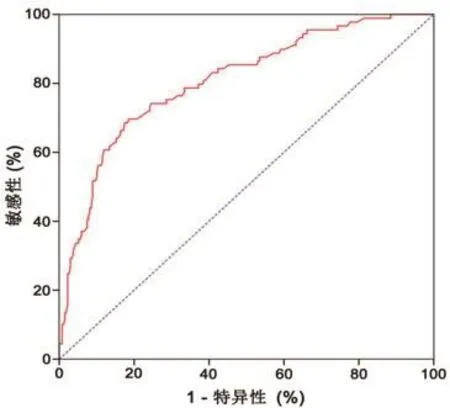
图2 MHR水平预测STEMI患者院内MACE的ROC曲线
单核细胞活化在动脉粥样硬化的发生发展中起到重要作用。血管内皮功能受损后,循环中的单核细胞可黏附于血管壁并迁移至内皮下,随后发育成巨噬细胞及分化成泡沫细胞[9]。而后者形成脂质核心,同血管平滑肌细胞一起构成纤维帽,进而形成动脉粥样斑块。此外,泡沫细胞还可分泌炎症因子、组织因子、生长因子和基质金属蛋白酶,促进斑块的生长、破裂[10]。在粥样斑块发生、发展的过程中产生的各种细胞因子可用于机体造血组织,刺激单核细胞代偿性增生。故外周血单核细胞作为组织巨噬细胞和泡沫细胞的来源,其数量升高被认为可预测斑块进展[11]。而HDL-C被称作经典的抗动脉粥样硬化脂蛋白,有抗炎、抗氧化和抗血栓形成等作用[12]。HDL-C可介导动脉管壁胆固醇的逆转运,降低内皮细胞粘附因子的表达,阻止单核细胞的活化和迁徙,并遏制斑块的进展和促进斑块的稳定[13]。HDL-C也通过直接作用于单核细胞而表现出抗炎作用[14]。因此我们认为,MHR作为单核细胞和HDL-C的比值不仅综合了炎症反应的信息,也可反应斑块的稳定状态,故可能与STEMI患者院内MACE的发生具有一定的相关性。
目前国内外关于MHR与STEMI之间关系的报道相对较少。Arisoy等研究纳入414例STEMI患者,发现入院早期的MHR水平可独立预测这些患者冠状动脉内的血栓负荷[15]。而Balta的研究结果表明,MHR水平还可能与接受急诊经皮冠状动脉治疗的STEMI患者的无复流现象有关[16]。本研究通过分析MACE和非MACE组患者的临床资料,发现MHR水平可作为STEMI患者的短期预后的一个评估指标。但本研究仍有以下不足:本研究为观察性研究,可能存在一定的选择偏倚;未对MHR水平进行动态观察,不能明确MHR水平变化与院内MACE发生的相关性;研究样本量偏小且为单中心分析,尚需大样本多中心的临床研究验证MHR对STEMI患者早期MACE的预测价值。
综上所述,STEMI患者入院时的MHR水平与其院内MACE的发生密切相关,且高MHR水平是STEMI患者发生院内MACE的独立危险因素。MHR仅需检测血常规和血脂便可获得,且相对经济便宜,因此可作为STEMI高危患者的一个简单有效地预测指标。
[1]American College of Emergency Physicians; Society for Cardiovascular Angiography and Interventions. ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction[J]. J Am Coll Cardiol,2013,61(4):e78-140.
[2]Akboga MK,Balci KG,Maden O,et al. Usefulness of monocyte to HDL-cholesterol ratio to predict high SYNTAX score in patients with stable coronary artery disease[J]. Biomark Med, 2016, 10(4):375-83.
[3]胡晓,张静,周学军,等. 单核细胞与高密度脂蛋白比值对阵发性房颤射频消融术后复发的影响[J]. 中国急救医学,2016,36(5):406-10.
[4]Kanbay M,Solak Y,Unal HU,et al. Monocyte count/HDL cholesterol ratio and cardiovascular events in patients with chronic kidney disease[J]. Int Urol Nephrol,2014,46(8):1619-25.
[5]中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 急性ST段抬高型心肌梗死诊断和治疗指南[J]. 中华心血管病杂志,2015,43(5):380-93.
[6]杨锦龙,刘欢,周学锋,等. 中性粒细胞/淋巴细胞比值对ST段抬高型心肌梗死患者PCI术后心血管不良事件的预测价值 [J]. 中国循证心血管医学杂志,2016,8(10):1216-9.
[7]Bolat I,Akgul O,Cakmak HA,et al. The prognostic value of admission mean platelet volume to platelet count ratio in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. Kardiol Pol,2016,74(4):346-55.
[8]Wang TK,Snow TA,Chen Y,et al. High-sensitivity troponin level precatheterization predicts adverse cardiovascular outcomes after primary angioplasty for ST-elevation myocardial infarction[J]. Eur Heart J Acute Cardiovasc Care,2014,3(2):118-25.
[9]Hilgendorf I,Swirski FK,Robbins CS,et al. Monocyte fate in atherosclerosis[J]. Arterioscler Thromb Vasc Biol,2015,35(2):272-9.
[10]Yu XH,Fu YC,Zhang DW,et al. Foam cells in atherosclerosis [J]. Clin Chim Acta, 2013, 424:245-52.
[11]Nozawa N,Hibi K,Endo M,et al. Association between circulating monocytes and coronary plaque progression in patients with acute myocardial infarction[J]. Circ J,2010,74(7):1384-91.
[12]Choi HY,Hafiane A,Schwertani A,et al. High-density lipoproteins:biology, epidemiology, and clinical management[J]. Can J Cardiol,2017,33(3):325-33.
[13]Berrougui H,Momo CN,Khalil A. Health benefits of high-density lipoproteins in preventing cardiovascular diseases[J]. J Clin Lipidol,2012,6(6):524-33.
[14]Thacker SG,Zarzour A1,Chen Y,et al. High-density lipoprotein reduces inflammation from cholesterol crystals by inhibiting inflammasome activation[J]. Immunology,2016,149(3):306-19.
[15]Arisoy A,Altunkas F,Karaman K,et al. Association of the monocyte to HDL cholesterol ratio with thrombus burden in patients with ST-segment elevation myocardial infarction[J]. Clin Appl Thromb Hemost,2017,23(8):992-7.
[16]Balta S,Celik T,Ozturk C,et al. The relation between monocyte to HDL ratio and no-reflow phenomenon in the patients with acute ST-segment elevation myocardial infarction[J]. Am J Emerg Med,2016,34(8):1542-7.

