类黄酮对油菜脂肪酸积累的影响及其分子机制
严涛,玄立杰,蒋立希
(浙江大学农业与生物技术学院,杭州310058)
植物油是人类生命活动所需要的基本营养物质之一,与我们的日常生活息息相关。常用的植物油主要有大豆油、菜籽油、橄榄油、花生油、葵花籽油等,不同植物油的脂肪酸组分不同,其营养价值也不同。油菜(Brassica napus L.)作为世界上广泛种植的油料作物,在油用作物中具有十分重要的地位。据估计,2016年我国油菜种植面积达到710万hm2,尤其在长江流域有较大的种植面积;菜籽油作为4大食用油之一,占植物油供给总量的55%以上[1]。但与此同时,我国油菜生产面临着种植面积不断减小、广适高抗强优品种缺乏等一系列问题[2],其中最突出的问题是我国油菜籽含油量比世界上其他国家明显偏低。我国大部分油菜主栽品种的种子含油量大约为41%,比德国、加拿大等国家的油菜籽含油量低3~5个百分点,这直接导致了我国油菜籽在植物油加工市场上竞争力不足。因此,大幅度提高我国油菜籽含油量是解决我国植物油供需不平衡、改变严重依赖进口现状的突破口。
影响油菜种子含油量的因素有很多,其中在油菜种子油脂积累过程中,类黄酮是影响油菜种子含油量尤其是脂肪酸组分的重要因素。高通量转录组测序分析发现,涉及类黄酮及脂肪酸合成的基因表达水平在种子成熟过程中发生显著变化,导致油菜种子中的油酸(C18:1)显著降低,亚油酸(C18:2)和α-亚麻酸(C18:3)显著增加[3]。这说明参与类黄酮生物合成调控的基因也会调控油菜种子脂肪酸的合成积累[3]。本文将着重介绍近年来有关类黄酮与脂肪酸含量的相关性及其分子机制的最新研究进展。
1 种子中的油脂代谢
脂类物质是细胞膜的重要组成成分,具有信号转导、膜蛋白运输与定位和能量贮存等生物学功能[4]。三酰甘油(triacylglycerols,TAG)是种子油脂的主要形式,与油体蛋白一起构成油滴(oilbody);三酰甘油水解形成游离态脂肪酸,在种子细胞中不能稳定存在[5-6]。在植物细胞中,脂肪酸的合成起始于细胞质中的乙酰辅酶A(AcCoA),在乙酰辅酶A羧化酶(HtACCase)的催化作用下生成丙二酰辅酶A[7];之后在丙二酰辅酶A转移酶的作用下,将丙二酰基转移到酰基载体蛋白(acyl carrier protein,ACP)上,为脂肪酸碳链的延伸提供碳原子[8],然后在脂肪酸合成酶复合体(fatty acid synthase,FAS)的作用下完成聚合反应,每次反应结束得到增加2个碳原子的酰基碳链。与此同时,酰基碳链又与ACP结合,重复上述反应直至形成16:0-ACP和18:0-ACP,然后脂肪酸被运输到内质网中进行碳链的延长和脱饱和,最后生成三酰甘油(TAG)[9-11]。TAG是植物体内脂肪酸的主要存在形式,彼此之间不能够聚合存在,而是以微滴的形式稳定分散于细胞内,即为油滴(图1)[12]。
植物体内脂肪酸的去饱和是在脱饱和酶的作用下完成的,存在于植物体内的不饱和脂肪酸主要为油酸(C18:1)、亚油酸(C18:2)和亚麻酸(C18:3)。油酸的脱饱和可以分为2部分,首先在脂肪酸去饱和酶(fatty acid desaturase,FAD)的作用下生成亚油酸(C18:2),之后继续在FAD的作用下生成亚麻酸(C18:3)。在质体中,第1部分由FAD6催化完成,第2部分由FAD7和FAD8催化完成[13-14]。在内质网中,2部分依次由FAD2、FAD3催化完成。油菜种子中主要存在8种脂肪酸,分别为C16:0、C18:0、C18:1、C18:2、C18:3、C20:0、C20:1和C22:1[12]。
2 类黄酮的合成、调控与分布
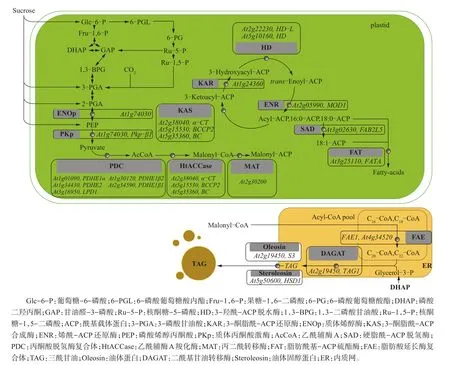
图1 植物成熟种胚中碳源代谢及TAG合成调控网络[12]Fig.1 Simplified scheme of carbon metabolism leading to triacylglycerol synthesis in maturing plant embryos[12]
类黄酮作为自然界分布最广泛的次级代谢产物之一,在植物的生长发育过程中扮演着重要角色。类黄酮可以帮助植物抵御逆境胁迫,比如:在紫外线照射下为植物提供保护,清除自由基[15-16];提高种子贮藏能力,延长寿命[17];改变花瓣颜色[18];干扰生长素的极性分布[19];影响脂肪酸的积累和组分[3]。
2.1 类黄酮的合成与调控
类黄酮可以分为黄酮醇、花青素、原花青素3部分,其合成过程[20]如图2所示。首先,丙二酰辅酶A与肉桂酰辅酶A在查尔酮合酶(chalcone synthase,CHS)的作用下开始合成类黄酮,由于TT4(TRANSPARENT TESTA4)基因编码CHS蛋白,因此TT4基因直接调控类黄酮合成;紧接着在TT5基因的作用下合成柚皮素(naringenin),然后在TT6和TT7的作用下合成黄酮醇。花青素和原花青素则是在其他一系列TT及TTG家族基因的作用下完成的。
类黄酮的合成是在多种酶的协调配合下完成的。到目前为止,17个与类黄酮合成转运和调控相关的蛋白已经被鉴定,包括功能蛋白(DFR,CHS,CHI,F3H,LDOX,FLS1,ANR)、调控蛋白(TT1,TT2,TT8,TT16,TTG1,TTG2)及可能与类黄酮分区相关的蛋白(TT12,TT19,AHA10)。其中TT19编码GST蛋白,该蛋白可以影响花青素和原花青素的合成,很可能参与原花青素在细胞质中的转运[21]。
2.2 种子中类黄酮的分布
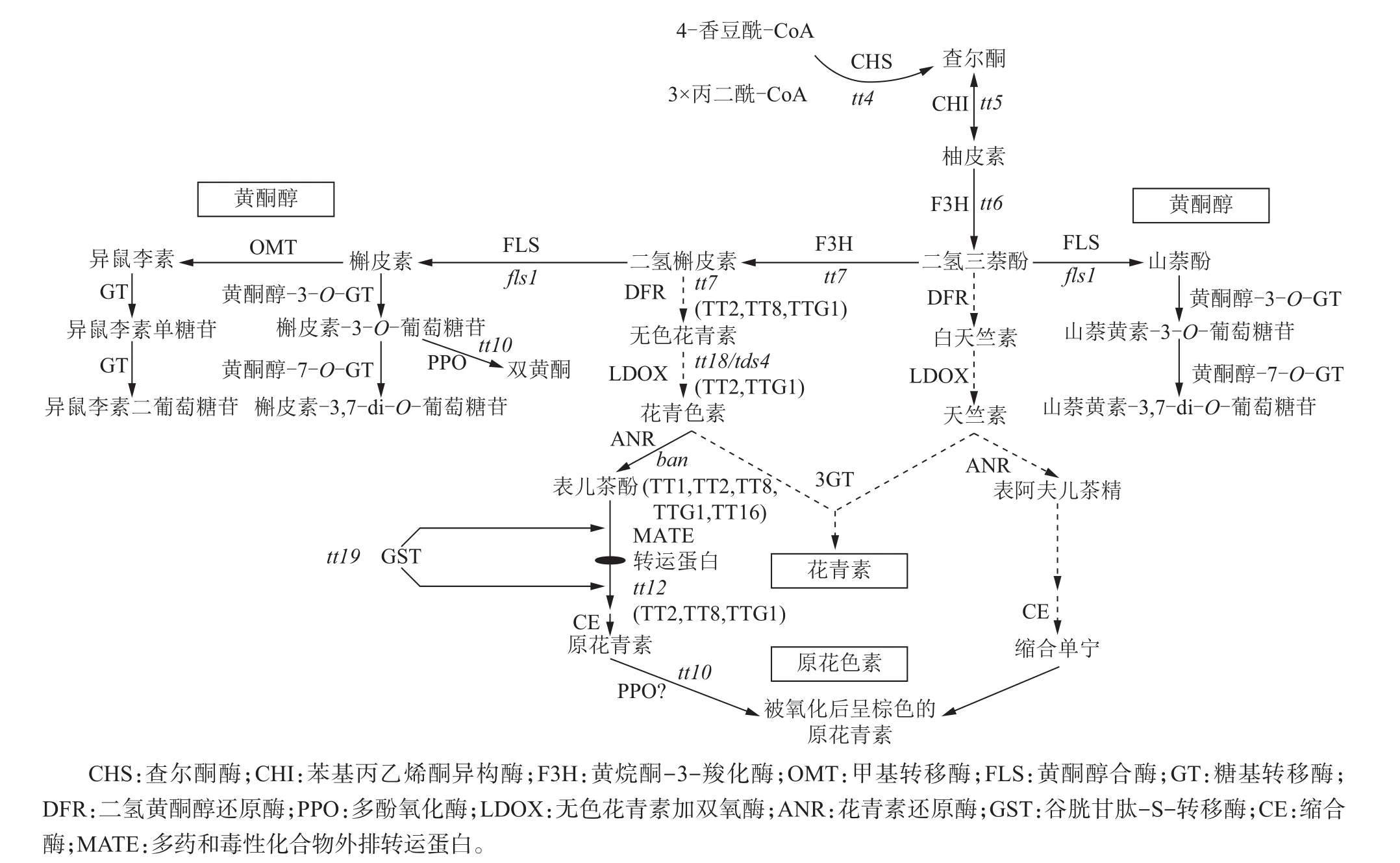
图2 种子类黄酮合成示意图[20]Fig.2 diagram of flavonoid biosynthetic pathway in seed[20]
类黄酮在大多数植物种子中都存在。在拟南芥(Arabidopsis thaliana L.)种子中仅有黄酮醇与原花青素的积累,其中黄酮醇在种胚与种皮中均存在。在成熟的拟南芥种子中,槲皮素-3-O-鼠李糖苷(quercetin-3-O-rhamnoside,Q-3-O-R)是黄酮醇的主要存在形式,而种子中90%的槲皮苷积累于种皮中。槲皮苷的形成需要以鼠李糖为底物,通过糖基化的作用形成。原花青素只存在于拟南芥种皮中,为胚乳和种胚提供保护[20]。在油菜种皮中原花青素的积累与拟南芥相似,同样积累于油菜的内种皮中,并以游离态与结合态2种形式存在[22]。
3 类黄酮对种子含油量的调控及机制
一直以来,黄籽油菜由于其高含油量和高品质获得了育种家们的高度关注[23-24]。有研究表明,拟南芥中黄籽含油量增多并非由单纯的种胚比例增多导致,其胚中脂肪酸合成效率也同样得到提高[11]。CHEN等[25]和WANG等[26]的研究表明,TT2和TT8基因可直接或间接调控脂肪酸合成基因的功能,从而提高胚中脂肪酸的合成效率。本节将从以下几点来综述类黄酮影响脂肪酸含量及其组分的作用机制。
3.1 类黄酮对种子脂肪酸形成的抑制作用
由于TT4是调控类黄酮合成的第一步,因此在tt4突变体中检测不到类黄酮的存在,这也导致tt4突变体的种子呈黄色。研究表明,拟南芥TT家族突变体均具有含油量高的特点[26],其中tt2和tt8突变体高含油量的机制已经被初步阐明[27]。TTG1(TRANSPARENT TESTA GLABRA1)在种子发育过程中调控类黄酮的合成,包括主要存在于种皮中的原花青素;通过对ttg1突变体的研究发现,其种皮中由于原花青素含量相对较少,因而呈现相对较浅的颜色[21]。最近的研究表明,由SK11/12(SHAGGY-like kinases 11/12)介导的TTG1磷酸化会增强种胚中脂肪酸的合成,同时抑制种皮中黏液和类黄酮的合成,类黄酮通过与脂肪酸竞争合成底物进而抑制脂肪酸的合成[28]。
3.2 类黄酮缺失对种子脂肪酸的影响
Gl2是黏液合成途径中的一个重要转录因子。Gl2功能缺陷会引起种子黏液缺失,从而导致gl2突变体种子含油量显著高于野生型;同时,gl2突变体中更多的鼠李糖被转化为葡萄糖,然后转运至种胚中用于脂肪酸的合成[29]。槲皮素-3-O-鼠李糖苷是种子类黄酮的主要存在形式,超过90%的Q-3-O-R积累在种皮中[20]。也就是说,在种皮发育过程中需要大量的鼠李糖用于类黄酮与黏液的合成。TTG1的磷酸化会抑制TTG1与TT2的相互作用,进而下调GLABRA2的表达,最终使得种胚中脂肪酸合成降低[28]。因此,类黄酮缺失会导致种子脂肪酸含量增加。
3.3 类黄酮通过影响生长素进而调控脂肪酸积累
作为植物激素,生长素在植物的生长发育过程中具有多种作用。在植物体内,生长素的合成主要是在TAA(TRYPTOPHAN AMINOTRANSFERASE OF ARABIDOPSIS)及YUC(YUCCA)家族酶的作用下完成的[30]。黄酮醇可以通过与生长素极性输出抑制剂萘基酞氨酸(naphthylphthalamic acid,NPA)竞争细胞膜结合位点,进而影响生长素的极性运输[31]。质膜极性定位的PIN(PIN-FORMED)蛋白家族在植物体内介导生长素从细胞内极性输出。PIN家族蛋白可以与NPA相互作用,从而干扰胞内生长素的极性输出,在经NPA处理的种胚中可以检测到生长素含量上升[32]。在tt4突变体根部检测到了增多的生长素运输,同时PIN家族基因的表达量发生变化[33]。通过体外胚珠培养方法对发育中的拟南芥种子进行外施生长素或NPA处理,发现外源生长素与NPA可以促进种子含油量的升高,结合生长素可以延缓衰老的特点,推测由于类黄酮的缺失引起生长素升高,进而使种子有更多的时间和能量用于碳源的合成转化,最后导致种子含油量的升高。因此,生长素在类黄酮对含油量的负调控过程中具有不可替代的作用[28]。
4 结语
类黄酮会抑制种子脂肪酸的积累。类黄酮的缺失引起荚果延缓衰老,使更多的碳源流入种胚中,增加的碳源刺激糖酵解途径的发生,进而产出更多的糖酵解中间产物。这些产物可能用于类黄酮、木质素、氨基酸、脂肪酸等合成。但是,糖酵解产物并非均匀流入各个途径中,而是更多地分配到脂肪酸合成途径中。类黄酮作为最重要的次级代谢产物之一,通过对生长素等的调控,对种子中碳源分布进行调控和重分配,进而影响种子脂肪酸的合成与积累。在油菜育种中,我们期望能够育成脂肪酸含量高的品种,而类黄酮的缺失一方面可以提高十字花科油籽的油脂积累,另一方面却导致油菜抗逆性减弱[34]。因此,如何平衡类黄酮的正负功效,最大限度地发挥黄籽油菜的优势,是油菜育种和实际生产中的重要挑战和机遇。随着经济的发展,人们越来越追求植物油的品质,如何在保证含油量的同时提高植物油品质也是今后育种工作者需要解决的问题。研究表明,参与类黄酮合成的基因也会调控脂肪酸组分的积累,进而影响脂肪酸组分,当类黄酮缺失或者合成减少时,油菜种子中的油酸(C18:1)含量显著降低,亚油酸(C18:2)和α-亚麻酸(C18:3)含量显著增加[3]。今后如何能够在油菜现有碳源的基础上对碳源进行重分配,使得碳源更多地流入我们需要的营养物质中,不失为一种提高油菜种子含油量的有效途径。
:
[1] 国家粮油信息中心.2016年1—12月中国进口食用植物油数据.http://www.grainmarket.com.cn.China National Grain and Oils Information Center.Data of imported edible oil from January to December in 2016.http://www.grainmarket.com.cn.
[2] 关周博,田建华,董育红.我国油菜发展的现状、面临的问题以及应对策略.陕西农业科学,2016,62(3):99-101.GUAN Z B,TIAN J H,DONG Y H.Current situation,problems and countermeasures of rapeseed development in China.Shaanxi Journal of Agricultural Sciences,2016,62(3):99-101.(in Chinese)
[3] LIAN J P,LU X C,YIN N W,et al.Silencing of BnTT1 family genes affects seed flavonoid biosynthesis and alters seed fatty acid composition in Brassica napus.Plant Science,2017,254:32-47.
[4] LI N N,XU C C,LI-BEISSON Y H,et al.Fatty acid and lipid transport in plant cells.Trends in Plant Science,2016,21(2):145-158.
[5] BAUD S,BOUTIN J P,MIQUEL M,et al.An integrated overview of seed development in Arabidopsis thaliana ecotype WS.Plant Physiology and Biochemistry,2002,40(2):151-160.
[6] O’NEILL C M,GILL S,HOBBS D,et al.Natural variation for seed oil composition in Arabidopsis thaliana.Phytochemistry,2003,64(6):1077-1090.
[7]KONISHI T,SHINOHARA K,YAMADA K,et al.Acetyl-CoA carboxylase in higher plants:Most plants other than Gramineae have both the prokaryotic and the eukaryotic forms of this enzyme.Plant and Cell Physiology,1996,37(2):117-122.
[8] OHLROGGE J,BROWSE J.Lipid biosynthesis.Plant Cell,1995,7(7):957-970.
[9] HOBBS D,LU C F,HILLS M J.Cloning of a cDNA encoding diacylglycerol acyltransferase from Arabidopsis thaliana and its functional expression.FEBS Letters,1999,452(3):145-149.
[10]ROUTABOUL J M,BENNING C,BECHTOLD N,et al.The TAG1 locus of Arabidopsis encodes for a diacylglycerol acyltransferase.Plant Physiology and Biochemistry,1999,37(11):831-840.
[11]ZOU J T,WEI Y D,JAKO C,et al.The Arabidopsis thaliana TAG1 mutant has a mutation in a diacylglycerol acyltransferase gene.The Plant Journal,1999,19(6):645-653.
[12]BAUD S,LEPINIEC L.Regulation of de novo fatty acid synthesisin maturing oilseedsofArabidopsis.Plant Physiology and Biochemistry,2009,47(6):448-455.
[13]IBA K,GIBSON S,NISHIUCHI T,et al.A gene encoding a chloroplast omega-3 fatty acid desaturase complements alterations in fatty acid desaturation and chloroplast copy number of the fad7 mutant of Arabidopsis thaliana.Journal of Biological Chemistry,1993,268(32):24099-24105.
[14]MCCONN M,HUGLY S,BROWSE J,et al.A mutation at the fad8 locus of Arabidopsis identifies a second chloroplast ω-3 desaturase.Plant Physiology,1994,106(4):1609-1614.
[15]LI J Y,OULEE T M,RABA R,et al.Arabidopsis flavonoid mutants are hypersensitive to UV-B irradiation.The Plant Cell,1993,5(2):171-179.
[16]TREUTTER D.Significance offlavonoidsin plant resistance and enhancement of their biosynthesis.Plant Biology,2010,7(6):581-591.
[17]DEBEAUJON I,LÉONKLOOSTERZIEL K M,KOORNNEEF M.Influence of the testa on seed dormancy,germination,and longevity inArabidopsis.Plant Physiology,2000,122(2):403-414.
[18]MOLA J,GROTEWOLD E,KOESA R.How genes paint flowers and seeds.Trends in Plant Science,1998,3(6):212-217.
[19]BUER C S,MUDAY G K.The transparent testa4 mutation prevents flavonoid synthesis and alters auxin transport and the response of Arabidopsis roots to gravity and light.The Plant Cell,2004,16(5):1191-1205.
[20]ROUTABOUL J M,KERHOAS L,DEBEAUJON I,et al.Flavonoid diversity and biosynthesis in seed of Arabidopsis thaliana.Planta,2006,224(1):96-107.
[21]LEPINIEC L,DEBEAUJON I,ROUTABOUL J M,et al.Genetics and biochemistry of seed flavonoids.Annual Review of Plant Biology,2006,57:405-430.
[22]AUGER B,MARNET N,GAUTIER V,et al.A detailed survey of seed coat flavonoids in developing seeds of Brassica napus L.Journal of Agricultural and Food Chemistry,2010,58(10):6246-6256.
[23]YU C Y.Molecular mechanism of manipulating seed coat coloration in oilseed Brassica species.Journal of Applied Genetics,2013,54(2):135-145.
[24]WANG F L,HE J W,SHI J H,et al.Embryonal control of yellow seed coat locus ECY1 is related to alanine and phenylalanine metabolism in the seed embryo of Brassica napus.G3:Genes,Genomes,Genetics,2016,6(4):1073-1081.
[25]CHEN M X,MAODZEKA A,ZHOU L H,et al.Removal of DELLA repression promotes leaf senescence in Arabidopsis.Plant Science,2014,219/220:26-34.
[26]WANG Z,CHEN M X,CHEN T L,et al.TRANSPARENT TESTA2 regulates embryonic fatty acid biosynthesis by targeting FUSCA3 during the early developmental stage of Arabidopsis seeds.The Plant Journal,2014,77(5):757-769.
[27]CHEN M X,WANG Z,ZHU Y N,et al.The effect of transparent TESTA2 on seed fatty acid biosynthesis and tolerance to environmental stresses during young seedling establishment in Arabidopsis.Plant Physiology,2012,160:1023-1036.
[28]LI C X,ZHANG B,CHEN B,et al.Site-specific phosphorylation of TRANSPARENT TESTA GLABRA1 mediates carbon partitioning in Arabidopsis seeds.Nature Communications,2018,9:571.
[29]SHI L,KATAVIC V,YU Y Y,et al.Arabidopsis glabra2 mutant seeds deficient in mucilage biosynthesis produce more oil.The Plant Journal,2012,69(1):37-46.
[30]MASHIGUCHI K,TANAKA K,SAKAI T,et al.The main auxin biosynthesis pathway in Arabidopsis.Proceedings of the National Academy of Sciences of the USA,2011,108(45):18512-18517.
[31]BROWN D E,RASHOTTE A M,MURPHY A S,et al.Flavonoids act as negative regulators of auxin transport in vivo inArabidopsis.Plant Physiology,2001,126:524-535.
[32]WEIJERS D,SAUER M,MEURETTE O,et al.Maintenance of embryonic auxin distribution for apical-basal patterning by PIN-FORMED-dependent auxin transport in Arabidopsis.The Plant Cell,2005,17(9):2517-2526.
[33]PEER W A,BANDYOPADHYAY A,BLAKESLEE J J,et al.Variation in expression and protein localization of the PIN family of auxin efflux facilitator proteins in flavonoid mutants with altered auxin transportin Arabidopsis thaliana.The Plant Cell,2004,16(7):1898-1911.
[34]XUAN L J,HUSSAIN N,WANG Z,et al.Comparison of vitality between seedlings germinated from black-coated and yellow-coated seeds of a turnip rape(Brassica rape L.)subjected to NaCl and CdCl2stresses.Plant Growth Regulation,2015,76(1):61-70.

