康莱特注射液联合GP治疗晚期非小细胞肺癌的临床分析
韩蓓 康军英 李复红
非小细胞肺癌(non-small cell lung cancer, NSCLC)在肺癌患者中占80%左右,大部分临床就诊时处于晚期,失去手术机会,主要选择化疗治疗[1-4]。目前临床治疗晚期NSCLC化疗方案较多,如吉西他滨+顺铂(gemcitabine+cisplatin, GP),但化疗不良反应多,加上晚期NSCLC患者体质差,化疗耐受性差,除了增加患者痛苦外,还会影响其生存质量[5]。因此在采取相关措施保证化疗效果基础上减轻不良反应,增强机体免疫功能,改善患者存活质量为近年来研究重点[6]。康莱特注射液由中药薏苡仁提炼而成,具有抗肿瘤、调节免疫功能双重作用,研究显示,康莱特注射液不仅能增强化疗治疗NSCLC效果,减轻不良反应,而且能改善患者免疫功能[7-8]。本文通过与单纯GP化疗方案治疗比较,重点分析康莱特注射液治疗对晚期NSCLC患者免疫功能、炎性因子的影响,现报道如下。
资料与方法
一、一般资料
选择本院2014年1月至2017年3月收治的晚期NSCLC患者200例,入选标准:①临床分期选择2009年国际抗癌联盟(Union for International Cancer Control, UICC)NSCLC标准,均为Ⅲ~Ⅳ期;②预期存活时间>3个月;③均接受GP化疗方案治疗;④相关资料完整[9]。排除标准:①肝肾功能严重障碍;②近期抗肿瘤相关药物干预史;③相关药物过敏者;④合并严重感染、脑转移者;⑤用药依从性差者;⑥资料不全者。根据不同治疗方法将其分为观察组与对照组。观察组99例患者中男62例,女37例,年龄50~78岁,平均(60.58±6.13)岁;其中腺癌52例,鳞癌44例,腺鳞癌3例;Ⅲ期48例,Ⅳ期51例。对照组101例患者中男65例,女36例,年龄49~79岁,平均(61.02±6.25)岁;其中腺癌55例,鳞癌43例,腺鳞癌3例;Ⅲ期50例,Ⅳ期51例。对比两组性别、年龄、病理分型、肿瘤分期差异均无统计学意义(P>0.05)。
二、研究方法
对照组采取单纯GP化疗方案治疗,吉西他滨(江苏奥赛康药业股份有限公司生产,国药准字H20093698)1 000 mg/m2经生理盐水250 ml稀释后静滴,0.5 h内滴完,1次/d,第1、8天;顺铂(齐鲁制药有限公司生产,国药准字H20023460)25 mg/m2经生理盐水500 ml稀释后静滴,2 h内滴完,1次/d,第1~3天。1周期21 d,干预2周期。观察组则行康莱特注射液联合GP治疗,其中GP化疗方案同对照组,另康莱特注射液(浙江康莱特药业有限公司生产,国药准字Z10970091)从化疗前1 d开始应用,200 ml静滴,1次/d,连续干预10 d,随化疗连续干预2个周期。
近期疗效以实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)1.0为依据,包括完全缓解(目标病灶消失且维持≥4周)、部分缓解(基线病灶长径总和缩小≥30%且维持≥4周)、稳定(介于部分缓解与疾病进展期)、疾病进展(基线病灶长径总和增大≥20%或新病灶出现)四个等级,有效率=完全缓解率+部分缓解率+稳定率,疾病控制率=100%-疾病进展率。观察记录两组不良反应情况,包括白细胞减少、恶心呕吐等[10]。
生存质量改善以卡氏评分(Karnofsky, KPS)为依据,改善:KPS评分较治疗前上升≥10分;稳定:KPS评分上升或下降<10分;下降:KPS评分下降≥10分。生存质量改善率=100%-降低率。治疗前后空腹采集患者外周静脉血3 ml,通过美国BD FACSCantoTM Ⅱ 流式细胞仪测定CD3+、CD4+、CD8+,计算CD4+/CD8+比值。治疗前后清晨空腹采集两组患者外周静脉血3 ml,常规离心血清后通过贝克曼库尔特AU5800全自动生化分析仪测定血清C反应蛋白(C-reaction protein, CRP)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及白介素-6(interleukin-6, IL-6)水平。
三、统计学方法
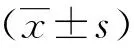
结 果
一、近期疗效及存活质量
观察组治疗有效率43.43%,较对照组的33.66%差异无统计学意义(P>0.05);观察组疾病控制率82.83%,较对照组的69.31%差异有统计学意义(P<0.05),见表1。

表1 两组近期疗效比较[n(%)]
注:与对照组比较,aP<0.05
二、存活质量改善情况
观察组患者存活质量改善率79.80%,较对照组的63.37%差异有统计学意义(P<0.05),见表2。

表2 两组患者存活质量改善情况比较[n(%)]
注:与对照组比较,aP<0.05
三、治疗前后免疫功能T细胞亚群变化
治疗前,两组CD3+、CD4+、CD8+、CD4+/CD8+比较,差异均无统计学意义(P>0.05);治疗后,观察组CD3+、CD4+、CD8+、CD4+/CD8+与治疗前比较无显著差异(P>0.05),而对照组CD3+、CD4+、CD4+/CD8+比治疗前均明显下降,CD8+明显上升,差异有统计学意义(P<0.05);观察组治疗后CD3+、CD4+、CD4+/CD8+明显大于对照组,CD8+明显低于对照组,差异有统计学意义(P<0.05),见表3。
四、治疗前后炎性因子变化
治疗前,两组血清CRP、TNF-α、IL-6水平比较差异均无统计学意义(P>0.05);治疗后,两组血清CRP、TNF-α、IL-6水平较治疗前均明显下降(P<0.05),且观察组上述指标均明显低于对照组(P<0.05),见表4。
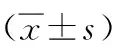
表4 两组治疗前后血清炎性指标比较
注:与同组治疗前比较,aP<0.05;与对照组比较,bP<0.05
五、不良反应情况
观察组白细胞减少、恶心呕吐、血小板减少发生率均明显低于对照组,差异有统计学意义(P<0.05),见表5。

表5 两组药物不良反应比较[n(%)]
注:与对照组比较,aP<0.05
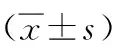
表3 两组治疗前后T细胞亚群指标比较
注:与同组治疗前比较,aP<0.05;与对照组比较,bP<0.05
讨 论
NSCLC与小细胞肺癌(SCLC)为肺癌的两种形式,前者占大多数,两者治疗原则差异明显,其中小细胞肺癌侵袭性强,早期便已远处转移,因此临床不建议手术干预,多选择化疗等非手术治疗方案;NSCLC相比小细胞肺癌侵袭性显著弱,对Ⅲa期及以下者优先选择手术干预,对Ⅲa期以上者考虑化疗等非手术治疗方案[11]。GP方案被认为是治疗晚期NSCLC的主要方式,其中顺铂通过与DNA链内、链间联结可破坏DNA功能,阻断其复制,发挥抗癌作用[12-13];吉西他滨对DNA修复有一定的抑制作用,联合顺铂可增强抗癌作用。本研究结果显示对照组经GP化疗2周期后有效率33.66%,与观察组的43.43%无显著差异,可见GP化疗有一定的疗效,且康莱特注射液并不能显著提高有效率,可能与GP抗癌作用较强有关。本研究发现加以康莱特注射液治疗后患者疾病控制率及存活质量改善率比单纯GP化疗显著高,与相关报道结果相符[14-15]。分析其原因:GP化疗方案会对患者免疫功能造成不同程度的影响,易发生骨髓抑制、恶心呕吐等不良反应,增加患者痛苦的同时可能影响其耐受性及用药依从性,最终造成患者存活质量下降;而康莱特注射液能有效改善机体免疫功能,提高化疗耐受性,减轻化疗不良反应。本研究观察组白细胞减少、恶心呕吐、血小板减少发生率均低于对照组也证实了这一点。
近年来中医药在恶性肿瘤辅助化疗中应用较多,研究表明参芪扶正注射液、艾迪注射液及康莱特注射液均能有效控制NSCLC进展,且能减轻放化疗不良反应,促进患者生活质量提升[16]。有研究对康莱特注射液治疗NSICLC疗效及安全性进行系统评价,表明相比单纯化疗,联合康莱特注射液治疗更为安全有效[17-18]。另外关于康莱特注射液治疗安全性方面,研究表明其不良反应少,但合并用药、放疗、合并其他疾病均可能影响康莱特注射液用药的安全性[19]。康莱特注射液主要中药成分为薏苡仁,其性甘,微寒,入脾、胃、肺经,具有健脾止泻、益气养阴、清热渗湿等功效。药理学及相关临床研究表明,康莱特注射液可诱导肿瘤细胞凋亡,对肿瘤细胞G2/M期起作用以阻断肿瘤细胞有丝分裂,且对癌基因表达、细胞因子有一定的抑制作用,抗癌作用明显,能有效控制肿瘤生长及转移[20-21]。康莱特注射液还可激活白介素-2、NK细胞活性,增强巨噬细胞吞噬能力,促患者免疫功能改善[22]。邓新娜等[23]研究表明相比单纯GP化疗治疗,联合康莱特注射液治疗能保护晚期NSCLC患者免疫功能。钱文军等[24]研究发现康莱特注射液不仅能明显提高GP治疗NSCLC患者的总有效率,显著降低恶心呕吐发生率,而且能明显改善患者的免疫功能及生活质量。鲁小敏等[25]通过与多西他赛+顺铂化疗方案比较,发现联合康莱特注射液治疗虽然并未明显提高NSCLC患者疾病控制率及总有效率,但其能明显减轻化疗毒副反应,增强机体免疫功能。
目前公认免疫功能与肿瘤发生、发展密切相关,特别是细胞免疫功能抑制肿瘤细胞[26]。细胞免疫在抗肿瘤免疫过程中发挥关键作用,而T淋巴细胞主要由骨髓淋巴样干细胞产生,在胸腺中发育成熟后转移到外周血液循环,其比例在外周血淋巴细胞中占70%左右,被认为是免疫应答最强细胞,参与免疫调节、靶细胞杀伤等过程。T细胞不同发育时期,细胞膜始终存在部分相对稳定的分子标记,如CD3+、CD4+、CD8+等。其中CD3+在T细胞信号传导中发挥作用;CD4+属于辅助T细胞识别抗原受体,对肿瘤细胞可直接杀伤,且有免疫记忆功能,于细胞免疫过程中发挥至关重要的作用;CD8+主要参与病毒及肿瘤细胞杀伤,对体液免疫发挥介导作用;CD4+/CD8+比值被认为是免疫功能评价的重要指标,反映免疫系统的平衡,当平衡被打破时机体免疫功能则会降低[27]。本研究结果显示单纯GP化疗后晚期NSCLC患者免疫功能有所下降,而康莱特注射液联合GP治疗后患者CD3+、CD4+、CD4+/CD8+均显著比单纯GP治疗高,提示康莱特注射液对晚期NSCLC患者免疫功能有一定的保护作用,这与朱佳佳等[28]研究结果相符一致。
受肿瘤细胞炎性因子、患者严重应激反应等影响,肿瘤患者机体多处于高炎症状态,除了促肿瘤生长外,还可能导致患者出现焦虑、抑郁等不良情绪。临床检测肺癌特异性炎症因子包括CRP、IL-6、TNF-α,其中CRP为急性时相因子,感染、手术创伤等发生后短时间内其水平显著上升,而病情改善后CRP水平又快速下降。临床上恶性肿瘤患者CRP水平大多数上升,可作为肿瘤治疗效果及预后评估重要指标。有研究认为CRP对肺癌早期诊断、预后评估有重要作用[29];IL-6为临床常见细胞因子,T淋巴细胞、巨噬细胞、相关瘤细胞等均可产生IL-6,它可诱导CRP产生,同时IL-6可刺激参与免疫反应的细胞增殖及分化;TNF-α主要由单核/巨噬细胞产生,对肿瘤细胞有杀伤及抑制作用,且其可诱导正常细胞产生IL-6。本文结果显示相比单纯GP治疗,加用康莱特注射液治疗后机体血清CRP、IL-6、TNF-α水平显著低,与金建江等[30]结果基本一致,表明康莱特注射液对患者机体肿瘤细胞活性有一定的抑制作用,可改善肿瘤细胞生存环境,降低炎性因子水平。
综上所述,康莱特注射液联合GP治疗晚期NSCLC疗效较好,能有效减少化疗相关不良反应,明显减轻机体炎性反应,改善机体免疫功能及存活质量。但本研究也存在一定的不足,未分析其远期疗效,尚需通过延长观察时间作进一步分析。
参 考 文 献
1 El-Hadaad HA, Wahba HA, Roshdy S. Concomitant chemoradiotherapy with Cisplatin plus 5-Fluorouracil for anal squamous cell carcinoma[J]. J Gastrointest Cancer, 2015, 46(2): 156-160.
2 徐丽娟, 刘华, 李进, 等. 埃克替尼和吉非替尼一线治疗晚期非小细胞肺癌患者的疗效观察[J]. 湖南师范大学学报(医学版), 2015, 12(6): 94-96,97.
3 Hassan R, Kindler HL, Jahan T, et al. Phase Ⅱ clinical trial of ama-tuximab, a chimeric antimesothelin antibody with pemetrexed and cisplatin in advanced unresectable pleural mesothelioma[J]. Clin Cancer Res, 2014, 20(23): 5927-5236.
4 陈伟伟, 雷励, 蔡少华, 等. 康莱特注射液联合化疗治疗晚期非小细胞肺癌的临床疗效[J]. 现代生物医学进展, 2015, 15(20): 3869-3871, 3885.
5 余蕊, 叶赟, 申光富, 等. 康莱特注射液对非小细胞肺癌的疗效及对T淋巴细胞亚群的影响[J]. 世界中医药, 2016, 11(10): 1997-2001.
6 杨卫京. 康莱特注射液联合埃克替尼治疗非小细胞肺癌的临床研究[J]. 现代药物与临床, 2016, 31(12): 1984-1987.
7 杭猛, 陈暑波, 孙清, 等. GP方案联合康莱特注射液治疗晚期非小细胞肺癌的疗效及安全性分析[J]. 实用癌症杂志, 2017, 32(2): 289-291.
8 姚俊, 宋晓. 吉西他滨和顺铂方案联合康莱特注射液治疗晚期非小细胞肺癌的临床分析[J]. 临床和实验医学杂志, 2017, 16(12): 1195-1198.
9 Peter G. Staging manual in thoracic onocology[M]. 7th. USA: Orange Park, 2009, 61.
10 Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline(version.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
11 陆舜, 纪文翔, 虞永峰, 等. 2014版《NCCN非小细胞肺癌临床实践指南》更新解读[J]. 中国医师进修杂志, 2015, 38(5): 318-320.
12 Momm F, Kaden M, Tannock I, et al. Dose escalation of gemcitabine concomitant with radiation and cisplatin for nonsmall cell lung cancer: a phase 1-2 study[J]. Cancer, 2010, 116(20): 4833-4839.
13 张军, 贾海威·多西他赛. 顺铂联合放疗治疗局部晚期非小细胞肺癌的疗效观察[J]. 中国基层医药, 2012, 19(14): 2148-2149.
14 刘雪娇. 康莱特联合化疗治疗中晚期非小细胞肺癌临床疗效观察[J]. 临床军医杂志, 2017, 45(3): 265-268.
15 李向东, 董灵. 康莱特注射液联合化疗对晚期非小细胞肺癌生活质量及骨髓抑制的影响[J]. 河北医学, 2016, 22(4): 543-545.
16 吕杨, 刘晓琳, 单探幽, 等. 不同中成药注射剂辅助治疗非小细胞肺癌的对比研究[J]. 中国医院用药评价与分析, 2017, 17(6): 790-791,795.
17 连宝涛, 黄超原, 庄振杰, 等. 康莱特注射液联合放疗用于非小细胞肺癌的系统评价[J]. 中国药房, 2016, 27(12): 1634-1637.
18 温海燕, 宋金春. 康莱特注射液联合NP方案治疗晚期非小细胞肺癌有效性和安全性的Meta分析[J]. 医学综述, 2017, 23(19): 3931-3937.
19 何斌, 杨宇飞, 李培红, 等. 康莱特注射液上市后安全性再评价研究[J]. 药物不良反应杂志, 2017, 19(3): 187-194.
20 姚德蛟. 康莱特联合吉西他滨、顺铂治疗晚期非小细胞肺癌的临床疗效及安全性评价[J]. 中国临床药理学杂志, 2015, 31(15): 1494-1496.
21 黄挺, 陈震, 杨雪飞, 等. 康莱特注射液抗恶性肿瘤肝转移疗效及机制的实验研究[J]. 中国现代应用药学, 2008, 25(1): 12-15.
22 王玉娟. 康莱特注射液联合新辅助化疗方案治疗肺癌的疗效及其对细胞凋亡和增殖的影响[J]. 广西医科大学学报, 2017, 34(2): 218-221.
23 邓新娜, 赵淑芳, 赵海静, 等. 康莱特注射液对晚期非小细胞肺癌化疗患者免疫功能的影响[J]. 现代中西医结合杂志, 2014, 23(34): 3767-3769, 3773.
24 钱文军, 沈冬. 康莱特注射液联合化疗治疗非小细胞肺癌及对患者T淋巴细胞亚群的影响[J]. 中国老年学杂志, 2015, 35(4):1079-1080,1081.
25 鲁小敏, 张燕, 吉浩明, 等. 康莱特注射液联合化疗对晚期非小细胞肺癌疗效及免疫功能的影响[J]. 江苏医药, 2016, 42(9): 1068-1070.
26 Liu CY, Xie WG, Wu S, et al. A comparative study on inflammatory factors and immune functions of lung cancer and pulmonary ground-glass attenuation[J]. Eur Rev Med Pharmacol Sci, 2017, 21(18): 4098-4103.
27 Nishikawa H, Kato T I, Ikeda H, et al. IFN-gamma Controls the Generation/Activation of CD4+CD25+Regulatory T Cells in Antitumor Immune Response[J]. J Immunol, 2005, 175(7): 4433-4440.
28 朱佳佳, 尤寅骏. 康莱特注射液联合GP方案对晚期非小细胞肺癌患者免疫功能的改善作用[J]. 河南中医, 2016, 36(11): 1943-1945.
29 吕艳玲, 袁冬梅, 金淑贤, 等. 非小细胞肺癌患者癌胚抗原、C反应蛋白表达水平与预后的关系[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(2): 140-144.
30 金建江, 胡启擂, 邱滔, 等. 康莱特注射液联合吉非替尼对晚期肺癌患者炎性因子与免疫功能的影响[J]. 中国生化药物杂志, 2016, 36(12): 147-150.

