腹腔镜胰十二指肠切除术的血管解剖与手术径路分析
姜翀弋,王 巍
(复旦大学附属华东医院,上海,200040)
腹腔镜手术以其显著的微创优势已在胃肠外科得到广泛应用,但腹腔镜技术在胰腺外科的应用发展始终较缓慢。1994年,Gagner等报道了首例腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD),截至1997年共完成10例,但因手术时间长、中转开腹率高、并发症发生率高而受到广泛质疑[1]。近十年,随着腹腔镜技术水平的提高及手术器械的进步,LPD在国内外少数大型胰腺医疗中心得到开展,其安全性、可行性也已得到证实[2]。但由于胰头十二指肠区域血管丰富,解剖层面复杂,腹腔镜手术对出血控制要求很高,术中突发难以控制的血管性出血往往成为LPD成功开展的最大障碍。因此熟悉胰头十二指肠区域的血管解剖知识,掌握正确的解剖分离平面,对安全开展LPD尤为重要。结合腹腔镜操作特点与胰十二指肠切除术的手术流程,LPD涉及的解剖分离部位可分为四个区域:(1)胰腺上区;(2)胰腺下区;(3)胰头十二指肠背侧区;(4)胰腺钩突区。本文将依次阐述各区域相关的血管解剖与手术径路。
1 胰腺上区
1.1 肝总动脉的解剖显露 胰腺上缘分布肝总动脉、腹腔干、脾动脉、胃左动脉等上腹部最重要的动脉血管。其中肝总动脉是胰腺上区重要的解剖标志。打开胃结肠韧带进入小网膜囊,显露胰腺后,于胰体上缘与肝脏面之间紧贴胰体上缘切开肝胰襞,进入胰体上后方的胰后间隙,即能定位、发现肝总动脉。沿肝总动脉向右解剖,可依次显露胃十二指肠动脉、肝固有动脉。胰腺上区另一个解剖路径是可于胃窦胰头间隙先找到胃十二指肠动脉,再沿此动脉上行显露肝总动脉与肝固有动脉。由肝总动脉、胃十二指肠动脉及胰腺上缘构成的三角形区域称为胰上三角,其深面为门静脉胰上段,此处门静脉表面与胰下肠系膜上静脉贯通形成胰颈后隧道。
1.2 肝十二指肠韧带的解剖 在明确肝总动脉与胃十二指肠动脉后,继续向右向头侧打开肝十二指肠韧带表面浆膜,可方便地显露肝固有动脉。需注意的是,有25%的人群存在肝动脉变异。肝动脉变异可分为替代肝动脉与副肝动脉两种类型。前者指变异肝动脉完全替代正常同名肝动脉;后者指正常肝动脉存在,变异肝动脉只参与正常同名肝动脉分布区域内一部分血供。Hiatt等[3]将肝动脉分为6型:(1)正常,占75.7%;(2)替代或副肝左动脉,占9.7%;(3)替代或副肝右动脉,占10.6%;(4)替代或副肝右动脉+替代或副肝左动脉,占2.3%;(5)肝总动脉来源于肠系膜上动脉,占1.5%;(6)肝总动脉来源于腹主动脉,占0.2%。解剖分离肝固有动脉时,一旦发现肝左或肝右动脉缺如,应考虑变异可能,此时应在肝胃韧带内探寻替代左肝动脉或在肝十二指肠韧带右侧探寻变异右肝动脉。如术中误伤替代肝动脉,可能造成肝脏缺血坏死及脓肿形成,胆肠吻合口也较容易发生吻合口瘘或狭窄。CT血管造影对肝动脉变异的诊断准确率可达98.5%,因此LPD术前应常规行CT血管造影,以明确肝动脉分布类型,指导术中肝动脉的解剖分离。
离断胃十二指肠动脉后,沿胰上三角深面的门静脉表面疏松结缔组织向肝十二指肠韧带分离,可完全打开门静脉前间隙,确保肝固有动脉周围淋巴结的彻底清扫。门静脉前方一般无血管汇入,但约有39%的胃左静脉可由肝固有动脉背侧由左向右汇入门静脉左侧壁[4]。因此沿肝固有动脉左侧清扫时,尤应留意其背侧有无胃左静脉。一旦误伤,由于此时门静脉尚未被完全显露,胃左静脉的血管破口又被肝固有动脉遮挡,镜下很难控制出血,甚至被迫中转开腹。
2 胰腺下区
肠系膜上静脉位于胰腺下缘的胰后间隙内,其左缘与胰腺下缘交点为胰颈的解剖标志。探寻肠系膜上静脉并沟通胰颈背侧隧道是胰腺下区手术操作的主要目标。腔镜手术中一般沿胰腺下缘向右侧胰头钩突方向解剖寻找肠系膜上静脉,也可沿中结肠静脉寻找。肠系膜上静脉于胰颈后上行,与脾静脉汇合成门静脉。胰颈背侧与肠系膜上静脉-门静脉间为无血管区,因此,不论开放手术抑或腔镜手术,均可沿此间隙贯通胰腺上下缘。患者多可于肠系膜上静脉与脾静脉的夹角处发现肠系膜下静脉汇入。于胰腺下缘沿肠系膜上静脉表面向右侧分离,可显露胃结肠静脉干。此静脉干由Henle于1868年提出,沿胰头下方走行,于肠系膜上静脉右外侧或右前方汇入[5]。胃结肠静脉干属支构成复杂,以右结肠静脉、胃网膜右静脉及胰十二指肠前上静脉三支合干而成最为多见[5-6];胃结肠静脉干缺失的患者,胰十二指肠前上静脉可直接汇入胃网膜右静脉,术中常见胃网膜右静脉较粗大,且右结肠静脉单独注入肠系膜上静脉[5]。由于胃结肠静脉干短小且壁薄,LPD术中分离结扎时操作应轻柔,避免静脉壁撕裂出血。
3 胰头十二指肠背侧区
打开胰十二指肠筋膜延伸至十二指肠外侧的腹膜后,即可进入Treitz筋膜平面(Kocher切口)。Treitz筋膜平面为位于胰后筋膜与肾前筋膜间的疏松无血管区,前界为胰头十二指肠,后界为右肾前筋膜、下腔静脉,内侧界为腹主动脉,外侧界为肝脏与十二指肠上部。经此疏松无血管平面可顺利游离胰头十二指肠,并清晰显露其深面的下腔静脉、左肾静脉、右肾动脉及腹主动脉。在左肾静脉汇入下腔静脉的上夹角可发现肠系膜上动脉自腹主动脉发出,向头侧分离1 cm,可发现腹腔干自腹主动脉发出。
Treitz筋膜平面充分显露肠系膜上动脉根部,并进行钩突系膜的薄层化处理是LPD术中最重要的技术环节之一[7]。镜下做扩大Kocher切口至肠系膜上静脉右侧十二指肠水平段,依次游离十二指肠、胰头及周围淋巴脂肪组织,将标本向左侧翻起,显露胰头十二指肠后方的下腔静脉、左肾静脉、腹主动脉。在左肾静脉与下腔静脉上方夹角内找到肠系膜上动脉根部,沿肠系膜上动脉右侧缘用超声刀骨骼化肠系膜上动脉2~3 cm,使连接肠系膜上血管的钩突系膜薄层化。此安全的解剖分离依据是肠系膜上动脉起始段2~3 cm内无重要血管分支。需注意的是术前CT阅片应注意此区域内有无变异肝动脉。经此步骤可使胰腺钩突系膜组织变薄,仅包含胰十二指肠下血管及肠系膜上静脉部分小分支,保证后续钩突处理的安全施行。
4 胰腺钩突区
Gockel等[8]最早于2007年提出“胰腺系膜”的概念。2012年Adham等[9]将胰腺系膜的解剖概念细化为“胰腺系膜三角”,其前界为肠系膜上静脉-门静脉后壁,内界为肠系膜上动脉及腹腔干右缘,后界为主动脉表面。临床上常将上述胰腺系膜称为胰腺钩突系膜。钩突系膜内包含肠系膜上静脉-门静脉与肠系膜上动脉发出的营养胰头、钩突的血管,因此处理钩突系膜时容易发生难以控制的大出血,导致手术失败[10]。胰腺钩突系膜处理始终是LPD最主要的技术难点,也是LPD与腹腔镜胃癌根治术最本质区别的技术环节[10]。
LPD术中处理钩突系膜时,首先按前述扩大Kocher切口的方法骨骼化肠系膜上动脉右侧壁,使钩突系膜薄层化,再按腹腔镜“由下至上”的操作原则,由足侧开始沿钩突系膜向头侧分离[7],如此步骤,可安全离断钩突系膜[11]。具体操作中,助手向左侧牵开肠系膜上静脉,即可显露肠系膜上动脉鞘,此时可见仅有薄薄的一层系膜组织附着于肠系膜上血管之上。由足侧开始离断钩突系膜时,首先遇到的是胰十二指肠下静脉,可汇入肠系膜上静脉或第一支空肠静脉[6]。在助手向左侧牵拉翻转肠系膜上静脉时常导致第一支空肠静脉同时被翻转至右侧,因此分离离断胰十二指肠下静脉时,应注意保护第一支空肠静脉。紧邻胰十二指肠下静脉头侧的为胰十二指肠下动脉,可单独作为肠系膜上动脉的第一分支,由距肠系膜上动脉起点2~5 cm处发出,或与第一支空肠动脉以共干形式自肠系膜上动脉后侧或左侧壁发出[12]。同样,离断胰十二指肠下动脉时,应避免误伤第一支空肠动脉从而导致近端空肠缺血。胰十二指肠上后静脉是胰头最大的回流静脉,于肠系膜上静脉-脾静脉汇合处上方1.5~3.0 cm处汇入门静脉右后侧壁[13],也是处理钩突系膜时遇到的最后一支血管。除上述三支血管外,钩突系膜其余部分均可使用电能量器械安全离断。采用上述动脉优先入路-钩突系膜薄层化技术处理钩突不仅能降低出血风险,而且也能保证彻底清除肠系膜上动脉右侧的系膜组织,保证手术的根治性。见图1~图6。
综上所述,胰头十二指肠区域血管解剖关系复杂,变异多见,手术又涉及多个解剖层面,总结腹腔镜下胰头十二指肠区域的主要血管分支、走行及相互关系,根据腹腔镜视角与操作特点采取不同于传统开放手术的暴露策略,对减少LPD术中血管损伤、提高手术安全性与根治彻底性具有重要的临床意义。
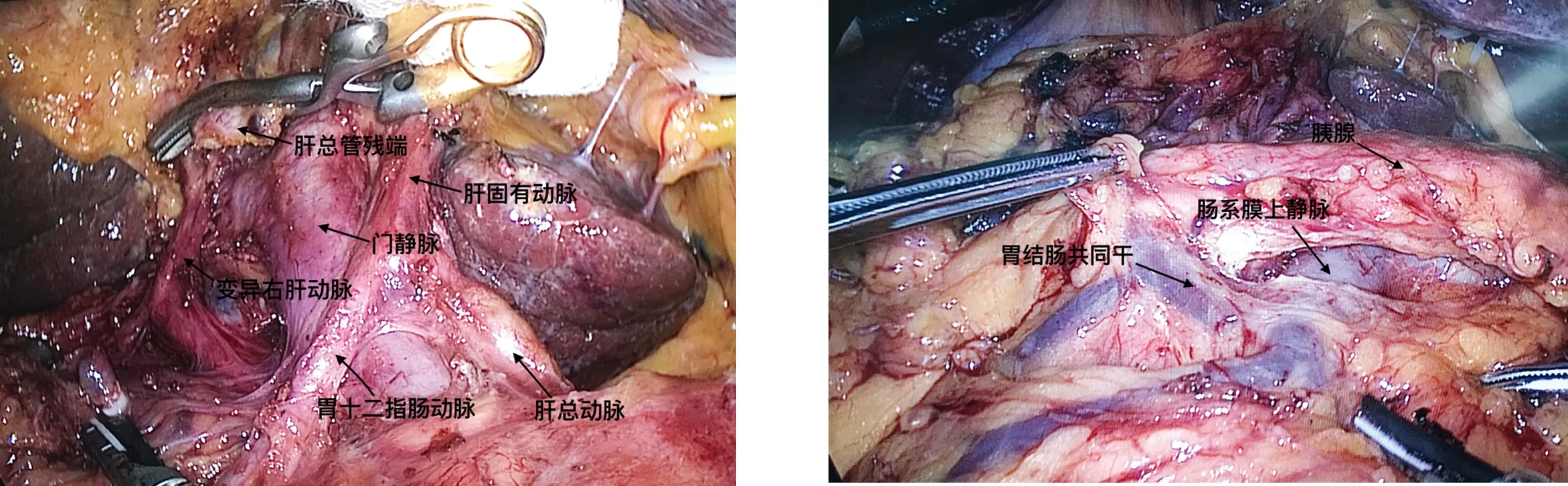
图1 解剖胰腺上区,显露血管结构 图2 显露胰腺下缘肠系膜上静脉及胃结肠共同干
图3 钩突系膜薄层化处理 图4 离断钩突,向左侧推开肠系膜上静脉,显露粗大的第一支空肠静脉

图5 钩突的处理 图6 胰十二指肠上后静脉
参考文献:
[1] Gagner M,Pomp A.Laparoscopic pancreatic resection:Is it worthwhile?[J].J Gastrointest Surg,1997,1(1):20-25.
[2] Umemura A,Nitta H,Takahara T,et al.Current status of laparoscopic pancreaticoduodenectomy and pancreatectomy[J].Asian J Surg,2018,41(2):106-114.
[3] Hiatt JR,Gabbay J,Busuttil RW.Surgical anatomy of the hepatic arteries in 1000 cases[J].Ann Surg,1994,220(1):50-52.
[4] Sakaguchi T,Suzuki S,Morita Y,et al.Analysis of anatomic variants of mesenteric veins by 3-dimensional portography using multidetector-row computed tomography[J].Am J Surg,2010,200(1):15-22.
[5] 赵丽瑛,张策,李国新.胃结肠静脉干解剖学研究的系统评价及其临床意义[J].中国实用外科杂志,2012,32(9):753-757.
[6] Ibukuro K.Vascular anatomy of the pancreas and clinical applications[J].Int J Gastrointest Cancer,2001,30(1-2):87-104.
[7] 王巍,姜翀弋,陈寅涛,等.腹腔镜胰十二指肠切除术钩突部位动脉处理的应用解剖研究[J].中国实用外科杂志,2016,36(2):206-209.
[8] Gockel I,Domeyer M,Wolloscheck T,et al.Resection of the mesopancreas (RMP):a new surgical classification of a known anatomical space[J].World J Surg Oncol,2007,5:44.
[9] Adham M,Singhirunnusorn J.Surgical technique and results of total mesopancreas excision (TMpE) in pancreatic tumors[J].Eur J Surg Oncol,2012,38(4):340-345.
[10] 王巍.胰腺系膜的临床解剖与腔镜下钩突系膜处理方式优化[J].外科理论与实践,2017,22(2):99-102.
[11] 梁赟,王巍,姜翀弋,等.动脉优先入路处理胰腺钩突在腹腔镜胰十二指肠切除术中的应用[J/CD].中华肝脏外科手术学电子杂志,2017,6(1):19-23.
[12] Bertelli E,Di Gregorio F,Bertelli L,et al.The arterial blood supply of the pancreas:a review. III. The inferior pancreaticoduodenal artery.An anatomical review and a radiological study[J].Surg Radiol Anat,1996,18(2):67-74.
[13] Yamada Y,Mori H,Kiyosue H,et al.CT assessment of the inferior peripancreatic veins:clinical significance[J].AJR Am J Roentgenol,2000,174(3):677-684.

